Совершенствование принципов диагностики эндометриоза является одной из приоритетных гинекологических задач в настоящее время, учитывая сохраняющуюся тенденцию к увеличению частоты эндометриоза, трудности в постановке диагноза и отсрочку назначения терапии [1, 2]. Не вызывает сомнения тот факт, что диагностика эндометриоза должна быть комплексной, основанной на опросе пациенток, клиническом обследовании и применении визуальных методов, таких как трансвагинальное ультразвуковое исследование (УЗИ) и магнитно-резонансная томография (МРТ). Многие авторы сходятся во мнении, что адекватная оценка жалоб и тщательный сбор анамнеза имеют важное значение, поскольку могут позволить предположить верный диагноз еще на начальном этапе обследования [3–6]. Согласно клиническим рекомендациям 2022 г., лапароскопия с гистологической верификацией диагноза хотя и является информативным методом обследования, но не абсолютно необходимым для диагностического поиска; ввиду чего на первый план выступают неинвазивные методы обследования [7]. Важно отметить, что «классические» симптомы эндометриоза – дисменорея, диспареуния и хроническая тазовая боль (ХТБ) при бессимптомном течении заболевания могут отсутствовать [8, 9]. Это указывает на необходимость продолжения поиска фенотипических маркеров заболевания и коморбидных состояний, позволяющих выявить женщин группы высокого риска по развитию эндометриоза. В литературе имеются исследования, демонстрирующие связь эндометриоза с рядом заболеваний. Так, например, частота выявления хронического эндометрита значительно выше в группе пациенток с эндометриозом (52,94%), независимо от его формы, по сравнению с группой контроля (27,02%) (p=0,0311) [10]. В ретроспективном когортном исследовании, включавшем 141 460 женщин, было установлено, что у пациенток с воспалительными заболеваниями органов малого таза (ВЗОМТ) риск развития эндометриоза был повышен в 3 раза (ОШ 3,02 [95% ДИ 2,85; 3,2]) [11]. Была установлена взаимосвязь эндометриоза с синдромом раздраженного кишечника (СРК) (ОШ 2,39 [95% ДИ 1,83; 3,11]) [12], интерстициальным циститом (ОШ 3,74 [95% ДИ 1,76; 7,94]) [13], мигренью (ОШ 2,62 [95% ДИ 1,43; 4,79]) [14], хроническим аутоиммунным тиреоидитом (ОШ 11,37 [95% ДИ 6,0; 21,5]) [15], а также с более низким индексом массы тела (ИМТ) [16]. Немаловажным является факт отягощенного семейного анамнеза по эндометриозу; риск возникновения заболевания увеличивается при наличии его у сиблингов [17, 18]. Кроме того, имеются данные, что увеличение числа симптомов повышает вероятность диагностирования заболевания [19]. Однако все еще отсутствует комплексный подход к оценке рисков развития эндометриоза.
Таким образом, целью настоящего исследования является анализ клинических характеристик и сопутствующих заболеваний у пациенток с эндометриозом для определения значимости коморбидности в его выявлении.
Материалы и методы
В одномоментное исследование были включены 220 женщин в возрасте от 18 до 45 лет. Основную группу составили 110 пациенток (средний возраст 29 (25; 36) лет, средний ИМТ – 20,7 (19,37; 22,49) кг/м2) с наличием наружного генитального эндометриоза (НГЭ), в группу сравнения – 110 женщин (средний возраст 27 (26; 32) лет, средний ИМТ – 22,31 (20,07; 23,92) кг/м2), сопоставимых по возрасту с основной группой (р>0,05) с отсутствием генитального эндометриоза. Критерием включения в исследование для основной группы являлось наличие НГЭ, верифицированного по данным экспертного УЗИ и МРТ органов малого таза, для группы сравнения – отсутствие признаков эндометриоза по УЗИ, а также МРТ или результатам ранее проведенного оперативного вмешательства. Для обеих исследуемых групп проводился сбор клинических данных путем опроса и анкетирования, а наличие сопутствующей патологии определялось на основании соответствующих лабораторных и инструментальных методов исследования согласно клиническим рекомендациям Минздрава России [20]. Критериями исключения для обеих групп являлись: онкологические заболевания женской репродуктивной системы в настоящий момент (в том числе – подозрение на них) и в анамнезе; беременность и лактация; прием гормонотерапии в течение 3 месяцев, предшествующих включению в исследование. С целью уменьшения вероятности систематической ошибки из группы сравнения были исключены пациентки не только с эхографическими признаками НГЭ, но также с аденомиозом любой степени распространенности и экстрагенитальным эндометриозом. Семейный анамнез по эндометриозу оценивали как наличие заболевания по 1-й линии родства, а также у бабушки по материнской линии. СРК определялся согласно Римским критериям IV пересмотра [21], мигрень – на основании данных опросника ID Migraine при наличии 2 и более положительных ответов [22]. Клиническая гиперандрогения устанавливалась при выявлении акне и/или гирсутизма. Тестирование на наличие вируса папилломы человека (ВПЧ) и вируса простого герпеса проводилось только у женщин, живущих половой жизнью. Степень выраженности дисменореи, диспареунии и ХТБ оценивалась по 11-балльной визуальной аналоговой шкале (ВАШ). У пациенток virgo показатель диспареунии по ВАШ не учитывался в расчетах. ХТБ определялась как ациклическая боль в области малого таза, не связанная с менструацией или половым актом, длительностью 6 и более месяцев. Перед проведением анализа клинического материала все данные были полностью обезличены. Исследование проводилось на базе ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» в период с 2021 по 2022 гг. и одобрено этическим комитетом. Учитывая относительно небольшой размер выборки (представлены результаты промежуточного анализа), на данном этапе не представлялось возможным оценить зависимость клинической манифестации от формы эндометриоза; этот анализ будет сделан в перспективе.
Статистический анализ
Статистический анализ производили с использованием программы SPSS (IBM Statistical Package for the Social Sciences, 26 версия). Расчет объема выборки проводился на основании частоты распространенности дисменореи как наиболее значимого клинического проявления эндометриоза [7, 19], что при уровне значимости в 5% и мощности 95% составляет 63 женщины. С учетом вышеизложенного, а также принимая во внимание потенциально меньшее количество исследуемых женщин для ряда параметров (диспареунии, ВПЧ и др.), данная выборка является достаточной для проведения исследования. Группа сравнения была подобрана по принципу 1:1. Для количественных показателей были рассчитаны: среднее значение (М), среднеквадратическое отклонение (SD), 95% ДИ, медиана (Ме), интерквартильный интервал (Q1; Q3). Для качественных и порядковых показателей – частоты (%). Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Числовые параметры, имеющие нормальное распределение, представлены в формате М (SD), где М – среднее значение, SD – стандартное отклонение среднего значения. Параметры, имеющие распределение, отличное от нормального, представлены в формате Ме (Q1; Q3). Для нахождения различий между группами пациентов применяли попарное сравнение групп c помощью непараметрического метода U-критерия Манна–Уитни (для количественных показателей) и точного критерия Фишера (для категориальных показателей). Для оценки порогового значения балла дисменореи, ХТБ и диспареунии использовался ROC-анализ по максимальному индексу Юдена (Se+Sp)-1 для каждого из параметров. Для получения численного значения клинической значимости теста, а также для сравнения двух тестов используется показатель AUC (Area Under Curve, или площадь под кривой) с указанием доверительного интервала, cудить о качестве теста можно по экспертной шкале для значений AUC. Для сравнения вероятности исхода в зависимости от наличия фактора риска использовался такой показатель, как относительный риск. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
В структуре НГЭ изолированный перитонеальный эндометриоз был диагностирован у 52/110 женщин (47,3%), эндометриомы – у 22/110 (20%). Глубокий эндометриоз был верифицирован у 36/110 женщин (32,7%); у 22/36 (61,1%) из них он сочетался с двумя другими формами; у каждой 4-й пациентки – с экстрагенитальным эндометриозом (у 8/36 (22,2%) – колоректальный, у 1/36 (2,8%) – эндометриоз мочевого пузыря). В 89/110 случаях (80,9%) НГЭ сочетался с диффузной формой аденомиоза, в 8/110 (7,3%) – с диффузно-узловой формой. Ранее 65/110 женщин (56,4%) получали гормонотерапию, 36/110 (32,7%) были оперированы по поводу эндометриоза, из них 8/36 (22,2%) – неоднократно.
Проведенный анализ клинико-анамнестических данных показал, что пациентки с эндометриозом характеризовались более низким ИМТ, чем женщины группы сравнения (20,7 (19,37; 22,49) кг/м2 против 22,31 (20,07; 23,92) кг/м2, р<0,01). Приблизительно у каждой 5-й пациентки с эндометриозом ИМТ был менее 18,5 кг/м2, у каждой 2-й – менее 21 кг/м2. Как видно из данных, представленных в таблице 1, у пациенток с эндометриозом дефицит массы тела встречался примерно в 2 раза чаще, а избыток массы тела – в 2 раза реже (табл. 1).
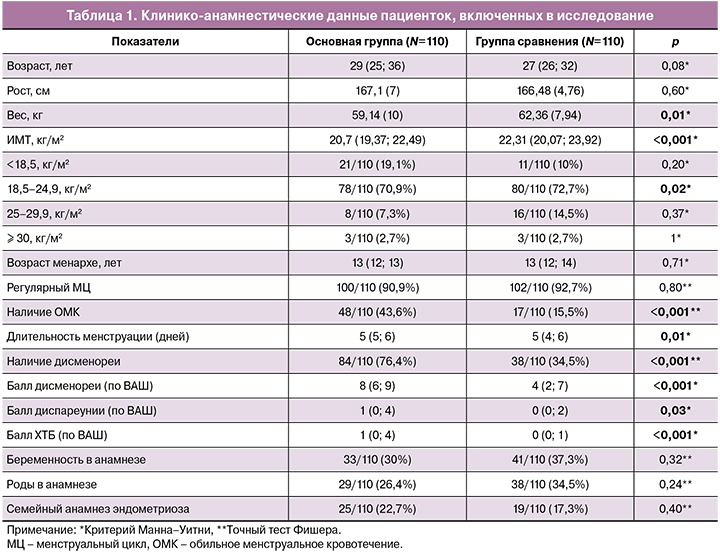
При оценке клинических данных было установлено, что для пациенток с эндометриозом характерны более обильные, длительные и болезненные менструации. Интенсивность дисменореи, диспареунии и ХТБ статистически значимо различалась между двумя исследуемыми группами (табл. 1). При учете пороговых значений было установлено, что для дисменореи этот показатель составил 5,5 баллов по ВАШ (чувствительность 76,4%, специфичность 65,5%, AUC 0,76 [95% ДИ 0,70; 0,83]), для ХТБ – 1,5 балла (чувствительность 49,1%, специфичность 91,8%, AUC 0,67 [95% ДИ 0,60; 0,74]), для диспареунии – 2,5 балла (чувствительность 40,8%, специфичность 88,4%, AUC 0,58 [95% ДИ 0,50; 0,65]) (p<0,001) (рисунок).
Для подтверждения целесообразности определения баллов ВАШ для диагностики эндометриоза были проанализированы две группы пациенток. Первая группа включала в себя женщин, у которых наличие болевого синдрома определялось при его интенсивности, превышающей рассчитанные пороговые значения. Во вторую группу входили женщины, у которых не учитывались баллы ВАШ, а только факт наличия или отсутствия боли при их субъективной оценке. Так, с учетом рассчитанных пороговых значений, дисменорея наблюдалась у 84/110 женщин с эндометриозом (76,4%) и 38/110 женщин группы сравнения (34,5%), без учета пороговых значений – у 108/110 (98,2%) и 101/110 (91,8%), соответственно; диспареуния – у 40/98 (40,8%) и 21/97 (21,6%) с учетом и 50/98 (51%) и 42/97 (43,3%) без учета пороговых значений, соответственно; ХТБ – у 54/110 (49,1%) и 20/110 (18,2%) учитывая и 63/110 (57,3%) и 32/110 (29,1%) – не учитывая, соответственно. Таким образом, определение балла ВАШ позволяет не только повысить вероятность диагностирования эндометриоза, но и исключить возможные ложноположительные результаты при субъективном опросе пациенток. Наибольшая клиническая значимость отмечалась при совместной оценке характеристик болевого синдрома с учетом установленных пороговых значений. Сочетание дисменореи и диспареунии у пациенток с эндометриозом встречалось в 3 раза чаще, чем в группе сравнения (33/98 (33,7%) и 13/97 (13,4%) (ОР 1,64 [95% ДИ 1,27; 2,13]); сочетание диспареунии с ХТБ – в 3,5 раза чаще (24/98 (24,5%) и 7/97 (7,2%) (ОР 1,72 [95% ДИ 1,33; 2,21]); сочетание дисменореи с ХТБ – в 5 раз чаще (51/110 (46,4%) и 10/110 (9,1%; ОР 2,25 [95% ДИ 1,79; 2,84]); всех 3 показателей болевого синдрома – в 6 раз чаще (24/98 (24,5%) и 4/97 (4,1%) соответственно) (ОР 1,93 [95% ДИ 1,54; 2,43]), а риск эндометриоза возрастал в 2 раза.
При оценке экстрагенитальной патологии, обращала на себя внимание значительная разница между группами (табл. 2). Так, фиброзно-кистозная болезнь (ФКБ) встречалась примерно у каждой 3-й пациентки с эндометриозом, что в 2,5 раза чаще, чем в группе сравнения, а мигрень, СРК и хронический цистит – у каждой 4-й женщины основной группы и в 2 раза чаще соответственно; однако статистически значимой разницы между группами выявлено не было. Клиническая гиперандрогения наблюдалась у 66/110 (60%) пациенток с эндометриозом, в группе сравнения – в 2 раза реже. В основной группе акне встречалось в 3 раза чаще (у каждой 3-й женщины).
Данные по сравнительной оценке частоты выявления сопутствующих гинекологических заболеваний представлены в таблице 3. При эндометриозе обращала на себя внимание большая частота встречаемости ВПЧ (40/96 (41,7%) в основной группе и 22/97 (22,7%) в группе сравнения), полипов эндометрия (ПЭ) (23/110 (20,9%) и 6/110 (5,5%)) и миомы матки (26/110 (23,6%) и 9/110 (8,2%)). Рецидивирующие функциональные кисты яичников (ФКЯ) встречались у каждой 2-й пациентки с эндометриозом, апоплексия яичников – у каждой 5-й, что значительно чаще, чем в группе сравнения. Несмотря на то что генитальный герпес, ВЗОМТ и параовариальные кисты встречались в 2–3 раза чаще у пациенток с эндометриозом, статистически значимой разницы между группами получено не было.
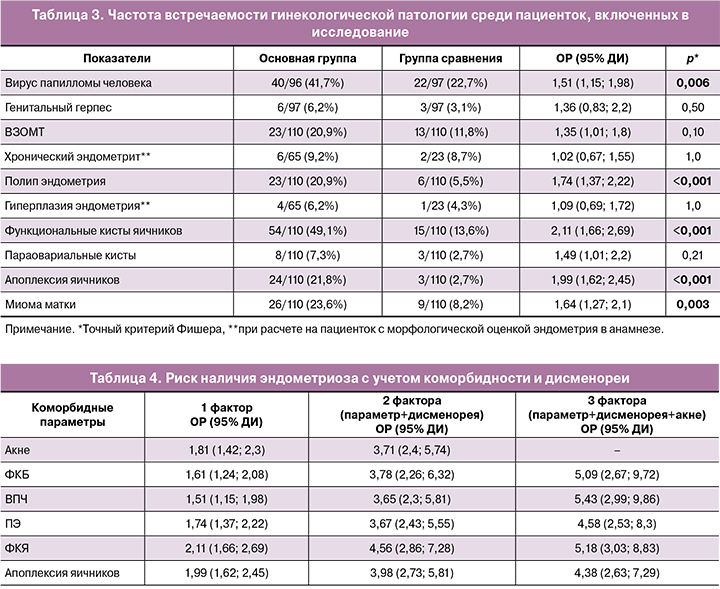
С целью оптимизации ранней диагностики эндометриоза, на основании всех имеющихся данных по коморбидности, была создана таблица стратификации риска заболевания на основе данных 6 параметров, обладающих достоверной статистической значимостью, а также дисменореи как наиболее важного клинического симптома эндометриоза (табл. 4). Для расчета ОР за «наличие» фактора риска принималось наличие всех факторов (для балла дисменореи использовалось значение ≥5,5 (см. результаты ROC-анализа)), за «отсутствие» фактора риска – отсутствие всех факторов (для балла дисменореи использовалось значение <5,5). Как видно из таблицы 4, при сочетании коморбидных состояний возрастает риск наличия эндометриоза. Так, например, ВПЧ увеличивает вероятность наличия эндометриоза в 1,5 раза, при сочетании этого признака с дисменореей риски возрастают до 3,7 раза, а в совокупности этих признаков с акне – до 5,5 раза. Схожая тенденция прослеживается для ФКБ и ФКЯ: риски увеличивались с 1,5 до 5 для ФКБ и с 2 до 5 – для ФКЯ. Сопоставимые результаты получены для показателей ПЭ и апоплексии. Однако сочетание более 3 признаков лишь незначительно повышало риски наличия эндометриоза либо не могло быть рассчитано, что, вероятно, связано с не столь большой выборкой пациенток.
Обсуждение
Настоящее исследование, посвященное роли коморбидности в диагностике эндометриоза, показало, что адекватная оценка жалоб и данных анамнеза, а также визуального осмотра позволяет уже на начальном этапе обследования выявить группу женщин с высоким риском по развитию данного заболевания. Полученные данные свидетельствуют о том, что клиническая гиперандрогения, в частности наличие акне, является достаточно простым для диагностики и вместе с тем значимым коморбидным состоянием при эндометриозе. Так, согласно результатам исследования, клиническая гиперандрогения регистрировалась в 2 раза, акне – в 3 раза чаще при эндометриозе. Данные крупного исследования, проведенного в Корее, свидетельствуют о пятикратном повышении частоты акне у пациенток с эндометриозом в сравнении с контролем [23]. По другим публикациям, риск возникновения эндометриоза увеличивается в 2 раза при наличии акне тяжелой степени в подростковом возрасте [24, 25]. Известно, что после 25 лет частота акне прогрессивно снижается. Однако, результаты проведенного исследования показали, что среди пациенток с эндометриозом в возрасте 25 лет и старше частота акне оставалась достаточно высокой (15/47 (31,9%) в возрасте от 25 до 34 лет против 8% общепопуляционных и 9/40 (22,5%) в возрасте от 35 до 44 лет против 3% общепопуляционных [26]). Несмотря на сопряженность эндометриоза и акне, механизмы взаимосвязи этих состояний окончательно не установлены. Вместе с тем известно, что генные последовательности, отвечающие за развитие акне и эндометриоза, располагаются на соседних локусах хромосомы 8q24. Ввиду чего можно предположить сцепленное наследование обоих признаков [27]. Однако в генезе эндометриоза и акне, вероятно, играют роль не только генетические факторы, но также хроническое воспаление и изменения состава микробиоты, что требует продолжения исследований в данном направлении.
Результаты проведенного исследования показали, что для пациенток с эндометриозом характерны не только акне, но и более низкие значения ИМТ. Так, у каждой 5-й женщины с эндометриозом выявлен дефицит массы тела; в то время как в 2 раза реже, чем в группе сравнения, наблюдался избыток массы тела. В ряде других работ также отмечалась статистически значимая разница между женщинами с эндометриозом и контрольной группой как по ИМТ [28], в том числе – в период полового созревания [29], так и по росту и соматотипу [30]. В настоящее время предложено несколько гипотез, объясняющих более низкие показатели ИМТ при эндометриозе. К наиболее весомым из них можно отнести роль генетических факторов. Установлено, что при эндометриозе повышена экспрессия генов Cyp2r1, Fabp4, Mrc1 и Rock2, связанных с уменьшением массы тела и количества жировой ткани, и снижена экспрессия генов Igfbp1 и Mmd2, ассоциированных с ожирением [31]. В литературе обсуждается также влияние адипокинов, в частности – более высокого уровня лептина [32], возможно, связанного со способностью эндометриоидной ткани к его продукции [33]. Учитывая анорексигенные свойства лептина [34], нельзя исключить, что дополнительная его выработка эктопическим эндометрием может способствовать снижению массы тела и количества жировой ткани.
Хорошо известна ассоциация эндометриоза с рядом эстрогензависимых заболеваний [19]. Эту взаимосвязь подтверждают и результаты проведенного исследования, в рамках которого была установлена коморбидность НГЭ с ФКБ, миомой матки и ПЭ. Обращало на себя внимание повышение частоты ПЭ у пациенток с эндометриозом в 4 раза, в отличие от группы сравнения (ОР 1,74 [95% ДИ 1,37; 2,22]). По данным метаанализа, включавшего 2896 женщин, риск ПЭ у женщин с эндометриозом повышен почти в 3 раза (ОШ 2,81 [95% ДИ 2,48; 3,18]), преимущественно – при 2–4 степени распространенности заболевания [35]. Результаты другого исследования показали, что гистологически верифицированные ПЭ встречаются в 1,5 раза чаще у пациенток с эндометриозом и бесплодием (38,8%) по сравнению с женщинами, страдающими только бесплодием (24,21%) (ОШ 1,992, р<0,001) [36]. Одним из возможных объяснений коморбидности эндометриоза и ПЭ может являться их связь с хроническим воспалением [37, 38]. Кроме того, эти заболевания относят к категории пролиферативных процессов эндо- и миометрия, в генезе которых играет роль повышение пролиферации, опосредованное локальным влиянием эстрогенов [39, 40] и ароматазы [41, 42].
В рамках данного исследования было отмечено 2-кратное повышение частоты выявляемости ВПЧ у пациенток с эндометриозом. В литературе имеются данные, демонстрирующие более высокую чистоту инфицирования ВПЧ высокого онкогенного риска женщин с эндометриомами [43]. Было также установлено, что папилломавирусная инфекция ассоциирована с бесплодием (ОР 1,39 [95% ДИ 1,19; 1,63]), риск повышался при наличии сопутствующего эндометриоза (ОР 1,85 [95% ДИ 1,33; 2,58]) [44]. Однако имеются работы, опровергающие ассоциацию этих двух заболеваний [45]. Следует отметить, что в настоящее время отсутствует патогенетическое обоснование коморбидности ВПЧ и эндометриоза. Возможно, эндометриоз-ассоциированное хроническое воспаление пролонгирует персистенцию ВПЧ, или, как предполагают Oppelt Р. et al., вирусная инфекция может способствовать имплантации эндометриоидной ткани на фоне гиперэстрогении, хронического воспаления и иммунного дисбаланса [46].
Согласно полученным данным, наибольшая взаимосвязь имеется между эндометриозом и ФКЯ, и особенно – между эндометриозом и апоплексией яичников. Как показало проведенное исследование, ФКЯ встречаются у 54/110 (49,1%), апоплексия яичников – 24/110 (21,8%) пациенток с НГЭ, что в 4 и 9 раз чаще, чем в группе сравнения (15/110 (13,6%) и 3/110 (2,4%) соответственно). Результаты ряда других исследований сопоставимы с этими данными и демонстрируют, что ФКЯ встречаются в 3–7 раз чаще у женщин с эндометриозом [19, 23, 47]. Однако ни в одной из этих работ не обсуждалась причина более частого их возникновения при эндометриозе. Что касается апоплексии яичника, в зарубежной литературе имеются немногочисленные данные, представленные преимущественно клиническими случаями возникновения гемоперитонеума при эндометриозе из-за апоплексии эндометриом или кист желтого тела [48, 49]. В отечественной литературе есть публикация, авторы которой указывают, что апоплексия яичника встречается у каждой 5-й пациентки с экстрагенитальным эндометриозом [50]. В 70% случаев апоплексия манифестирует в лютеиновую фазу цикла, характеризующуюся физиологическим усилением кровотока в яичнике [51]. При эндометриозе повышается продукция сосудисто-эндотелиального фактора роста (СЭФР), усиливающего ангиогенез и вызывающего патологическую неоваскуляризацию [52]. Повышение экспрессии СЭФР, а также его рецепторов СЭФРР-1 и СЭФРР-2 обнаруживают в эндотелии сосудов яичника и лютеоцитах желтого тела [53]. Таким образом, атипическая васкуляризация и повышение проницаемости сосудистой стенки могут предрасполагать к кровоизлиянию [54].
Как известно, наиболее частыми жалобами при эндометриозе являются дисменорея, ХТБ и диспареуния. Согласно результатам настоящего исследования, дисменорея наблюдалась у 84/110 (76,4%) пациенток с эндометриозом и 38/110 (34,5%) женщин группы сравнения. Немаловажным является тот факт, что частота дисменореи была сопоставимой в когорте пациенток группы сравнения с лапароскопически исключенным эндометриозом – 8/23 (34,7%). Учитывая достаточно высокую частоту первичной дисменореи (от 17 до 90%) [55], важно отметить, что у пациенток до 30 лет частота дисменореи составила 46/56 (82,1%) в основной группе и 32/74 (43,2%) – в группе сравнения; в то время как в возрастной категории 30 лет и старше ее частота оставалась достаточно высокой у женщин с эндометриозом – 38/54 (70,4%), а в группе сравнения ее значение было ниже в 2,5 раза – 6/36 (16,7%). В реальной клинической практике важное значение имеет не только выявление дисменореи, которую пациентка оценивает субъективно, но также степени ее выраженности, отсутствие тенденции к снижению интенсивности боли с возрастом и сочетание с ХТБ и диспареунией, повышающее риск наличия эндометриоза в 2 раза. Однако дисменорея, хоть и считается основным симптомом эндометриоза, все же не выявляется у 20–30% женщин [9]. Ввиду чего комплексная оценка коморбидности многократно увеличивает шансы на своевременную диагностику эндометриоза. Среди анализируемых признаков наиболее простыми, не требующими проведения дополнительных исследований, помимо дисменореи, являются акне и апоплексия яичников в анамнезе. Первые два признака можно выяснить на первом визите к гинекологу, а последний – по данным медицинской документации. Как оказалось, оценка совокупности двух параметров повышает риск наличия эндометриоза от 1,5 до 2 раз (только дисменорея: ОР 2,6 [95% ДИ 1,83; 3,68], дисменорея в сочетании с апоплексией: ОР 3,98 [95% ДИ 2,73; 5,81], дисменорея в сочетании с ФКЯ: ОР 4,56 [95% ДИ 2,86; 7,28]). Выявление акне имеет существенное значение при сочетании с дисменореей и другими коморбидными состояниями, такими как ФКЯ, ФКБ, ПЭ или ВПЧ. Схожие данные были получены в исследовании Ballard et al., в котором, по аналогии с настоящим исследованием, вероятность выявления эндометриоза повышалась по мере увеличения количества сопутствующих симптомов (1 симптом: ОШ 5,0 [95% ДИ 4,4; 5,7]; 3 симптома: ОШ 22,9 [95% ДИ 19,9; 26,4]) [19], что подтверждает целесообразность комплексного подхода в диагностике НГЭ.
Заключение
Таким образом, результаты проведенного исследования позволяют сделать заключение, что оценка коморбидности и характерных клинических симптомов уже на начальном этапе обследования позволяет выделить группу женщин с высоким риском наличия НГЭ, которых необходимо направлять на дальнейшее обследование. Применение данного подхода в клинической практике в перспективе может способствовать сокращению времени до постановки диагноза и своевременному началу терапии эндометриоза.



