Нарушения ритма сердца плода встречаются с частотой от 0,1 до 5% всех беременностей. В зависимости от частоты сердечных сокращений (ЧСС) фетальные аритмии разделяют на два типа: тахи- и брадиаритмии [1, 2].
Среди всех случаев фетальных нарушений сердечного ритма ведущее место по тяжести последствий для плода и новорожденного занимают злокачественные аритмии, которые встречаются с частотой до 1:5000–20 000 беременностей. Перинатальная смертность при сочетании данной патологии с неиммунной водянкой плода достигает 30% и возрастает до 100% при наличии пороков развития сердца [1–3].
В развитии брадиаритмии плода следует различать фетальные, встречающиеся с частотой до 25%, и материнские (до 75%) факторы. Наибольший интерес представляет изучение влияния материнских факторов на развитие фетальной аритмии и возможности терапевтической коррекции во время беременности [4].
Цель данного исследования: изучение причин возникновения, особенностей течения и исходов беременности при различных формах фетальных брадиаритмий (ФБ).
Материалы и методы
Обследованы 15 беременных с диагностированной ФБ при сроке беременности от 18 до 37 недель, обратившихся в ФГБУ «НМИЦ АГиП им. В.И. Кулакова» с 2018 по 2019 гг. Исследование было одобрено этическим комитетом ФГБУ «НМИЦ АГиП им. В.И. Кулакова». Письменное информированное согласие на участие в исследовании получено.
Критерием включения было наличие ФБ при одноплодной беременности по данным ультразвукового метода исследования (ЧСС менее 110 уд/мин).
Критерии исключения: заболевание матери, исключающее возможность проведения эфферентных методов терапии, иммуноглобулинотерапии и пульс-терапии глюкокортикоидами.
Специальные лабораторные методы исследования включали иммунологическое обследование (Ro/SSA- и La/SSB-антитела, антитела к двуспиральной ДНК (дсДНК), антиядерные антитела); эхокардиографическое исследование плода в динамике; ультразвуковую фетометрию и ультразвуковую допплерометрию плода, антенатальную кардиотокографию, а также консультации смежных специалистов. По показаниям назначались гидроксихлорохин, лечебный плазмаферез, иммуноглобулинотерапия, пульс-терапия глюкокортикостероидами. Проводились динамическая оценка состояния беременной и плода, контроль титров аутоантител в плазме крови матери, по результатам которых решался вопрос о необходимости и целесообразности повторных курсов комплексной терапии.
Статистический анализ
Статистическая обработка полученных данных была выполнена с использованием программы IPM SРSS Statistics, версия 22, и Microsoft Office Excel 2007. Данные представлены в виде среднего арифметического и стандартного отклонения – Мean (SD). Для сравнения групп по качественным бинарным признакам использовали точный критерий Фишера. Для определения нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона. При сравнении групп по количественным данным использовался t-критерий Стьюдента. Статистически значимыми считались различия при уровне значимости p<0,05.
Результаты
 У 6 из 15 (40%) беременных нарушение ритма сердца плода было диагностировано в сроке менее 26 недель беременности, у остальных 9 (60%) – в конце II, начале III триместра беременности, из них в 26% случаев – в сроке более 36 недель беременности.
У 6 из 15 (40%) беременных нарушение ритма сердца плода было диагностировано в сроке менее 26 недель беременности, у остальных 9 (60%) – в конце II, начале III триместра беременности, из них в 26% случаев – в сроке более 36 недель беременности.
В зависимости от степени выраженности ФБ беременные были разделены на 2 группы: I группа – умеренная брадикардия (n=9) с ЧСС плода 86–110 уд/мин и атриовентрикулярной (АВ) проводимостью 1:1, зарегистрированная в ≥27 недель беременности; II группа – тяжелая брадикардия (n=6), зарегистрированная в 18–26 недель, к которой были отнесены все случаи с наличием АВ-блокады (рис. 1).
Возраст обследованных женщин варьировал от 19 до 40 лет и составил в среднем 30,3 (5,3) года: в I группе – 31,3 (5,6) года, во II группе – 28,8 (4,0) года. Статистически значимых различий по возрастному составу между данными группами отмечено не было. Все женщины проживали в одинаковых климатогеографических условиях, преимущественно в центральном федеральном округе. При изучении социально-экономического статуса среди обследованных женщин статистически значимых различий выявлено не было.
Частота аутоиммунных заболеваний была статистически значимо выше во II группе пациенток с тяжелой ФБ (р=0,01) (табл. 1). При этом у 4 из 6 (66,6%) беременных с тяжелой ФБ был диагностирован дебют аутоиммунного заболевания.

При оценке особенностей течения I триместра беременности статистически значимых различий между группами по частоте раннего токсикоза, угрозы прерывания беременности и дисбиотических нарушений влагалищной микробиоты не было отмечено. Анализ особенностей течения II и III триместров беременности не выявил статистически значимых различий по частоте развития гестационного сахарного диабета, угрожающих преждевременных родов и острых респираторных вирусных инфекций.
Частота диагностирования задержки развития плода, мало-/многоводия по данным ультразвукового исследования была сопоставима между группами (р≥0,05).
При сравнительном анализе результатов специальных лабораторных методов исследования (табл. 2) было выявлено, что титр анти-SSA/Ro-антител был cтатистически значимо выше во II группе.
Учитывая вероятный «материнский» генез ФБ, была предпринята попытка проведения базисной терапии аутоиммунного ревматологического заболевания, направленная на снижение общего воспалительного ответа и профилактику фиброза. В качестве терапии после консультативного междисциплинарного обсуждения инициировался прием гидроксихлорохина и пероральной формы фторированных глюкокортикостероидов (метилпреднизолона и/или дексаметазона). Проводился курс лечебного плазмафереза, состоящий из трех сеансов, с последующим внутривенным введением пульс-терапии глюкокортикостероидов (дексаметазон в дозировке 32 мг) на фоне продолжающейся пероральной терапии глюкокортикостероидами. В качестве комплексной терапии при высоком титре аутоантител в крови беременной и быстром прогрессировании нарушения ритма сердца плода использовалось внутривенное введение человеческого иммуноглобулина в дозировке 1 г/кг.
Терапевтические подходы представлены в таблице 3. В связи с прогрессированием степени АВ-блокады плода и нарастанием титра анти-SSA/Ro- и анти-SSB/LA-антител повторный курс эфферентных методов терапии потребовался 4 из 6 беременных (66,7%). На фоне комплексной терапии при динамическом контроле сохранялся высокий титр аутоантител; при этом у 2 из 6 беременных (33,3%) отмечалась регрессия АВ-блокады до I–II степени, а в остальных 4 случаях (66,7%) не отмечалось прогрессирования сердечной недостаточности и прогрессирования или развития неиммунной водянки, что позволило пролонгировать беременность до доношенного срока во всех 6 случаях.
В двух случаях (33,3%) тяжелой ФБ (II группа) в связи с ЧСС плода ниже 55 уд/мин применялись селективные β2-адреномиметики (кленбутерол), и впоследствии данным новорожденным потребовалась установка электрокардиостимулятора в первые сутки жизни (табл. 3).

В I группе в 8 из 9 случаев (88,8%) назначения специфической терапии не потребовалось в связи с транзиторными эпизодами ФБ по данным мониторинга за состоянием плода.
Метод родоразрешения определялся степенью выраженности ФБ. Так, учитывая стабильное состояние плода и ЧСС выше 95–100 уд/мин, роды через естественные родовые пути произошли у 2 из 9 (22,2%) беременных I и у 1 из 6 беременных (16,7%) II группы. Самостоятельно вступили в роды 44,4% (4 из 9) беременных I группы, однако в связи с развитием острой гипоксии плода, подтвержденной пробой скальп-лактата, двое из них были родоразрешены путем операции кесарева сечения. В остальных случаях в связи с выраженной брадикардией плода, признаками АВ-блокады II–III степени было произведено оперативное родоразрешение путем кесарева сечения (55,5 и 83,3% соответственно) в плановом порядке. Средний срок при родоразрешении в обеих группах составлял 38,4 (1,1) недели. Значимых различий в сроках и методах родоразрешения между исследуемыми группами не было.
При изучении неонатальных исходов не было выявлено статистически значимых различий при рождении по массе тела (I группа – 3133,6 (350,9) г, II группа – 3176 (272,9) г), длине (I группа – 50,4 (2,1) см, II группа – 50,8 (1,7) см) и оценке состояния по шкале Апгар на 1-й и 5-й минутах (I группа – 8 и 9 баллов, II группа – 7 и 8 баллов соответственно).
У 3 из 9 (33%) новорожденных I группы были диагностированы множественные пороки развития сердечно-сосудистой и легочной систем (в 1 случае – кистозно-аденоматозная мальформация левого легкого, в 1 – множественные межпредсердные сообщения, трабекулярность миокарда левого желудочка по типу некомпактного, в 1 – коарктация аорты); 4 из 9 (44%) новорожденных сохранили нарушение ритма сердца после рождения в виде синусовой брадикардии, неполной блокады правой ножки пучка Гиса или синдрома WPW (Wolff-Parkinson-White). Лишь у 2 из 9 (22%) новорожденных данных за неонатальное нарушение ритма сердца не было отмечено.
В I группе ни одному новорожденному не потребовалась установка электрокардиостимулятора.
Во II группе кардиохирургическая помощь потребовалась 4 из 6 новорожденных (66,7%). Данные дети с диагностированным внутриутробно и сохраняющимся в первые часы жизни нарушением ритма сердца в виде АВ-блокады III степени с ЧСС 50–60 уд/мин в течение первых суток были переведены в кардиохирургический стационар для установки постоянного электрокардиостимулятора. В одном случае после имплантации электрокардиостимулятора отмечалась неэффективная стимуляция желудочков сердца новорожденного, и в связи с врожденным фиброэластозом эндокарда правых и левых отделов сердца, тяжелой аритмогенной дисфункцией миокарда и прогрессирующей сердечно-легочной недостаточностью на фоне кардиотонической, вазопрессорной терапии с максимальными дозами препаратов в возрасте 2 суток жизни у ребенка диагностирована клиническая смерть.
Двое новорожденных (33,3%) II группы, с отмеченным положительным эффектом от проведения антенатальной иммуносупрессивной терапии матери, в течение первого месяца жизни наблюдались по поводу блокады правой ножки пучка Гиса и АВ-блокады I и II степени (Мобитц 1, Мобитц 2).
Терапия новорожденных определялась видом нарушения ритма и ЧСС. Назначение глюкокортикостероидов потребовалось 28% детей из II группы и 10% из I группы. 40% новорожденных из I группы не потребовалось назначения специфической терапии, за ними проводилось динамическое наблюдение. Необходимость в проведении антибактериальной терапии в обеих группах была сопоставима и составляла 20%.
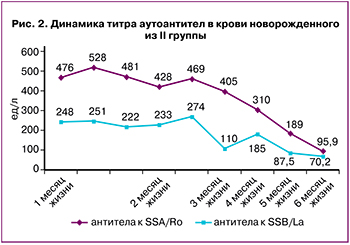 При дальнейшем проспективном наблюдении новорожденных с тяжелой брадиаритмией отмечалось изменение титра Ro/La-антител в крови. Так, в течение первых 6 месяцев жизни новорожденной Ш. титр анти-Ro- и анти-La-антител снизился в 5 и 3,5 раза соответственно (рис. 2).
При дальнейшем проспективном наблюдении новорожденных с тяжелой брадиаритмией отмечалось изменение титра Ro/La-антител в крови. Так, в течение первых 6 месяцев жизни новорожденной Ш. титр анти-Ro- и анти-La-антител снизился в 5 и 3,5 раза соответственно (рис. 2).
Обсуждение
ФБ плода является редкой и тяжело диагностируемой патологией проводящей системы сердца плода, особенно до 20 недель беременности. Ранняя диагностика фетального нарушения ритма сердца, своевременное и комплексное обследование беременной способствуют раннему началу терапии и профилактике необратимого повреждения проводящей системы сердца плода, что существенно влияет на неонатальные исходы. Крайне важна дифференциальная диагностика генеза ФБ, определяющего необходимость и объемы проведения антенатальной терапии.
По данным ряда авторов, более 85% всех АВ-блокад плода развивается с 16-й по 28-ю неделю гестации, что было подтверждено полученными нами данными [5]. Так, тяжелая брадикардия, представленная исключительно AВ-блокадой, диагностирована в сроке от 18 до 26 недель – II группа, а умеренная ФБ была зарегистрирована в сроке беременности более 27 недель – I группа.
Вышеописанные значимые различия по сроку диагностики (рис. 1), степени тяжести ФБ и титру аутоантител (антиядерных и анти-SSA, рис. 2) между группами позволяют сделать вывод о различном этиопатогенезе умеренной и тяжелой брадикардии.
Нарушение ритма сердца плода у беременных I группы наблюдалось в более поздние сроки беременности и не было связано с иммунным статусом матери. В 77,7% (7 из 9) случаев они были обусловлены «фетальным» фактором блокады проведения импульса, включающим врожденные аномалии развития сердца, каналопатии и синдром WPW. Раннее развитие ФБ сопряжено с тяжелым и порой необратимым поражением проводящей системы сердца плода вследствие участия в патогенезе аутоиммунных механизмов матери. Так, возникновение 83,3% (5 из 6) случаев ФБ во II группе обусловлено «материнским» генезом нарушения выработки и проведения электрического импульса сердца: трансплацентарным переходом вышеописанных аутоантител к экстрагируемым ядерным рецепторам и, как следствие, генерацией устойчивой воспалительной реакции в миокарде плода.
Полученные нами сопоставимые результаты особенностей течения беременности между группами подтверждаются зарубежными публикациями о том, что наличие анти-SSA-антител не влияет на развитие осложнений и исходы беременности, за исключением риска формирования АВ-блокады III степени у плода [6].
К сожалению, на сегодняшний день в мировой практике отсутствует единый унифицированный подход к терапии ФБ. Предпринимаются попытки лечения глюкокортикостероидами в различных режимах, препаратами с противовоспалительными свойствами, иммуноглобулинами, эфферентными методами. Применение данных методов лечения уменьшает материнскую нагрузку аутоантител, приостанавливая каскад развития аутоиммуноопосредованной брадикардии плода в связи с уменьшением титра анти-Ro- и анти-La-антител, доступных для связывания с кардиомиоцитами и их последующего апоптоза. Из-за малого числа наблюдений убедительных доказательных данных терапии ФБ крайне недостаточно. Тем не менее некоторые описанные в литературе методы терапии данной группы нарушений ритма сердца плода подтвердили свою эффективность в лечении и профилактике необратимого повреждения проводящей системы сердца плода [7–9]. Однако предикция и профилактика постнатальной прогрессии блокады являются предметом дальнейшего изучения.
Одним из основных является вопрос в отношении срока и методов родоразрешения, связанный с тем, что реальная оценка состояния плода при наличии ФБ крайне затруднена и практически невозможна при стойком нарушении ритма. В большинстве случаев нами был выбран оперативный метод родоразрешения в связи с трудностями проведения кардиотокографического мониторинга в родах и возможной дополнительной нагрузкой на сердечно-сосудистую систему плода при родоразрешении через естественные родовые пути. Представленные результаты также согласуются с систематическим обзором 2015 г., где родоразрешение путем операции кесарева сечения при АВ-блокаде плода описано в 75% беременностей [5]. Самопроизвольные роды стали возможными у беременных II группы при регрессе АВ-блокады до I степени в ходе проведения иммуносупрессивной терапии.
В исследовании J.P. Buyon et al. описаны высокая неонатальная смертность (до 30%) новорожденных с АВ-блокадой III степени и последующая необратимая заболеваемость. Так, до 64–70% новорожденных при полной АВ-блокаде требуют имплантации кардиостимулятора в первые 2 недели жизни. По нашим данным, кардиохирургическая помощь потребовалась 4 из 6 новорожденных из II группы.
Отмеченное в нашей работе снижение титра Ro/La-антител в крови новорожденных в динамике за первые 6 месяцев жизни доказывает их трансплацентарный переход и подтверждается литературными данными о том, что данный вид ФБ является моделью пассивно приобретенного аутоиммунного заболевания [10].
Наши результаты показывают, что 88,8% случаев умеренной ФБ не нуждается в назначении специфической терапии, проводится динамическое наблюдение, что согласуется с литературными данными [11–13].
Наличие стабильного ритма в ходе динамического наблюдения и отсутствие прогрессирования сердечной недостаточности плода позволило родоразрешить через естественные родовые пути 2 из 9 (22,2%) беременных I группы. Высокий процент родоразрешения (44,4% – 4 из 9 беременных) путем операции кесарева сечения в родах в данной группе был обусловлен начавшимся нарушением состояния плода по данным кардиотокографии и ультразвуковой допплерометрии. Данное осложнение, вероятно, вызвано возникновением дополнительной нагрузки на сердечно-сосудистую систему плода при развитии регулярной родовой деятельности.
Согласно полученным результатам, трем новорожденным с пороками сердечно-сосудистой и легочной систем требовался динамический электрокардиографический мониторинг без назначения специфической терапии.
Заключение
Своевременная дифференциальная диагностика ФБ – важная задача современной перинатальной медицины. Совместное использование ультразвуковых и лабораторных методов обследования при диагностике нарушения ритма сердца плода способствует определению причины возникновения данной патологии и обеспечивает выбор тактики ведения пациентки, в том числе необходимость начала медикаментозного и афферентного лечения.
Результаты работы демонстрируют целесообразность специального иммунологического обследования при диагностике ФБ, а также проведения скринингового ультразвукового исследования сердца с 18-й по 28-ю неделю беременности.



