Дефициты макро- и микронутриентов во время беременности, особенно в ранние сроки, связаны с развитием плацентита, гипотрофии плода, увеличением риска врожденных аномалий ЦНС и органов зрения. Помимо общеизвестных нутриентов (витамины А, группа В, С, D, Е, селен, цинк, йод, железо и др.), входящих в большинство ВМК для беременных, не менее важное значение для нормального развития беременности имеет обеспеченность активными фолатами и омега-3 полиненасыщенными жирными кислотами (ПНЖК) [1].
Потребность организма в фолатах во время беременности увеличивается, поскольку фолаты в комплексе с другими витаминами и цинком принципиально важны для роста и развития плода. Недостаток фолатов приводит к тяжелым последствиям, в том числе дефектам нервной трубки (ДНТ), которые встречаются в 0,5% случаев беременности и составляют 2% в структуре неудачной беременности [2].
Эссенциальные омега-3 ПНЖК способствуют оптимальному развитию мозга не только внутриутробно, но на многие годы вперед (в период детства и отрочества), а также способствуют профилактике послеродовой депрессии [3]. Между активными фолатами, витаминами группы В и омега-3 ПНЖК существует определенный фармакодинамический синергизм: дефицит активных фолатов негативно влияет на метаболизм ПНЖК, а недостаточность омега-3 ПНЖК приводит к нарушениям метаболизма фолатов [4]. В настоящей работе рассмотрены упомянутые выше перспективные микронутриенты, которые целесообразно включать в современные ВМК для беременных.
Дефицит фолатов, особенно в преконцепцию и на ранних стадиях беременности, существенно повышает риск возникновения врожденных пороков (в том числе ДНТ), гипотрофии и недоношенности, а также увеличивает риск выкидыша и таких осложнений беременности, как эклампсия. На более поздних сроках беременности дефицит фолатов повышает риск синдрома Дауна и врожденных пороков сердца [5]. Нехватка фолатов в организме беременной ассоциирована с нарушениями развития речи в последующей жизни ребенка [6].
Для компенсации дефицита фолатов используют такие витамеры В9, как фолиевая кислота и 5-метилтетрагидрофолиевая кислота (L-метилфолат). Неметилированная форма витамина B9, фолиевая кислота, должна подвергаться ферментативному восстановлению метилентетрагидрофолатредуктазой (MTHFR), чтобы стать биологически активным витамером [7].
Метилтетрагидрофолиевая кислота (5-МТГФ, левомефолиевая кислота, L-метилфолат, (6S)-5-метилтетрагидрофолат, метафолин, экстрафолат S) является первичной биологически активной формой фолата, используемой на клеточном уровне для метилирования ДНК и регуляции уровней гомоцистеина. L-метилфолат синтезируется в абсорбирующих клетках тонкой кишки из полиглутамилированного диетического фолата.
Необходимость использования 5-МГТФ обусловлена тем, что от 5 до 25% людей в различных популяциях характеризуются пониженной активностью фермента метилтетрагидрофолат редуктазы (МТГФР), который является центральным ферментом метаболизма фолатов. Поэтому беременным предпочтительнее принимать именно метилтетрагидрофолат, который, в отличие от фолиевой кислоты, уже не требует биотрансформации и является биологически активной формой фолатов. Пик концентрации активного метаболита в плазме при аналогичной дозировке в несколько раз выше, чем при приеме просто фолиевой кислоты, что указывает на фармакокинетическое преимущество приема метилтетрагидрофолата [8].
При развитии мозга и органов зрения плода большую роль играют эссенциальные липиды – полиненасыщенные жирные кислоты (ПНЖК). Омега-3 ПНЖК не синтезируются в организме человека и крайне важно ежедневно получать их в достаточном количестве и в сбалансированном составе. У большинства россиянок репродуктивного возраста отмечается недостаточное потребление омега-3 ПНЖК [9]. По результатам независимого опроса в России препараты омега-3 ПНЖК принимают не более 1% беременных. В то же время каждый год возрастает число детей с нарушениями функции зрения и с перинатальной энцефалопатией – заболеваниями, во многом обусловленными дефицитом омега-3 [10]. Дети, рожденные от женщин, у которых содержание омега-3 ПНЖК в молоке было выше, обладают лучшими когнитивными способностями.
Основным механизмом фармакологического действия и омега-3, и омега-6 ПНЖК на физиологию человека является их участие в метаболических процессах, формирующих так называемый «каскад арахидоновой кислоты». Арахидоновая кислота (АРК) – разновидность омега-6 ПНЖК, присутствующая в значительном количестве в фосфолипидах, составляющих клеточные мембраны. Основной механизм физиологического воздействия омега-3 ПНЖК заключается в уменьшении воспаления через снижение синтеза простагландинов, тромбоксанов и лейкотриенов. Это обеспечивает широкий круг клинического применения препаратов на основе омега-3 ПНЖК за счет процесса, известного как «разрешение воспаления» [11] (рисунок).
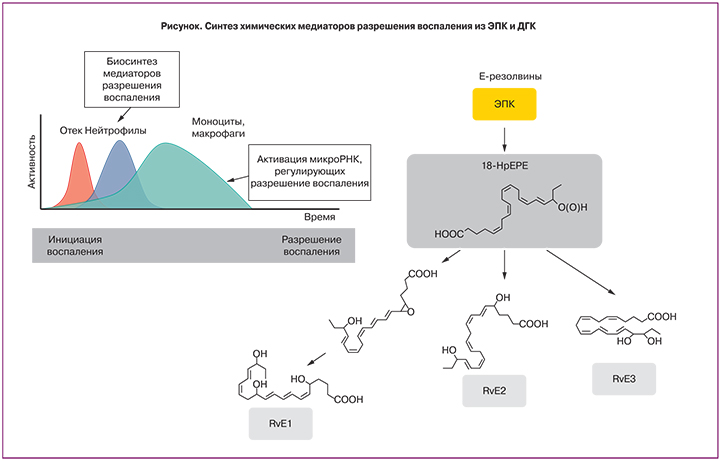
Противовоспалительные эффекты эйкозаноидов и докозаноидов, синтезируемых из омега-3 ПНЖК, важны для поддержания беременности [10]. Показано, что достаточное потребление омега-3 ПНЖК во время беременности снижает риск преждевременных родов [12]. Результаты мета-анализа подтвердили снижение частоты преждевременных родов при приеме омега-3 ПНЖК: на сроке 34–36 нед. – на 8%, ранее 34 нед. – на 31% [13]. Прием омега-3 снижает риск преэклампсии и прерывания беременности [14, 15], а также преждевременного отхождения вод при родах [16]. По данным мета-анализа, дотации омега-3 ПНЖК приводят к снижению риска преждевременных родов на 58%, а длительность гестации возрастает почти на 2 недели [17]. Дополнительно в ходе клинических исследований были выявлены и другие позитивные эффекты, связанные с приемом омега-3 ПНЖК во время беременности: увеличение объема околоплодных вод при маловодии [18]; эффективная профилактика депрессии во время беременности и после родов [19]; профилактика сниженной массы тела при рождении (в частности, крупномасштабное исследование 12 373 беременных показало, что низкие концентрации омега-3 ПНЖК в плазме крови были связаны с более низкой массой тела новорожденных (отношение шансов 1:4) [4]); снижение риска развития аллергий у детей [20] (например, пищевая аллергия на яйца встречалась только у 9% детей, рожденных от матерей, получавших 900 мг/сут омега-3 ПНЖК во время беременности, а в контроле – у 15% детей). Дети от матерей, получавших дотации омега-3 ПНЖК во время беременности, имели более высокую степень восприятия и воспроизведения речи по шкалам МакАртура и Бейли на 12, 14 и 18-й месяцы жизни [21].
Важно отметить, что между фолатами и омега-3 ПНЖК существуют неразрывные синергичные взаимодействия. С одной стороны, биологические эффекты активных фолатов осуществляются посредством синтезируемого из фолатов S-аденозилметионина, участвующего в реакциях метилирования ДНК при участии рибофлавина (витамин В2), никотинамида (витамин РР), пиридоксина (витамин В6) и цианокобаламина (витамин В12). Фолаты непосредственно воздействуют на экспрессию генов метаболизма углеводов, регуляции клеточного цикла и апоптоза. Развивающиеся на фоне дефицита активных фолатов нарушения метилирования ДНК будут нарушать экспрессию генов, кодирующих ферменты метаболизма омега-3 ПНЖК. С другой стороны, противовоспалительные, антиапоптотические и нейропротективные эффекты омега-3 ПНЖК обусловлены их производными – резолвинами и нейропротектинами. Омега-3 ПНЖК и их производные включаются в состав фосфолипидов, которые действуют как промежуточные сигнальные молекулы и также взаимодействуют с разными факторами транскрипции. Эти взаимодействия оказывают непосредственное влияние на экспрессию генов, вовлеченных в метаболизм фолатов и гомоцистеина [4].
Помимо омега-3 ПНЖК, синергистами фолатов является и ряд других микронутриентов (в частности, другие витамины группы В и цинк). Синергичность действия проявляется, прежде всего, в профилактике пороков развития и поддержании энергетического метаболизма постоянно растущих тканей плода. Дефицит многих витаминов группы В типичен для беременных (особенно при наличии гестационного диабета и рвоте беременных), что делает обязательной коррекцию дефицита витаминов посредством специальных ВМК для беременных [22].
Витамин В1 повышает секрецию молока у лактирующих женщин, в связи с чем используется в комплексе мер по лечению ранней гипогалактии (чаще в сочетании с витаминами С, В2, В6).
В составе кофакторов флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН) витамин В2 (рибофлавин) входит более чем в 180 ферментов, многие из которых участвуют в биосинтезе АТФ. Рибофлавин необходим для развития нервной системы, кожи, слизистых оболочек, печени плода, также стимулирует кроветворение. При нутрициальном дефиците рибофлавина в 3 раза возрастает риск развития дефектов конечностей [23], расщелин неба у плода и риск преэклампсии у беременной [24].
В3 (РР, никотинамид) необходим для активности ферментов биосинтеза АТФ. Низкие уровни диетарного потребления рибофлавина (менее 1,2 мг/сут) и никотинамида (менее 13,5 мг/сут) соответствовали более чем двукратному повышению риска рождения ребенка с врожденными пороками сердца [25].
Гиповитаминоз витамина РР может длительное время протекать латентно, без характерных клинических проявлений. В дальнейшем появляются вялость, депрессия, повышенная утомляемость, эпизодические головокружения и головная боль, раздражительность, нарушение сна, тахикардия с ощущениями сердцебиения, цианоз губ, лица, кистей, бледность и сухость кожи [22].
Пантотеновая кислота (витамин В5) входит в состав ацетил-кофермента А (ацетил-КоА), который является одним из важнейших кофакторов для ферментов, вовлеченных в катаболизм жирных кислот, аминокислот и сахаров. Поэтому витамин В5 синергичен прежде всего с другими витаминами группы В, вовлеченными в синтез АТФ (витамины В1, В2, В3). Следовательно, дефицит пантотеновой кислоты во время беременности будет стимулировать гипотрофию тканей плода.
В составе кофактора пиридоксальфосфата пиридоксин (витамин В6) необходим для поддержания активности более 120 белков протеома человека. Совместно с фолатами и витамином В12 витамин В6 участвует в обезвреживании гомоцистеина и метилировании ДНК. Дефицит витамина В6 у беременных весьма распространен, особенно на ранних сроках беременности (50–100% беременных, в зависимости от региона) [26]. Дефицит пиридоксина сопряжен с повышенной частотой судорог икроножных мышц, парестезий, с тревожным состоянием психики, рвотой на ранних сроках беременности, кариесом зубов [27].
При этом именно у беременных с дефицитом витамина В6 кариес может развиваться очень быстро. Эффективность применения пиридоксина при рвоте беременных показана в классе доказательности «А».
Витамин Н (биотин) принимает участие в процессах катаболизма жиров и углеводов, синтеза АТФ, способствует улучшению состояния кожи, ногтей и волос. Недостаток биотина у беременных сопровождается шелушением кожи головы и лица, усталостью, депрессией, тошнотой, диффузным выпадением волос. Дефицит биотина может привести к развитию врожденных пороков [28].
Витамин В12 (цианкобаламин) является кофактором ферментов, участвующих в метаболизме гомоцистеина и фолатов. Тяжелый дефицит витамина В12 ведет к серьезным аномалиям развития плода и прерыванию беременности [29]. Гиповитаминоз В12 возникает у беременных с дисбиозом кишечной флоры, может приводить к врожденным порокам развития скелета вследствие нарушения кальций-фосфорного обмена [30]. Установлена взаимосвязь между низким уровнем В12 во время беременности у матери и ожирением и резистентностью к инсулину у детей в возрасте 6 лет [31].
Ионы цинка принципиально необходимы для стабилизации фрагментов структуры белка, известных как «цинковые пальцы». Данный тип цинк-связывающего фрагмента структуры белка входит в состав более 1100 факторов транскрипции, стабилизируя их пространственную структуру, обеспечивая специфичность взаимодействия этих транскрипционных факторов с ДНК [32]. Поэтому цинк принципиально необходим для поддержания нормофизиологической генной экспрессии и, следовательно, нормального развития тканей плода. Ранние стадии эмбриогенеза наиболее чувствительны к дефициту цинка, поэтому у 13–18% беременных с дефицитом цинка отмечается развитие тяжелейших пороков плода (гидроцефалия, анофтальмия), а также расщепления неба, пороков сердца и др. Отмечена прямая корреляция между снижением концентрации цинка в сыворотке крови у беременных и риском слабости родовой деятельности, преждевременных родов и послеродовых инфекций [33].
Наиболее приемлемым является использование органических низкотоксичных солей цинка, характеризующихся высокой биодоступностью (40–50%) и приемлемыми органолептическими свойствами (такими как цитрат цинка, входящий в состав, например, ВМК для беременных прегнотон мама).
Недостаток железа – самый распространенный дефицит микронутриентов среди беременных. Он ведет к развитию анемии (ЖДА) и нарушениям в развитии плода (низкий вес). Распространенность ЖДА в мире составляет 42% [34], в России также порядка 40% [35].
Компенсация железодефицита с помощью ВМК длится достаточно долго. Поэтому профилактический прием железосодержащих препаратов целесообразно начинать за несколько недель до планируемого зачатия. ЖДА возникает у большинства беременных. Поэтому препараты железа обязательно назначают при беременности, а также при подготовке к беременности.
Биоусвояемость железа из неорганических форм (сульфат железа, оксид железа) весьма низка (менее 10%), что обусловливает высокие дозировки и связанные с ними нежелательные побочные эффекты (прежде всего, тошнота, запоры, раздражения ЖКТ), проявляющиеся у 25–35% пациенток. Прием микроинкапсулированного пирофосфата («липосомное» железо) беременными с железодефицитом в течение 12 недель на 80% увеличил уровень ферритина. Рост уровня гемоглобина и степени насыщения трансферрина также был достоверным [36].
Частота побочных эффектов была значительно ниже при приеме липосомного железа перорально (Р<0,001), так что пероральное липосомное железо является безопасной и эффективной альтернативой в/в введению глюконата железа для коррекции анемии [37]. Поскольку железо в ВМК прегнотоне мама представлено «липосомной» формой, то можно ожидать, что прием этой формы в количестве 14 мг/сут в пересчете на железо будет достоверно увеличивать ферритиновое депо железа.
Недостаток йода во время беременности является фактором риска развития кретинизма у ребенка и зоба у роженицы. Компенсирование этого дефицита является обязательным условием для нормальных родов, так как большинство россиянок репродуктивного возраста проживают в йододефицитных регионах. Потребление беременными 200 мкг/сут йода дополнительно к рациону питания нормализует уровень йода в организме и ликвидирует опасность йододефицита как для матери, так и для плода [38, 39].
Витамин Е является эндогенным антиоксидантом и участвует в процессах тканевого дыхания, метаболизме белков, жиров и углеводов. Дефицит витамина Е распространен среди беременных (15–20%). Дефицит витамина Е у недоношенных новорожденных сопровождается повышенным риском гемолитической анемии и в нарушений зрения. Прием витамина Е снижает риск отслойки плаценты [40].
Данные многочисленных фундаментальных и клинических исследований указывают на взаимосвязь между сниженной обеспеченностью витамином D и риском возникновения гестационного диабета. Дефицит витамина D3 встречается достаточно часто даже в относительно обеспеченных европейских странах (до 30% женщин репродуктивного возраста). Прием витамина D3 у беременных снижает риск преэклампсии, преждевременных родов и недостатка веса новорожденных [41]. В состав прегнотона мама витамин D3 входит в количестве 200 МЕ (при суточной норме для беременных 600 МЕ/сут), что позволяет при необходимости проводить дополнительную коррекцию недостаточности витамина D3 соответствующими монопрепаратами.
Недостаток витамина С часто встречается среди беременных. Есть данные, что прием витамина С снижает риск преждевременного отслоения плаценты и преждевременного отхождения вод при родах [42].
Показано, что прием аскорбиновой кислоты беременными снижал риск инфекций мочеполовой системы более чем в 2 раза (12% против 29%) [43].
Недостаточность селена у беременных значительно чаще встречается при повторных родах, особенно при коротких интервалах между родами. Отмечена взаимосвязь между дефицитом селена во время беременности и повышенным риском внезапной смерти у детей в раннем возрасте, развитием селен-дефицитной кардиомиопатии у роженицы. Дефицит селена может приводить к преждевременному прерыванию беременности, задержке развития плода, преэклампсии [44], послеродовой депрессии [45], повышенной материнской смертности [10, 22].
Заключение
В настоящее время среди производителей ВМК для беременных наблюдается положительная тенденция отхода от менее усвояемых и, в ряде случаев, более токсических неорганических форм микронутриентов (например, сульфат железа) к формам с более высокой биодоступностью (органическое соли, комбинированные формы, липосомное железо). Не менее важными тенденциями являются использование биологически активных форм микронутриентов (например, активных фолатов) и все более широкое применение омега-3 полиненасыщенных жирных кислот в составе ВМК для беременных.
Отечественный ВМК для беременных прегнотон мама соответствует всем описанным выше тенденциям. Вместо низкоусвояемых сульфата железа и сульфата цинка прегнотон мама содержит «липосомное» железо (14 мг) и органическую соль цитрат цинка (11 мг), соответственно. В ВМК включены субстанция ДГК (200 мг/капс.) и фолатная субстанция, содержащая 5-метилгидрофолат и фолиевую кислоту (400 мкг/капс.). Кроме того, в состав ВМК включены такие важные для поддержки беременности микронутриенты, как витамины С (аскорбиновая кислота, 55 мг), D (холекальциферол, 5 мкг, т.е. 200 МЕ), Е (токоферола ацетат, 13 мг), В1 (тиамина гидрохлорид, 1,2 мг), В2 (рибофлавин, 1,6 мг), В3 (ниацинамид, 15 мг), В5 (пантотенат кальция, 6 мг), В6 (пиридоксина гидрохлорид, 1,9 мг), В12 (цианокобаламин, 3,5 мкг), Н (биотин, 60 мкг), калия йодид (150 мкг элементного йода), натрия селенит (50 мкг элементного селена). ВМК прегнотон мама ориентирован на компенсирование повышенной потребности в ключевых микронутриентах (йод, железо, фолат) беременных и готовящихся к беременности женщин. Рекомендации по применению: по одной капсуле в день во время еды.



