Во многих странах в последние десятилетия отмечается значительный рост тромбоэмболических осложнений при различных заболеваниях, в том числе при патологическом течении беременности, в родах и послеродовом периоде [1, 2]. По данным А.П. Момота, до 50% всех венозных тромбоэмболических осложнений (ВТЭО), возникающих у женщин в возрасте до 40 лет, связаны с гестационным процессом [3]. Доказано, что венозные тромбозы с одинаковой частотой развиваются во время беременности и в послеродовом периоде, тогда как тромбоэмболия легочной артерии (ТЭЛА) наиболее часто наблюдается после родоразрешения [4]. Частоту венозных тромбозов бывает трудно оценить, так как тромбоз глубоких вен (ТГВ) в 38%, а ТЭЛА – в 22% случаев развивается уже после выписки пациентки из акушерского стационара [5]. Развитие венозного тромбоэмболизма потенцируется рядом факторов: кесарево сечение (КС) (особенно экстренное), ожирение, сердечно-сосудистые заболевания, курение, варикозное расширение вен, текущая инфекция, иммобилизация больше 4 дней, носительство отдельных протромботических генов тромбофилии, которые традиционно относят к факторам умеренного риска развития тромботических осложнений [6, 7]. Их взаимодействие приводит к значительному снижению адаптационных способностей организма женщины и может стать своего рода «триггером» в каскаде патологических реакций развития генерализованной микроангиопатии и тромбофилии. Поэтому у женщин, имеющих сочетание этих факторов, имеется риск патологического течения беременности, родов, а также послеродового периода.
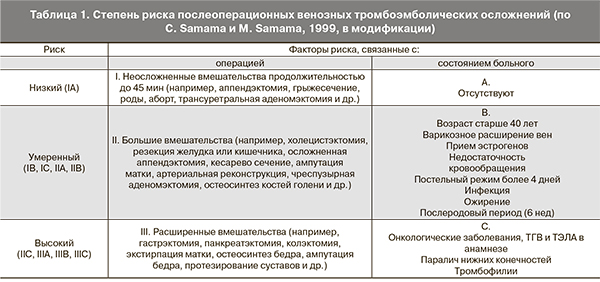
Для оценки степени риска развития ВТЭО применяют модифицированную классификацию С. Samama и M. Samama (табл. 1).
В последнее время все больше данных свидетельствует о связи тромботических и воспалительных процессов [8, 9]. Возможно, это является свидетельством того, что, несмотря на широкое внедрение антибиотикопрофилактики и антибиотикотерапии, воспалительные осложнения пуэрперия не стали «болезнью прошлого» и ежегодно фиксируются у тысяч родильниц. Ряд исследователей отмечают, что отличительной особенностью течения послеродовых воспалительных осложнений являются стертые клинические процессы, которые не соответствуют глубине морфологических изменений и не отражают тяжесть состояния родильницы [10–12]. Так, стертая форма метроэндометрита без яркой манифестации встречается в современных условиях чаще (80%), чем классическая (20%) и имеет ряд особенностей, которые необходимо учитывать при диагностике этой патологии [13]. Это определяет подходы к терапии и профилактике осложнений пуэрперия, предусматривающие применение препаратов, изначально нормализующих функции свертывающей системы крови, в частности НМГ. Однако на сегодняшний день нет единого мнения относительно противовоспалительного действия НМГ. Поэтому, несмотря на выяснение некоторых механизмов патогенеза патологических состояний в акушерстве, вопросы разработки эффективных и оптимальных методов терапии и профилактики возникающих осложнений послеродового периода, особенно в ситуациях сочетания факторов умеренного риска тромбоза, продолжают оставаться открытыми.
Цель исследования: совершенствование профилактики воспалительных и тромботических осложнений с использованием НМГ после операции кесарева сечения у родильниц с факторами умеренного риска развития тромбоза.
Материал и методы исследования
Нами проведен анализ клинического течения послеродового периода у 111 родильниц после абдоминального родоразрешения с дополнительными факторами умеренного риска тромботических осложнений, которых выборочно разделили на две группы: I (основная) – 51 родильница, в комплекс терапии которым был включен эноксапарин натрия, II (группа сравнения) – 60 родильниц, которые не получали НМГ. После одобрения этическим комитетом и получения информированного согласия, родильницам основной подгруппы, через 12 ч после абдоминального родоразрешения с целью профилактики воспалительных и тромботических осложнений вводили эноксапарин натрия в дозе 40 мг в сутки в течение 3 дней. В ходе исследования наряду с общеклиническими и гемостазиологическими показателями осуществлялось определение в сыворотке крови концентраций про-(IL-1β, IL-6) и противовоспалительных цитокинов (IL-4, IL-10), эндотоксина на 1-е, 3–4-е и 6–7-е сутки, а также проводилось допплерометрическое исследование сосудов послеродовой матки на 3–4-е и 7–8-е сутки.
Из исследования исключались пациентки с воспалительными процессами различной локализации в III триместре беременности, с применением НМГ в течение 3–4 недель до родоразрешения, наличием факторов риска тромботических осложнений, несоответствующих умеренному, тяжелой экстрагенитальной патологией, преэклампсией, отслойкой плаценты, а также родоразрешенных в экстренном порядке.
Статистическая обработка данных проводилась с помощью пакета статистических программ PASW (SPSS) Statistics 18 с предустановленной операционной системой Windows 7. Определялся характер распределения данных. При получении показателей с распределением, отличающимся от нормального, для сравнения двух независимых выборок применяли непараметрические критерии Манна–Уитни и критерий χ2; для двух связанных совокупностей – тест Уилкоксона. Для случая наличия более чем двух зависимых выборок использовали тест Фридмана.
Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным 0,05.
Результаты исследования и обсуждение
В ходе исследования было установлено, что по социально-биологическим характеристикам, объему оперативного вмешательства группы обследованных родильниц были однородны и сопоставимы, что свидетельствует о случайном распределении пациенток на группы и является признаком рандомизации проводимого исследования. Так, в активном репродуктивном возрасте (до 29 лет) находились 38,6% женщин основной группы и 32,9% женщин группы сравнения, в позднем репродуктивном возрасте (от 35 лет и старше) – 41,9 и 36,7% соответственно. До наступления данной беременности никотиновой зависимостью страдала каждая третья из родильниц. При анализе структуры и частоты встречаемости экстрагенитальной патологии выявлено, что заболевания сердечно-сосудистой системы (гипертоническая болезнь I–II стадии, пролапс митрального клапана, варикозная болезнь) имелись у каждой четвертой родильницы. Эндокринная патология (гиперандрогения, заболевания щитовидной железы) встречалась у 13,1% женщин основной и у 16,5% женщин группы сравнения. Почти каждая вторая родильница (45 и 48% соответственно) имели избыточную массу тела или I–II степень ожирения. В 17% случаев у женщин основной группы и в 19% случаев у женщин группы сравнения был выявлен гетерозиготный полиморфизм гена метилентетрагидрофолотредуктазы.
Основными показаниями к абдоминальному родоразрешению были: тяжелая экстрагенитальная патология – в 26,2 и 21,6% наблюдений; возраст первородящей в сочетании с осложненным течением данной беременности и отягощенным акушерским анамнезом в 11,8 и 13,1%; рубец на матке после предыдущего кесарева сечения в 9,1 и 6,8%; показания со стороны плода в 7,2 и 8,9% наблюдений в основной и группе сравнения соответственно. Длительность операции составила в основной группе 51,2±4 мин, в группе сравнения – 58,9±3 мин, средний объем кровопотери был 834±75 мл и 912,3±81 мл соответственно. Всем родильницам был проведен короткий внутривенный профилактический курс антибактериальными препаратами.
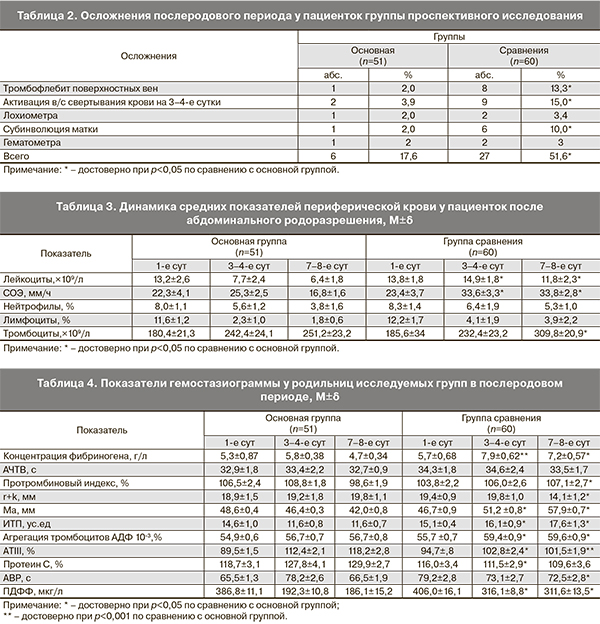
По нашим данным, достоверно чаще осложнения послеродового периода возникали у родильниц в группе без профилактического применения НМГ (табл. 2): тромбофлебит поверхностных вен в основной группе был выявлен у 1 (2%), в группе сравнения у 8 (13,3%) родильниц (р=0,03); лохиометра в основной группе у 1 (2%) пациентки, в группе сравнения у 2 (3,4%) пациенток, субинволюция послеродовой матки у 1 (2%) пациентки основной группы, в группе сравнения у 6 (10%) пациенток. Важно отметить, что у 2 (3,9%) родильниц после профилактического курса НМГ на 3–4-е сутки послеродового периода сохранялась гиперкоагуляция, гиперагрегация и активация внутрисосудистого свертывания крови, которые были расценены как проявление потенциального риска тромбообразования, в связи с чем была продолжена антикоагулянтная терапия НМГ. Также у 5 (9,8%) родильниц основной группы потребовалось повторное назначение НМГ на 5–6-е сутки в связи с выраженной активацией внутрисосудистого свертывания, что могло быть следствием первоначально неадекватно подобранной дозы НМГ или недостаточной продолжительности курса противотромботической профилактики. В группе без профилактического применения НМГ у 9 (15%) родильниц на 3–4-е сутки возникла необходимость назначения НМГ с лечебной целью в связи с выраженной гиперкоагуляцией и активацией внутрисосудистого свертывания крови. Мы расценили это как следствие срыва регулирующих систем и дальнейшей реализации системной воспалительной реакции.
Помимо клинического течения послеродового периода, оценивались общеклинические и гемостазиологические показатели крови в динамике (табл. 3, 4).
Сравнительный анализ показателей периферической крови у всех родильниц на 1-е сутки показал умеренный лейкоцитоз и повышение СОЭ, что является физиологическим процессом после родов, а повышенные уровни палочкоядерных нейтрофилов и лимфоцитов на 1-е сутки после родов объясняются состоянием после оперативного вмешательства [14]. В плазменном и тромбоцитарном звеньях свертывающей системы крови отмечалось увеличение средней концентрации фибриногена, снижение показателей активированного частично тромбопластинового времени (АЧТВ) и протромбинового индекса (ПТИ). На тромбоэластограмме (ТЭГ) была выявлена хронометрическая и структурная гиперкоагуляция в плазменном звене, о чем свидетельствовало укорочение показателей r+k и увеличение индекса тромбодинамического потенциала (ИТП). Более того, в обеих группах отмечались признаки активации внутрисосудистого свертывания крови – увеличение D-димеров.
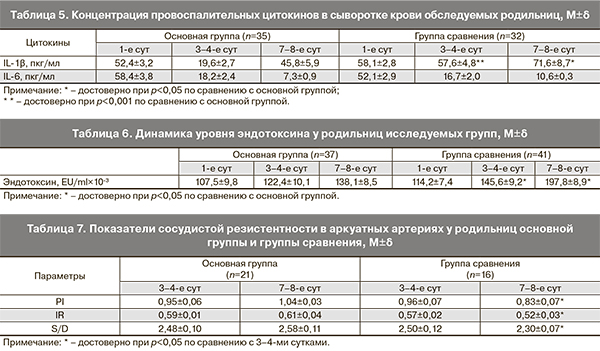
У большинства родильниц после абдоминального родоразрешения в 1-е сутки в сыворотке крови определялись высокие значения провоспалительных цитокинов – IL-1β, IL-6, а концентрация противовоспалительных цитокинов (IL-4) составила менее 5 пкг/мл. Концентрацию IL-10 удалось определить лишь у 11 родильниц в обеих подгруппах, которая была в пределах 2,17–17,3 пкг/мл. При последующих исследованиях концентрация IL-10 составила менее 1 пкг/мл.
Было установлено, что в сыворотке крови большинства родильниц в 1-е послеоперационные сутки определялся эндотоксин, средний уровень которого в основной группе составил 107,5±9,8 EU/ml×10-3, в группе сравнения – 114,2±7,4 EU/ml×10-3. Согласно исследованиям М.С. Селиховой, в которое были включены 66 родильниц с физиологическом течением послеродового периода, эндотоксин в сыворотке крови не определяется, что, по-видимому, связано с методикой определения [15]. На возможность эндотоксина как маркера системной воспалительной реакции (СВР) указывает в своих работах В.Н. Серов, который, изучая особенности акушерского сепсиса и перитонита после кесарева сечения, обнаружил высокий уровень эндотоксина и определил его динамику в зависимости от клинического течения патологического процесса [16]. По некоторым данным, под действием эндотоксина и цитокинов происходит активация тромбоцитов и выброс стимуляторов агрегации (адреналина, АДФ, серотонина, ТХА2). В результате массивной внутрисосудистой агрегации происходит разрушение и дегрануляция тромбоцитов, что приводит к дальнейшему высвобождению стимуляторов агрегации в плазме и обусловливает явление потенциальной гиперагрегации тромбоцитов [17].
Таким образом, динамическое наблюдение за показателями периферической крови в 1-е сутки послеоперационного периода выявило гиперкоагуляцию, гиперагрегацию и умеренную интенсификацию процессов внутрисосудистого свертывания, а также активацию воспалительного потенциала крови, повышенный уровень провоспалительных цитокинов, наличие эндотоксина, что указывает на течение системной воспалительной реакции. Мы согласны с А.С. Симбирцевым, полагающим, что данное положение можно рассматривать как физиологический процесс, позволяющий организму адекватно реагировать на повреждающий фактор [18]. Однако, по данным S. De Carolis и соавт., у женщин с претромботическим состоянием данные проявления следует расценивать как проявление потенциального риска тромбообразования [19].
На 3–4-е послеоперационные сутки повышение уровня СОЭ и тромбоцитов в обеих группах мы расценили как один из этапов реализации воспалительной реакции. В плазменном звене гемостаза наблюдалось нарастание тромбогенного потенциала крови. Доказано, что риск венозной тромбоэмболии повышается в 4 раза при уровне фибриногена более 5 г/л [20]. Анализ параметров ТЭГ показал, что в группе без профилактического применения НМГ активизировались процессы внутрисосудистого свертывания крови. Об этом свидетельствуют укорочение константы r+k в среднем до 19,8±1,0 мм и удлинение амплитуды Ma до 51,2±0,8 мм, в то же время в основной группе динамика этих показателей была противоположная. В то же время, по данным C.T Esmon и соавт. [21], лабораторные маркеры гиперкоагуляции не коррелируют с клиническим риском тромбоза у беременных и родильниц даже в группах очень высокого риска, включая пациенток с тромбофилиями, онкологическими заболеваниями и эпизодами тромбоэмболии в анамнезе.
Полученные в нашей работе результаты (табл. 5) свидетельствуют о достоверном снижении уровня IL-1β в основной группе на 3–4-е сутки (р<0,05) по сравнению с 1-ми сутками, что, мы считаем, стало следствием профилактического применения НМГ, а отсутствие динамики концентрации IL-1β в группе сравнения – дальнейшей реализацией системной воспалительной реакции. Полученные нами результаты подтверждают данные Н.В. Долгушиной, указавшей на противовоспалительное действие НМГ в комплексном лечении плацентарной недостаточности и других осложнений беременности у пациенток с вирусными инфекциями [22].
Таким образом, на 3–4-е сутки послеоперационного периода у родильниц с факторами умеренного риска происходит постепенная интенсификация процессов воспаления и тромобогенеза, следовательно, и дальнейшее развитие СВР, что впоследствии приводит к срыву регулирующих систем и возникновению осложнений.
На 7–8-е сутки послеоперационного периода в основной группе наблюдалась постепенная нормализация клинических показателей крови и гемостазиограммы. Это согласуется с данными ряда исследователей о нормализации основных параметров крови при физиологическом течении послеродового периода не ранее чем на 5–7-е сутки после родов [23, 24]. В группе сравнения наблюдались признаки активации внутрисосудистого свертывания крови, что свидетельствовало о сохранении риска развития ВТЭО.
На протяжении всего послеродового периода у пациенток обеих групп средний показатель эндотоксина постепенно возрастал (табл. 6). Концентрация IL-1β на 7–8-е сутки повысилась в обеих группах. Аналогичные сведения в своих исследованиях приводит М.С. Селихова, указавшая на достоверное возрастание уровня цитокинов и выявление эндотоксина при возникновении инфекционных осложнений [15]. Более низкий показатель эндотоксина и IL-1β в основной подгруппе, мы полагаем, стал следствием эффективной профилактики НМГ.
В настоящее время все шире в клиническую практику внедряются допплерография и цветное допплеровское картирование. При оценке состояния маточного кровотока у родильниц без профилактического применения НМГ на 7–8-е сутки послеродового периода отмечено достоверное снижение индексов периферической резистентности сосудов в аркуатных артериях, возможно, вследствие замедления инволюции матки или из-за наличия потенциальной инфекции. У родильниц основной группы при анализе полученных допплерограмм выявлена тенденция к увеличению индекса резистентности в аркуатных артериях и, следовательно, повышение перфузии матки и улучшение реологических свойств крови (табл. 7). Этот факт мы рассматриваем как положительный эффект профилактического назначения НМГ.
Таким образом, понимание взаимосвязи в развитии тромботических и воспалительных процессов позволяет патогенетически подойти к прогнозированию возможных послеродовых осложнений. Проведенные нами исследования доказывают необходимость включения НМГ в комплекс профилактических мероприятий при ведении родильниц с факторами умеренного риска развития тромботических осложнений, так как эти препараты обладают не только антикоагулянтной активностью, но и противовоспалительными свойствами.