С одной стороны, современные подходы к хирургическому лечению злокачественных новообразований основываются на расширении объемов хирургических вмешательств с целью повышения их радикальности, а с другой – на сохранении высокого качества жизни пациента [1]. В последние годы активно изучаются нервосберегающие подходы к хирургическому лечению при таких заболеваниях, как рак прямой кишки, простаты и шейки матки. Так, было доказано, что сохранение вегетативных нервных сплетений при операциях на органах малого таза достоверно снижает частоту урологических расстройств у мужчин и женщин, нарушений сексуальной функции у мужчин [2–4].
Несмотря на накопленный опыт в области нервосберегающей хирургии, уровень функциональных послеоперационных осложнений остается неудовлетворительным. Создание и внедрение новых хирургических подходов упростят работу хирурга и снизят частоту развития осложнений. Одной из таких технологий является рассечение тканей с помощью водоструйного диссектора. Основными преимуществами данного метода являются селективное выделение и сохранение нервных волокон и сосудов с минимальной деформацией окружающих тканей. Использование метода водоструйной диссекции позволяет наиболее деликатно разделять ткани без термического воздействия [5].
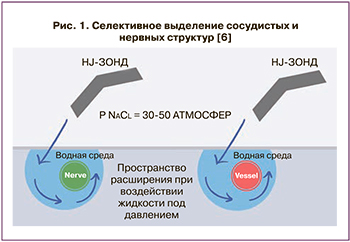 Метод водоструйной диссекции основан на формировании циркулярно закрученной тончайшей водной струи, выбрасывающейся под давлением из сопла рабочей рукоятки. Для выделения нервных структур малого таза используется давление в 50–100 бар (5–15 МПа) (рис. 1) [6].
Метод водоструйной диссекции основан на формировании циркулярно закрученной тончайшей водной струи, выбрасывающейся под давлением из сопла рабочей рукоятки. Для выделения нервных структур малого таза используется давление в 50–100 бар (5–15 МПа) (рис. 1) [6].
Вопрос об оптимальном давлении жидкости при водоструйной диссекции остается дискутабельным. В экспериментальном исследовании на лабораторных крысах H. Alenezi et al. оценивали давление потока жидкости при выделении кавернозных нервов. В группе сравнения 8 крысам гидродиссекция выполнена при давлении 15 бар, в группе контроля у 7 животных кавернозные нервы выделялись стандартным методом диссекции. Функциональная оценка активности кавернозного нерва оценивалась с помощью регистрации интракавернозного давления при прямой стимуляции нерва через 4 недели после эксперимента. В группе сравнения среднее интракавернозное давление оказалось почти в два раза выше (65,4 см и 33,4 см водного столба соответственно). При этом значимых различий в выраженности фиброза тканей при морфологическом исследовании выявлено не было. Таким образом, полученные результаты свидетельствуют о безопасности высокого давления при диссекции нервных структур [7]. В другом экспериментальном исследовании на околоушной железе собаки функция нервов оставалась не затронутой при давлении жидкости до 40 бар [8].
В клинических наблюдениях, описывающих технику водоструйной диссекции при выполнении нервосберегающих операций, отмечено, что давление 16–21 бар не приводит к нарушению функции нервов у пациентов [9].
Таким образом, основным преимуществом хирургического подхода с использованием водоструйного диссектора по сравнению с другими методами является селективное разделение тканей. Более того, полное отсутствие термического повреждения окружающих тканей по сравнению с ультразвуковой или электрохирургической диссекцией является еще одним преимуществом этой технологии.
Применение водоструйного диссектора в клинической практике
Первые экспериментальные работы, посвященные методу водоструйной диссекции, стали появляться в литературе в конце 80-х – начале 90-х гг. XX в. Так, в 1980 г. метод водоструйной диссекции впервые использован в клинической практике для рассечения костной ткани при выполнении эндопротезирования [10]. В 1982 г. D.N. Papachristou и R. Barters впервые описали применение для диссекции ткани печени водной струи [11].
Результаты первых клинических исследований в 80-х гг. прошлого столетия инициировали разработку первого водоструйного диссектора Helix hydro-jet, которая завершилась его созданием в 2001 г. Правила использования водоструйного диссектора в практической хирургии сформулированы в ходе многочисленных экспериментальных работ [8, 9]. Важно отметить, что в зависимости от давления водной струи, расстояния от сопла до рассекаемой поверхности можно варьировать глубину проникновения в ткани, а также степень рассеивания.
Первые исследовательские работы, описывающие метод водоструйной диссекции, посвящены типичным резекциям печени при первичных и метастатических опухолях в качестве атравматичного доступа к глиссоновым пучкам, позволяющего избежать значительного рассечения паренхимы печени [12, 13]. Метод нашел широкое применение и в области нейрохирургии для прицельного препарирования и рассечения в пограничной зоне между опухолью и мозговой структурой [14]. В работе J. Piek et al. описан метод водоструйной диссекции при удалении опухолей головного мозга. Давление струи в 6 бар позволяло создать наиболее прецизионные зоны диссекции; при этом морфологическое исследование показало отсутствие повреждения и отека окружающих тканей [15].
В последнее десятилетие метод водоструйной диссекции активно используется в оперативной хирургии малого таза при злокачественных новообразованиях прямой кишки, простаты. Встречаются единичные сообщения, касающиеся изучения нервосберегающей техники операции Вертгейма при раке шейке матки (РШМ). В данном обзоре литературы представлены основополагающие работы применения водоструйного диссектора при нервосберегающих операциях на органах малого таза.
Нервосберегающая расширенная простатэктомия
В 1982 г. P.C. Walsh и P.J. Donker заложили начало нейроанатомии предстательной железы, дав точное описание топографической анатомии вегетативных нервных сплетений малого таза, иннервирующих кавернозные тела [16].
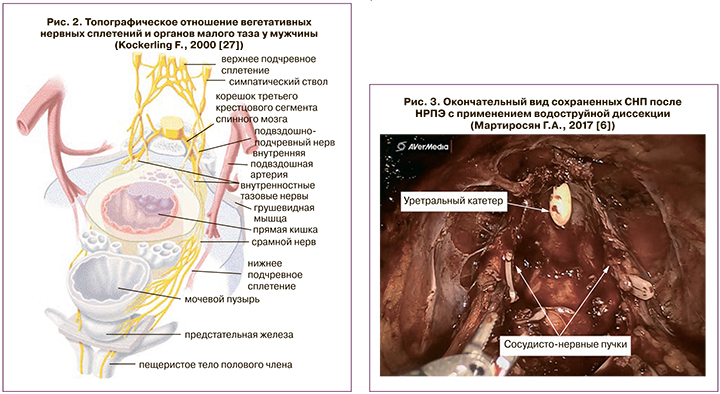
Выделяют три основных функциональных компонента сосудисто-нервного пучка (СНП). Первый компонент включает в себя заднебоковые нервы, проходящие по задней поверхности мезоректальной фасции, осуществляя иннервацию прямой кишки. Второй компонент представляет собой боковые нервы, иннервирующие мышцу, поднимающую задний проход. И, наконец, третий компонент, – это нервные волокна кавернозных тел (рис. 2). Описание авторами локализации и хода компонентов СНП дало возможность для более подробного изучения нейроанатомии и поиска хирургических методов, позволяющих сохранить вегетативную иннервацию малого таза [17–20].
Выделение предстательной железы происходит благодаря прецизионной диссекции тканей тончайшей струей воды; при этом сила давления воды в 15–20 бар позволяет селективно выделить сосуды и нервные волокна и рассечь мышечные структуры [20]. На сегодняшний день в мировой периодической литературе представлено не более десятка исследований с применением метода водоструйной диссекции при нервосберегающей расширенной простатэктомии (НРПЭ) [21–24].
Впервые техника НРПЭ с использованием метода водоструйной диссекции была описана в 2002 г. S. Fernandez de La Maza et al. [3]. Исследование включало в себя две группы по 18 пациентов: в группе контроля выполнялась стандартная расширенная простатэктомия, в группе сравнения – НРПЭ с использованием водоструйного диссектора Helix Hydro Jet. Контрольной точкой исследования являлась оценка показателей интраоперационной кровопотери, частоты переливания компонентов крови, времени операции и частоты осложнения. Оценивались результаты операции: функция нижних мочевых путей и восстановление эректильной функции. По сравнению со стандартной расширенной простатэктомией операции с использованием метода водоструйной диссекции оказались более простыми в техническом исполнении, что отразилось на продолжительности хирургического вмешательства, время которого сократилась на 20%. В группе сравнения средний объем интраоперационной кровопотери сократился на 36% и составил 830 мл. Через 3 месяца после хирургического вмешательства проводилась оценка эректильной функции с помощью Международного индекса эректильной функции 5 (МИЭФ-5). У 80% пациентов группы сравнения результаты продемонстрировали восстановление потенции, а в контрольной группе этот показатель не превышал 56% наблюдений.
В России группой авторов под руководством Д.Ю. Пушкаря в 2012 г. опубликовано единственное рандомизированное исследование, анализирующее результаты хирургического лечения 98 больных раком предстательной железы. Всем пациентам хирургическое вмешательство было выполнено на роботической хирургической системе DaVinci Surgical System. Пациенты были разделены на две группы: основная группа – 50 пациентов с сохранением СНП при помощи гидродиссекции на аппарате ERBEJET 2 и контрольная группа – 48 пациентов с сохранением СНП общепринятой техникой. Эректильная функция, так же, как и в предыдущих исследованиях, оценивалась при помощи МИЭФ‑5. Дооперационные показатели МИЭФ-5 в обеих группах были сопоставимы. Через 3 месяца наблюдения в основной группе средний показатель МИЭФ-5 был на 2,8 балла выше по сравнению с аналогичным показателем контрольной группы. Спустя 6 месяцев разница в суммарном балле МИЭФ-5 была выше в основной группе на 2,5 балла. Через 12 месяцев не было выявлено статистически значимых различий исследуемого параметра между группами. Результаты исследования обоснованно демонстрируют более быстрое восстановление эректильной функции у больных раком предстательной железы, которым выполнялась роботическая радикальная простатэктомия с использованием гидродиссекции, по сравнению с пациентами без нее [24].
Схожие результаты продемонстрированы в работе Г.А. Мартиросяна и соавт., посвященной использованию водоструйной диссекции при раке предстательной железы (рис. 3) [6]. В исследование включены 129 пациентов, которым выполнялась операция в объеме НРПЭ. В группе контроля 96 пациентам выполнена НРПЭ по стандартной методике с односторонним или двусторонним сохранением СНП. В группе сравнения в 33 случаях хирургическое вмешательство производилась на роботической установке Da Vinci Surgical System с использованием водоструйного диссектора ERBEJET 2. Автор сделал вывод о сохранности эректильной функции после роботической НРПЭ, где при селективном выделении СНП использовали метод водоструйной диссекции. В исследовании получена статистически значимая разница по шкале МИЭФ-5 до и после операции: 1±5 баллов против 4±6 баллов (p<0,001) по сравнению с группой пациентов, которым производилась НРПЭ по общепринятой методике.
Таким образом, атравматичная мобилизация предстательной железы водной струей позволяет предотвратить повреждение капсулы простаты, вегетативных нервных сплетений и селективно пересечь сосуды. Эти обстоятельства приводят к сокращению интраоперационной кровопотери, сохранению эректильной функции и профилактике инконтиненции в послеоперационном периоде [21].
Нервосберегающая тотальная мезоректумэктомия
В 1982 г. Richard John Heald et al. опубликовали статью в журнале British Journal of Surgery, посвященную технике тотальной мезоректумэктомии (ТМЭ). Данная публикация стала революционной в онкопроктологии, оставляя за собой «эпоху до ТМЭ», когда пятилетняя выживаемость не превышала 50%, а частота местных рецидивов достигала 30% [25].
В 1998 г. в журнале Archives of Surgery опубликовано исследование R.J. Heald, демонстрирующее отдаленные результаты применения техники ТМЭ. Так, среди пациентов, которым была выполнена ТМЭ по поводу рака прямой кишки, частота развития местных рецидивов составила 3,0% через 5 лет и 4,0% спустя 10 лет; пятилетняя безрецидивная выживаемость достигала 80%, а десятилетняя – до 78% [26].
Таким образом, полученный R.J. Heald научно-обоснованный анализ хирургического лечения рака прямой кишки с применением техники ТМЭ показал значительное улучшение отдаленных онкологических результатов. Техника ТМЭ подразумевает выделение прямой кишки в эмбриональном слое – фасциально-жировом футляре, в пределах мезоректальной фасции с сохранением вегетативной иннервации органов малого таза. На сегодняшний день число исследовательских работ в мировой литературе, посвященных возможностям применения водоструйной диссекции при ТМЭ, не превышает десяти [27–30].
К одному из таких исследований следует отнести научную работу F. Kockerling, которая была опубликована в 2000 г. [27]. В исследование включены 49 пациентов, которым выполнено хирургическое вмешательство в объеме низкой передней резекции прямой кишки с использованием водоструйного диссектора. Послеоперационная нейрогенная дисфункция нижних мочевых путей имела место только у 14% больных. Нейрогенная дисфункция мочевого пузыря спустя 3 месяца после операции наблюдалась в 6% наблюдений. Авторы сделали вывод, что использование водоструйного диссектора при выполнении нервосберегающей резекции прямой кишки значительно упрощает ее выполнение и позволяет выделить вегетативные нервные сплетения быстрее, не травмируя ткани.
A. Touloumtzidis и P. Kühn данную методику при ТМЭ применили у 226 пациентов, проходивших лечение по поводу рака прямой кишки [30]. Медиана наблюдения составила 35 месяцев. В послеоперационном периоде несостоятельность анастомоза наблюдалась в 5,7% наблюдений, раневые инфекции, включая промежностные, – в 29,5%, внутрибрюшные инфекции – в 7,6% и инфекции мочевых путей – в 7,6%. Что касается послеоперационной дисфункции мочевого пузыря, требующей катетеризации, то это осложнение было нечастым и наблюдалось лишь у 1,9% больных. В 8% случаев отмечен местный рецидив, в том числе у трех пациентов, перенесших неоадъювантную химиолучевую терапию. Пятилетняя опухоль-специфическая выживаемость составила 74%. Таким образом, отдаленные онкологические результаты операции оказались сопоставимыми с таковыми после стандартных хирургических подходов.
В нашей стране первый опыт применения водоструйного диссектора при хирургических вмешательствах по поводу рака прямой кишки был продемонстрирован Д.В. Сидоровым и соавт. [31]. В исследование включены 20 пациентов, которым выполнена операция в объеме низкой передней резекции прямой кишки, парааортальная лимфаденэктомия (рис. 4, 5).

На первом этапе с помощью метода водоструйной диссекции проводилась мобилизация ректосигмоидного отдела толстой кишки. При выделении задней и боковых стенок прямой кишки производилось селективное выделение гипогастральных нервов с последующим отделением от мезоректальной фасции. Гидродиссекция в так называемом, священном аваскулярном слое («holy plane», по H.J. Heald) позволила сохранить внутритазовую фасцию, покрывающую пресакральные сосуды, внутренние подвздошные сосуды и грушевидные мышцы. У всех пациентов зарегистрирован минимальный объем кровопотери. При оценке функционального результата операций отмечено отсутствие дизурических нарушений. Самостоятельное мочеиспускание восстановилось в 1-е сутки сразу после удаления мочевого катетера.
Нервосберегающая радикальная гистерэктомия
На сегодняшний день во всем мире расширенная гистерэктомия (РГЭ) С2 типа является стандартом хирургического лечения инвазивного РШМ IB–IIA стадий. При этом показатели 5-летней общей выживаемости достигают 80–90%. Объем РГЭ С2 типа по классификации радикальных гистерэктомий D. Querleu и C.P. Morrow (2008) включает иссечение крестцово-маточной связки у прямой кишки и пузырно-маточной связки у мочевого пузыря, полное выделение мочеточников, резекцию 15–20 мм влагалища от опухоли или шейки матки, иссечение околовагинальных тканей без сохранения вегетативных нервных сплетений малого таза [32].
Расширенные хирургические вмешательства по поводу РШМ часто сопровождаются нарушением функции мочевыделительной системы. Основная причина развития дисфункции нижних мочевых путей – повреждение компонентов вегетативной нервной системы малого таза [33, 34]. При иссечении дорсального параметрия на этапе удаления крестцово-маточной связки происходит повреждение симпатической иннервации малого таза, а именно правого и левого гипогастральных нервов. Иссечение латерального параметрия в составе кардинальной связки, а также диссекция в области внутренней подвздошной вены приводят к повреждению парасимпатической части вегетативной нервной системы малого таза в виде веточек S2–S4 крестцового сплетения.
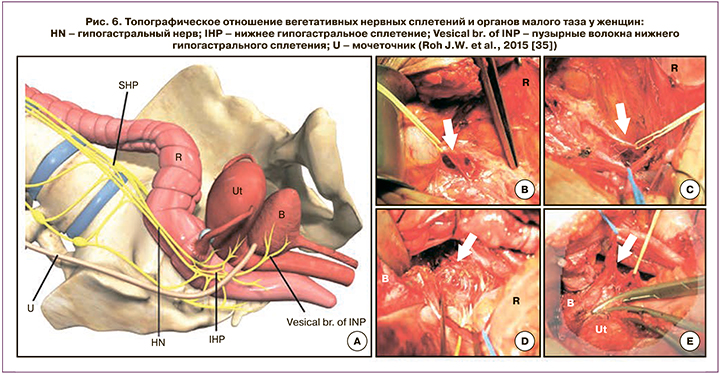
Травма нервных веточек пузырного сплетения происходит при иссечении заднего листка пузырно-маточной связки (рис. 6) [35]. К значительному улучшению функциональных результатов привело создание нервосберегающей техники операции РГЭ.
 Нервосберегающая расширенная гистерэктомия (НРГЭ), или РГЭ С1 типа, уменьшает риск возникновения дисфункции нижних мочевых путей, так как сохраняются сплетения вегетативной нервной системы малого таза, расположенные в непосредственной близости от области вмешательства [36, 37].
Нервосберегающая расширенная гистерэктомия (НРГЭ), или РГЭ С1 типа, уменьшает риск возникновения дисфункции нижних мочевых путей, так как сохраняются сплетения вегетативной нервной системы малого таза, расположенные в непосредственной близости от области вмешательства [36, 37].
В нашей стране техника модифицированной НРГЭ, или РГЭ С1 типа, в сочетании с нервосберегающей парааортальной лимфаденэктомией описана и внедрена в работу отделения опухолей репродуктивных и мочевыводящих органов МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России (рис. 7–9). Модифицированная расширенная НРГЭ является научно обоснованным анатомо-физиологическим методом радикального хирургического лечения РШМ IВ1–IIB стадий, обуславливающим эффективную профилактику послеоперационных осложнений в сравнении со стандартной РГЭ. При этом показатели 5-летней общей и безрецидивной кумулятивной выживаемости не отличаются от результатов стандартного хирургического лечения.
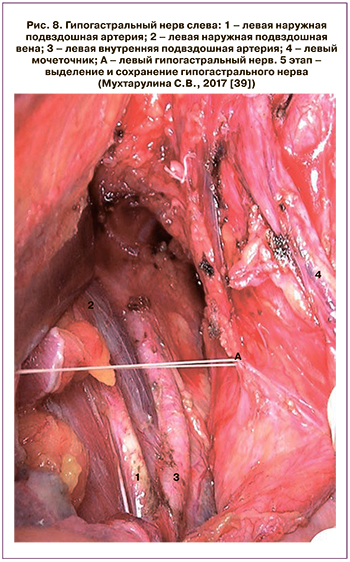 Проведенное клиническое наблюдение и инструментальные методы, такие как цисто- и урофлоуметрия, показали, что нервосберегающий подход позволяет добиться наилучших функциональных результатов и приводит к значительному снижению случаев нарушений функции мочевыделительной системы, носящих кратковременный характер. В группе сравнения при иссечении вегетативных нервных сплетений малого таза и забрюшинного парааортального пространства функциональные нарушения со стороны мочевыделительной системы встречались в четыре раза чаще и были более длительными [38, 39].
Проведенное клиническое наблюдение и инструментальные методы, такие как цисто- и урофлоуметрия, показали, что нервосберегающий подход позволяет добиться наилучших функциональных результатов и приводит к значительному снижению случаев нарушений функции мочевыделительной системы, носящих кратковременный характер. В группе сравнения при иссечении вегетативных нервных сплетений малого таза и забрюшинного парааортального пространства функциональные нарушения со стороны мочевыделительной системы встречались в четыре раза чаще и были более длительными [38, 39].
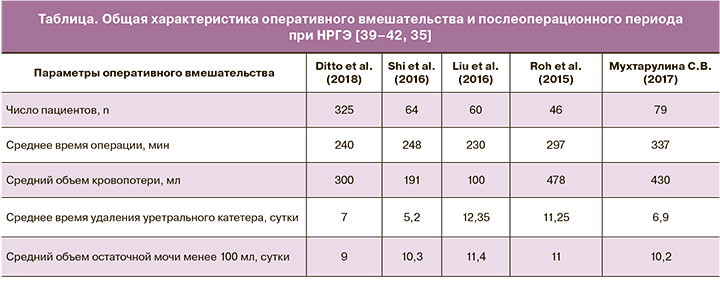
Таким образом, нервосберегающий подход в сравнении с общепринятой техникой операции ведет к восстановлению функции мочевого пузыря в послеоперационном периоде в более сжатые сроки. Напротив, удаление вегетативных нервных сплетений малого таза и забрюшинного парааортального пространства ухудшает функциональные результаты в виде более длительной катетеризации мочевого пузыря и максимального удлинения сроков восстановления функции мочевого пузыря (таблица).
Однако при традиционной технике диссекции риски повреждения нервных волокон высоки ввиду трудности распознавания и выделения нервных волокон. В этой связи использование водоструйного диссектора для визуализации и выделения вегетативных сплетений малого таза может привести к улучшению послеоперационных результатов со стороны мочевыделительной системы.
 На сегодняшний день в мировой литературе описано единственное рандомизированное исследование, посвященное применению метода водоструйной диссекции при НРГЭ [4]. Китайские ученые сравнивали показатели уродинамического исследования после лапароскопической НРГЭ с использованием водоструйного диссектора (основная группа) и стандартной лапароскопической НРГЭ (контрольная группа). Критерии включения в исследование были следующими: пациентки с диагнозом РШМ IB стадии (FIGO), нормальные показатели уродинамического исследования перед НРГЭ. Всем женщинам проводили эти обследования за 2 недели до и через 4 месяца (±2 недели) после операции. В исследование были включены 160 пациенток, при этом в каждую группу были рандомизированы по 80 женщин. Через 14 дней после хирургического вмешательства в основной группе у 82,5% пациенток количество остаточной мочи составляло ≤100 мл, в отличие от контрольной группы – 62,5% (р=0,005). Через 4 месяца после хирургического лечения проведено контрольное уродинамическое исследование. В контрольной группе нейрогенная дисфункция мочевого пузыря наблюдалась у 7 пациенток (8,8%), в основной группе – в 4 (3,8%) случаях (p=0,349). Через 12 месяцев симптомы нейрогенной дисфункции мочевого пузыря у женщин основной группы уже отсутствовали, а у 1 пациентки контрольной группы сохранились явления стрессового недержания мочи. Через 33 месяца при оценке отдаленных результатов исследования авторы не выявили статистически значимых различий между общей и безрецидивной выживаемостью пациентов контрольной и основной групп. Таким образом, ученые сделали вывод, что использование водоструйной диссекции при НРГЭ приводит к более быстрому восстановлению мочевыделительной функции в послеоперационном периоде, при этом не оказывая влияния на выживаемость пациентов.
На сегодняшний день в мировой литературе описано единственное рандомизированное исследование, посвященное применению метода водоструйной диссекции при НРГЭ [4]. Китайские ученые сравнивали показатели уродинамического исследования после лапароскопической НРГЭ с использованием водоструйного диссектора (основная группа) и стандартной лапароскопической НРГЭ (контрольная группа). Критерии включения в исследование были следующими: пациентки с диагнозом РШМ IB стадии (FIGO), нормальные показатели уродинамического исследования перед НРГЭ. Всем женщинам проводили эти обследования за 2 недели до и через 4 месяца (±2 недели) после операции. В исследование были включены 160 пациенток, при этом в каждую группу были рандомизированы по 80 женщин. Через 14 дней после хирургического вмешательства в основной группе у 82,5% пациенток количество остаточной мочи составляло ≤100 мл, в отличие от контрольной группы – 62,5% (р=0,005). Через 4 месяца после хирургического лечения проведено контрольное уродинамическое исследование. В контрольной группе нейрогенная дисфункция мочевого пузыря наблюдалась у 7 пациенток (8,8%), в основной группе – в 4 (3,8%) случаях (p=0,349). Через 12 месяцев симптомы нейрогенной дисфункции мочевого пузыря у женщин основной группы уже отсутствовали, а у 1 пациентки контрольной группы сохранились явления стрессового недержания мочи. Через 33 месяца при оценке отдаленных результатов исследования авторы не выявили статистически значимых различий между общей и безрецидивной выживаемостью пациентов контрольной и основной групп. Таким образом, ученые сделали вывод, что использование водоструйной диссекции при НРГЭ приводит к более быстрому восстановлению мочевыделительной функции в послеоперационном периоде, при этом не оказывая влияния на выживаемость пациентов.
Заключение
Таким образом, использование метода водоструйной диссекции в оперативной хирургии малого таза при злокачественных новообразованиях простаты, прямой кишки позволяет визуализировать, прецизионно и атравматично выделить сосудисто-нервный пучок, что обоснованно приводит к уменьшению интраоперационной кровопотери и функционально значимых послеоперационных осложнений со стороны мочевыделительной и половой систем. Дальнейшее изучение новых технологий при выполнении НРГЭ позволит оценить функциональную эффективность и онкологическую безопасность данной методики при РШМ.



