В попытке минимизировать число послеоперационных функциональных осложнений японской школой онкогинекологов впервые разработана концепция нервосберегающего подхода при радикальном хирургическом лечении инвазивного рака шейки матки (РШМ). Так, T. Kobayashi модифицировал операцию H. Okabayashi (1921) и в 1961 г. опубликовал методику нервосберегающей гистерэктомии, основанную на сохранении нижних гипогастральных нервов и веточек тазового сплетения при диссекции латерального параметрия [1]. В дальнейшем хирургическая техника систематического сохранения элементов вегетативной нервной системы (ВНС) малого таза была усовершенствована и подробно описана в работах таких японских онкогинекологов, как S. Takizawa (1988) [2], N. Sakuragi et al. (2005) [3].
За последнее десятилетие в мировой литературе опубликовано более 100 исследований, подтверждающих, что сохранение элементов ВНС малого таза позволяет значимо снизить количество послеоперационных функциональных расстройств мочеполовой системы, при этом сохранив высокий уровень отдаленных онкологических результатов лечения [5, 6-8].
Несмотря на накопленный опыт в области нервосберегающей хирургии малого таза, уровень функциональных послеоперационных осложнений остается неудовлетворительным [9]. Поэтому создание и внедрение новых хирургических подходов позволяет упростить работу хирурга и снизить уровень осложнений. Одной из таких технологий является рассечение тканей с помощью водоструйного диссектора. Основным преимуществом данного метода является селективное выделение и сохранение нервных волокон и сосудов с минимальной деформацией окружающих тканей при отсутствии термического воздействия.
Целью представленного исследования является оценка функциональных результатов лечения у больных РШМ IB1-IIB стадий после расширенной РГЭ С1 типа (нервосберегающей РГЭ) с использованием водоструйного диссектора. В данной статье представлен первый российский опыт применения метода водоструйной диссекции при расширенной РГЭ C1 типа у пациенток с инвазивным РШМ.
Материалы и методы
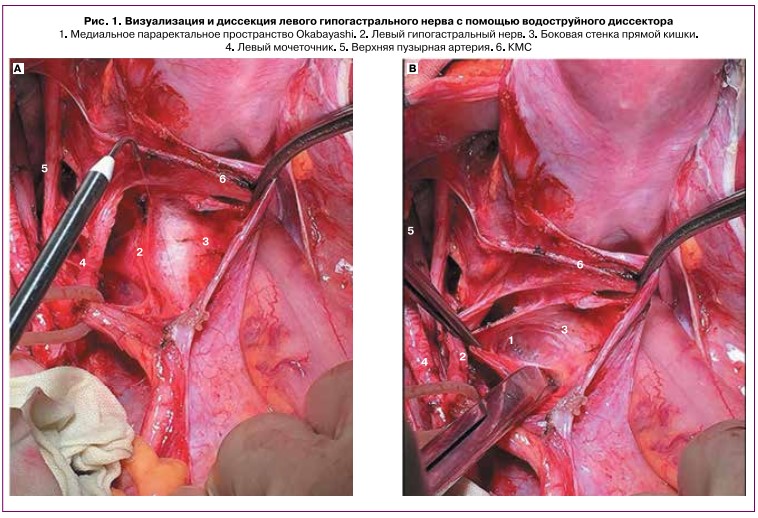
В исследование включены 82 пациентки с морфологически верифицированным РШМ IB1- 11В стадий, которым в период 2017-2021 гг. на базе отделения онкогинекологии МНИОИ им. П.А. Герцена, отделения гинекологии с химиотерапией НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина - филиалов ФГБУ «НМИЦ радиологии» Министерства здравоохранения Российской Федерации проведена расширенная РГЭ по поводу инвазивного РШМ. Основную группу составили 30 пациенток, которым выполнена расширенная РГЭ С1 типа с тазовой и пара- аортальной лимфаденэктомией с применением метода водоструйной диссекции с использованием установки ERBEJET2. Применение водоструйного диссектора начинали при раскрытии медиального параректального пространства Okabayashi. На латеральной поверхности крестцово-маточной связки (КМС) визуализировали проксимальную часть нижнего гипогастрального сплетения (plexus hypogastricus inferior). Струю воды диаметром 0,1 мм под давлением 20-35 Бар направляли параллельно плоскости КМС, отступя от визуализируемых нервных сплетений 3-5 мм. Выделение гипогастрального нерва проводили от мыса крестца до места пересечения с маточными сосудами, после чего
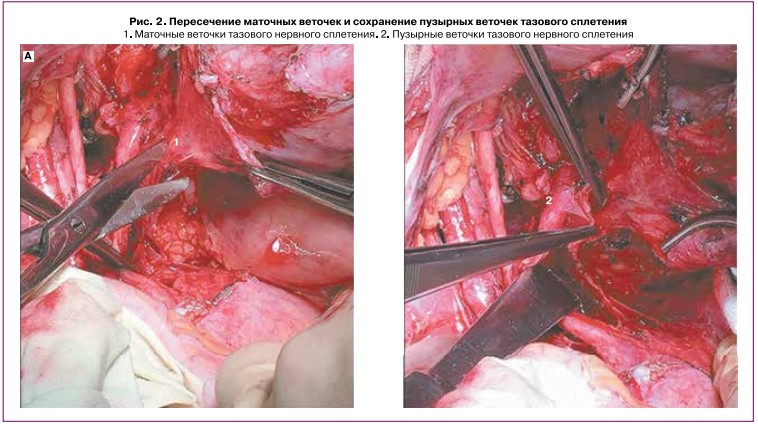
выполняли удаление КМС. После пересечения глубокой маточной вены выполняли диссекцию водной струей тазового или нижнего гипогастрального сплетения, располагающегося на боковом своде влагалища в околовлагалищной клетчатке (рис. 1). Далее с помощью водоструйного диссектора выделяли пузырные ветви тазового сплетения из толщи пузырно-маточной связки (ПМС), после чего под визуальным контролем пузырных ветвей тазового сплетения проводили пересечение ПМС. Тазовое сплетение после пересечения маточных веточек смещалось латерально (рис. 2).
В группу контроля вошли 52 пациентки, которым проведено хирургическое вмешательство в объеме РГЭ 2 типа с тазовой и парааортальной лимфаденэктомией. Критериями включения пациенток в настоящее исследование являлись: стадия опухолевого процесса IB1—IIB, общесоматический статус по шкале ECOG 0—1, отсутствие предоперационной лучевой и/или химиотерапии, отсутствие выраженных уродинамических нарушений и патологии со стороны мочевыделительной системы. Критерии исключения из исследования представляли собой наличие отдаленных метастазов на стадии предоперационного обследования, грубые функциональные нарушения или пороки развития со стороны мочевыделительной системы, а также предшествующие хирургические вмешательства на органах мочевыделительной системы.
Основные оцениваемые параметры: интраоперационные показатели, среднее время удаления уретрального катетера и сутки объема остаточной мочи (ООМ) менее 100 мл, а также наличие нейрогенной дисфункции мочевого пузыря в послеоперационном периоде.
Статистический анализ
Проведена статистическая обработка полученных данных с помощью R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria). Проверка данных на нормальность распределения была выполнена с помощью теста Шапиро—Уилка. В качестве описательных статистик для количественных показателей посчитаны средние±средние квадратические отклонения (M (SD); медиана и квартили [Me (Q1;Q3)]; минимальные и максимальные значения в выборке. Сравнение медиан в группах проводилось с помощью теста Манна- Уитни, частот — с помощью точного теста Фишера. Различия признавались статистически значимыми на уровне р<0,05.
Результаты
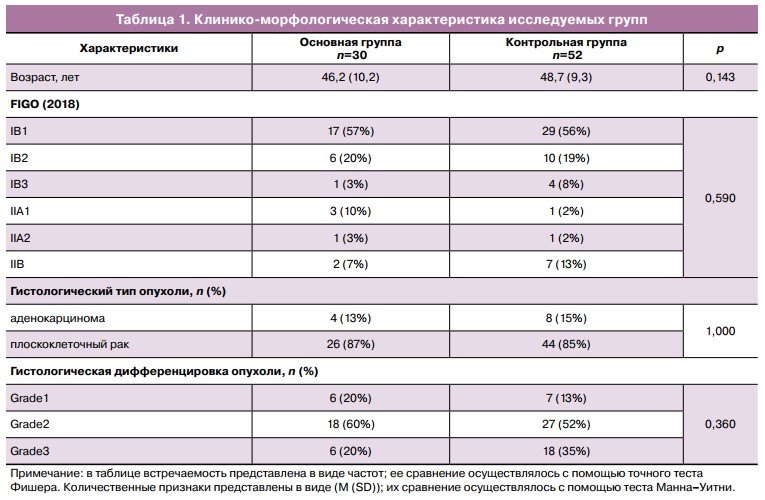
Средний возраст пациенток основной группы составил 46,7 (11,8) года, группы контроля — 48,7 (9,3) года. Распределение пациенток основной группы по стадиям FIGO (2018) было следующим: IB стадия определена у 24/30 (80%) пациенток, IIA — у 4/30 (13%), IIB — у 2/30 (7%). В группе контроля распределение по стадиям было следующим: IB — 43/52 (83%), IIA — 2/52 (4%), IIB — 7/52 (13%).
При морфологическом исследовании материала в основной группе плоскоклеточный рак определен у 26/30 (87%) пациенток, аденогенный — у 4/30 (13%). В группе контроля в морфологической структуре также преобладал плоскоклеточный тип опухоли — в 44/52 (85%) случаях. Сравнение клинико-морфологических характеристик в исследуемых группах не выявило значимых различий (табл. 1).
Что касается оценки основных интраоперационных показателей, то в основной группе применение метода водоструйной диссекции привело к статистически значимому сокращению времени хирургического вмешательства (180 [160;200] минут против 300 [225;345] минут; р<0,001). В основой группе средний объем кровопотери составил 100 [100;140]
мл, тогда как в группе контроля данный показатель составил 712 [525;875] мл соответственно (р<0,001). Средний уровень интраоперационного гемоглобина в основной группе составил 115 [105;125] г/л, в группе контроля — 103 [98;108] г/л соответственно (р<0,001) (табл. 2).

Применение метода водоструйной диссекции в основной группе позволило сократить время до удаления уретрального катетера (2 [2;3] суток против 16 [11,5;20] суток; р<0,001), а также минимизировать сроки восстановления мочеиспускания по критерию ООМ менее 100 мл (3 [3;4] суток против 21 [20;25] суток; р<0,001). В основной группе ни у одной пациентки в послеоперационном периоде не было отмечено клинических признаков нейрогенной дисфункции мочевого пузыря. В то время как в группе контроля пациентки сталкивались с проявлениями нейрогенной дисфункции мочевого пузыря в 26,2% случаев (р<0,001) (табл. 3).

В основной группе число койко-дней составило 9 [8; 11] суток, в группе контроля данный показатель составил 20 [17,5;25] суток (р<0,001).
Обсуждение
На сегодняшний день в рекомендациях по лечению РШМ не описано стандартизованной техники нервосберегающей РГЭ [10]. Также не выделен общепринятый подход для визуализации и идентификации нервных волокон, а все методики являются авторскими и находят свое применение в рамках одной клиники [11]. Оригинальные техники нервосберегающей РГЭ представлены в работах многих японских онкологов-гинекологов, основанных на детальном изучении анатомических элементов тазовых нервных сплетений [3, 4, 12, 13].
Предложенные техники варьировали в зависимости от отношения к различным классификационным системам. Так, при нервосберегающей ГЭ по Piver III типа для хирурга затруднительно идентифицировать нижнее гипогастральное сплетение. А в классификации Querleu-Morrow (2008) и методе TMMR (Total mesometrial resection), предложенном Hockel M. et al., не указана роль выделения пузырно-влагалищной связки, что вызывало критику ряда авторов [14-16].
Краеугольным камнем сохранения тазовых нервных сплетений является четкое определение границ параметральной резекции [17]. Хирургическая анатомия забрюшинных нервных сплетений наиболее подробно продемонстрирована D. Cibula et al. в новой классификационной системе РГЭ. Границы параметральной резекции определялись в горизонтальном и вертикальном сечениях для вентрального, латерального и дорсального параметриев, что позволило сформировать своеобразную трехмерную анатомическую картину. В большинстве авторских техник нервосберегающей гистерэктомии описаны анатомические ориентиры, представленные в данной классификации. Так, согласно С1 типу классификации D. Cibula et al. (2011), при выделении мочеточника пересекается «крыша тоннеля», затем он выделяется от латерального и частично от вентрального параметриев (на 1-2 см). При этом вертикальная граница резекции вентрального параметрия - пузырные веточки нижнего гипогастрального сплетения. Линия горизонтального иссечения латерального параметрия проходит по медиальному краю внутренней подвздошной артерии и вены. Вертикальная граница иссечения латерального параметрия находится на уровне глубокой маточной вены. На этом участке нижележащие слои латерального параметрия содержат веточки ВНС малого таза. Что касается вентрального параметрия, то линия горизонтального иссечения проходит у места прикрепления ПМС к прямой кишке, а вертикальная граница — тазовое сплетение и гипогастральный нерв. Таким образом, в данной классификации детально описаны границы параметральной резекции, позволяющие прецизионно выделить и сохранить ВНС малого таза [18].
В 2007 г. Fujii et al. представили свой опыт проведения нервосберегающей операции в модификации Okabayashi, подробно изложив технические аспекты, позволяющие сохранить элементы вегетативной нервной системы малого таза. Авторы определили сосудистые ориентиры, позволяющие визуализировать нервные сплетения. Так, прецизионное выделение глубокой маточной вены на границе шейки матки и бокового свода верхней трети влагалища позволяет сохранить волокна нижнего гипогастрального сплетения, а определение хода нижней пузырной вены и артерии помогает визуализировать ход пузырных веточек тазового сплетения, идущих к задней стенке мочевого пузыря [4]. В исследовании М. Possover et al. из Йенского университета (Германия) авторы описывают такой сосудистый ориентир, как средняя прямокишечная артерия на уровне отхождения от внутренней подвздошной артерии, которая делит плоскость кардинальной связки на сосудистую и нервную части [19].
В данной статье нами описана оригинальная методика РГЭ С1 типа с использованием метода водоструйной диссекции, позволяющая значительно снизить частоту послеоперационных функциональных осложнений со стороны мочевыделительной системы. В отечественной литературе описан опыт успешного применения водоструйной диссекции в качестве нового метода анатомического рассечения тканей в области онкоурологии - Д.Ю. Пушкарь и соавт. [20] и колопроктологии - Д.В. Сидоров и соавт. [21].
Однако отсутствуют отечественные исследования, посвященные применению данной технологии в хирургии опухолей женской репродуктивной системы. На сегодняшний день в мировой литературе описано единственное рандомизированное исследование, посвященное применению метода водоструйной диссекции при нервосберегающей расширенной РГЭ [22]. Авторы исследования проводили сравнение показателей уродинамического исследования после лапароскопической нервосберегающей расширенной РГЭ с использованием водоструйного диссектора (основная группа) и стандартной лапароскопической нервосберегающей расширенной РГЭ (контрольная группа). В контрольной группе нейрогенная дисфункция мочевого пузыря наблюдалась у 7 пациенток (8,8%), в основной группе — в 4 (3,8%) случаях (^=0,349). При этом не выявлено статистически значимых различий между общей и безрецидивной выживаемостью пациентов контрольной и основной групп. Данное исследование позволяет авторам сделать вывод, что использование водоструйной диссекции при нервосберегающей расширенной РГЭ приводит к более быстрому восстановлению мочевыделительной функции в послеоперационном периоде, не оказывая влияния на выживаемость пациентов.
Таким образом, необходимо дальнейшее изучение перспективной методики с использованием водоструйного диссектора для оптимизации функциональных результатов лечения больных инвазивным РШМ.
Заключение
Анализ полученных данных первых результатов исследования позволяет предположить, что использование водной струи при диссекции тканей способствует упрощенному подходу к визуализации нервных волокон и, как следствие этого, наиболее атравматичному выделению вегетативных нервных сплетений малого таза. Таким образом, у больных инвазивным РШМ после РГЭ С1 типа с использованием водоструйного диссектора восстановление функции нижних мочевых путей происходит в более краткие сроки.



