Анемия относится к гематологическому синдрому, проявляющемуся снижением концентрации гемоглобина (Нb) и/или числа эритроцитов в единице объема крови, что приводит к уменьшению снабжения тканей кислородом и является одним из наиболее частых осложнений течения беременности, развития плода и исходов родов [1, 2]. По данным ВОЗ анемия у беременных в 20–80% железодефицитная (ЖДА) и характеризуется снижением содержания железа в сыворотке крови, костном мозге и других депо. Это связано с повышенной потребностью организма в железе, особенно во II и III триместрах беременности, когда увеличивается его адсорбция в тонком кишечнике. В результате создается естественный дефицит железа, нарушается образование гемоглобина и возникает кислороддефицитное состояние, приводящее к тканевой и гемической гипоксии [3, 4]. Показано, что при выраженной гемической гипоксии происходят изменения в плаценте, нарушается маточно-плацентарное кровообращение, вегетативный гомеостаз, система адаптации организма, что, в свою очередь, может привести к усилению напряжения и даже к срыву компенсаторно-защитных механизмов с неблагоприятными последствиями для матери, плода и потомства [5, 6]. Причинами развития ЖДА у беременных могут быть: анемия до наступления беременности, физиологические и дисфункциональные маточные кровотечения, изменение обмена железа из-за плохой утилизации организмом, ранний токсикоз, кровотечения при предлежании плаценты и др. В настоящее время используют следующую классификацию ЖДА: Нb от 90 до 109 г/л – легкая степень, Нb от 70 до 89 г/л – умеренная и Нb менее 70 г/л – тяжелая [7, 8]. Уровень ферритина (основной маркер ЖДА) ≤20 нг/л указывает на истощение запасов железа [9]. Терапия ЖДА у беременных в основном проводится пероральными препаратами железа, разделенными на две основные группы, определяющие их биодоступность и, соответственно, скорость восстановления Hb. Это соли двухвалентного железа, всасывающиеся в кишечнике (ферро-фольгамма, ферретаб, тотема, фенюльс и др. – ионные препараты) и железосодержащие комплексы трехвалентного железа – гидроксид-полимальтозные комплексы (мальтофер, феррум-лек, ферлатум и др.– неионные препараты), биодоступность которых в несколько раз ниже [10, 11]. Они основаны на включениях железа в виде сульфата, в соединении с витамином С, никотиновой или янтарной кислотами, которые стимулируют пристеночное пищеварение. Однако традиционная железозаместительная терапия является длительной, часто малоэффективной, с серьезными побочными эффектами, осложняющими течение беременности. Это объясняет рост интереса к немедикаментозным методам лечения ЖДА, которые могут заменить или существенно ограничить потребность в лекарственных средствах и эффективно воздействовать на различные звенья патологического процесса. В этом плане применение медицинского озона в комплексной терапии беременных с кислороддефицитным состоянием и развитием ЖДА может быть патогенетически обоснованным для получения положительного эффекта.
По данным литературы медицинский озон способствует усиленной отдаче кислорода недостаточно кровоснабжаемым тканям, восстановлению Hb, улучшению тканевого дыхания и маточно-плацентарного кровообращения, нормализации реологических свойств крови и повышению адаптационных возможностей организма [12]. Известно, что в регуляции адаптационных процессов, направленных на сохранение беременности, значительную роль играет вегетативная нервная система (ВНС).
В связи с этим целью настоящего исследования стало изучение корригирующих свойств медицинского озона, озона и железосодержащего препарата и только препарата железа в комплексной терапии ЖДА у беременных в отношении функционального состояния ВНС.
Материал и методы исследования
Обследованы 60 женщин в возрасте 29,6±4,5 года во II–III триместре гестации с ЖДА легкой и средней степени тяжести, установленной при данной беременности. Пациентки были разделены на 3 группы (по 20 в группе): в 1-ю группу вошли беременные, курс лечения которых состоял из озонотерапии (О3) – внутривенное капельное введение 200 мл озонированного физиологического раствора с концентрацией О3 400 мкг/л (5 сеансов через день); 2-ю группу (О3 + Fe) составили женщины, которым было проведено сочетанное лечение – озонотерапия (как в 1-й группе, 5 сеансов через день) + прием двухвалентного препарата железа перорально, состоящего из железа сульфата – 100 мг, фолиевой кислоты – 5 мг и витамина В12 – 10 мкг (по 1 капсуле 2 раза в день, до конца беременности – не менее 4 недель); в 3-ю группу вошли беременные, принимающие только препарат железа (Fe). Критериями включения беременных в группы явились: снижение уровня Hb от 70 до 110 г/л; уровень сывороточного ферритина – 20 мкг/л и ниже; коэффициент насыщения трансферрина железом менее 16%; содержание железа в сыворотке крови менее 12,5 мкмоль/л. Критериями исключения из исследования служили: заболевания крови (в том числе анемии, не связанные с дефицитом железа); анемия на фоне периодических кровотечений из половых путей во время настоящей беременности; прием тетрациклинов и антацидов; язвенная болезнь желудка и/или 12-перстной кишки; любая форма парентеральной терапии анемии препаратами железа в течение последних 20 дней до взятия под наблюдение, гиперфункция щитовидной железы, мочекаменная и/или желчекаменная болезни, а также наличие гипокоагуляции крови.
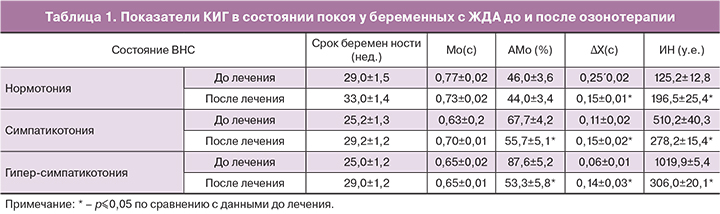
Состояние ВНС беременных женщин оценивали с помощью метода кардиоинтервалографического анализа (КИГ-анализ) с математической обработкой вариабельности сердечного ритма по Р.М. Баевскому, дающему обширную и разнообразную информацию о нейрогуморальной регуляции физиологических функций и адаптационных реакциях целостного организма [13]. Общеизвестно, что девиации ритма сердца отражают адаптацию организма в целом к экстремальным воздействиям и служат маркером функционального состояния ВНС [14]. Для провоцирования компенсаторно-защитных реакций применяли функциональную вентиляционную пробу в виде задержки дыхания на 20 сек. после выдоха. Проба, являясь безвредным гипокси-гиперкапническим воздействием, в сочетании с КИГ-анализом, позволяет выявить эффективность регуляторных механизмов и оценить степень их напряжения при различной патологии, в данном исследовании – при ЖДА [15].
У женщин в положении лежа на Мингографе-82 регистрировали ЭКГ во 2-м стандартном отведении (300 циклов) – в состоянии покоя, во время проведения функциональной пробы и в период восстановления (через 5 мин после пробы). Исследования проводили у всех больных дважды – до лечения и через 1 месяц после проведенной терапии.
При анализе КИГ расcчитывали моду (Мо) в с., амплитуду моды (АМо) в процентах и вариационный размах (∆Х) в с., характеризующие активность гуморального канала управления ритмом сердца, симпатического и парасимпатического отделов ВНС. Вычисляли индекс напряжения регуляторных систем (ИН) в условных единицах (у.е.), который является интегральным показателем степени централизации управления ритмом сердца (ЦУРС).
Полученные характеристики структуры сердечного ритма обследованных (согласно триместрам беременности) сравнивали с известными показателями здоровых беременных II и III триместров, выявленных А.Д. Поповым [16]. По его данным у здоровых беременных во II триместре в основном наблюдается нормотония (Мо – 0,79±0,02 с., АМо – 37,55±1,37%, ∆Х – 0,16±0,02 с., ИН – 166,0±12,5 у.е), а в III триместре – умеренная симпатикотония (Мо – 0,7±0,02 с., АМо – 39,75±2,97%, ΔХ – 0,13±0,02 с., ИН – 264,8±46,0 у.е.). Полученные результаты обрабатывали статистически с использованием критерия t Стьюдента.
Результаты и обсуждение
При обследовании женщин до лечения было обнаружено, что уровень Нb во всех группах колебался от 76 до 110 г/л, что соответствовало умеренной и легкой степени тяжести ЖДА. Средний уровень Нb составил 103,5±4,8 г/л, эритроцитов – 3,4±0,3×10×12/л, гематокрита – 0,32±0,03. Проведенный КИГ-анализ выявил у 75% беременных нарушения в функциональном состоянии ВНС –
широкий диапазон колебаний показателей структуры сердечного ритма – от ваготонии до гиперсимпатикотонии. Это проявлялось в разной активности контуров регуляции и степени вовлеченности в управление ритмом сердца холинергических и адренергических механизмов. В связи с чем в зависимости от показателей вегетативного тонуса и ЦУРС, женщины в каждой из трех групп были разделены на 4 подгруппы:
- 1-я подгруппа – ваготония – 6 беременных (10%) с крайне низким значением ЦУРС;
- 2-я подгруппа – нормотония – 15 беременных (25%) с нормальным или немного сниженным ЦУРС;
- 3-я подгруппа – симпатикотония – 30 беременных (50%) с высоким значением ЦУРС;
- 4-я подгруппа – гиперсимпатикотония – 9 беременных (15%) с чрезвычайно высокой ЦУРС.
У женщин трех групп с ваготонией до лечения в состоянии покоя ИН соответственно составил: 44,3±3,2 у.е.; 39,7±2,3 у.е. и 42,4±2,1 у.е. (в 3–4 раза ниже нормы). Проведение функциональной пробы и период восстановления выявили ослабление компенсаторно-защитных механизмов и функциональных резервов у пациенток всех трех групп. Терапия озоном, озоном + Fe и только Fe не приводила к повышению ЦУРС, компенсаторно-защитные механизмы оставались ослабленными (ИН соответственно: 43,8±2,5 у.е.; 26,3±3,7 у.е.; 35,9±2,4 у.е.), что указывало на отсутствие эффекта в отношении ВНС от проведенного лечения.
Результаты КИГ-анализа женщин 1-й группы (только О3) представлены в табл. 1. Как следует из таблицы, озонотерапия способствовала усилению ЦУРС в 1,6 раза у беременных с нормотонией и снижению процессов саморегуляции практически до нижней границы нормы, что свидетельствовало о повышении компенсаторно-защитных механизмов. У пациенток с симпатикотонией терапия озоном также оказывала положительное действие – в состоянии покоя снижалось напряжение регуляторных систем (в 1,8 раза) по сравнению с данными до лечения, реакция на пробу проходила с закономерным понижением ЦУРС, а в период восстановления показатели ЦУРС соответствовали нормальным значениям КИГ для беременных III триместра.
У женщин с гиперсимпатикотонией в состоянии покоя О3 способствовал понижению ЦУРС (в 3,3 раза) и усилению активности парасимпатического звена регуляции. Наблюдалось почти полное восстановление нормального уровня функционирования ВНС.
У пациенток 2-й группы (О3+Fe) с нормотонией до лечения в состоянии покоя напряжение регуляторных систем соответствовало значениям здоровых женщин II триместра беременности (табл. 2). Однако на функциональную пробу наблюдалась слабая реакция (ИН=112,6±8,9 у.е.). После лечения и с прогрессированием беременности ЦУРС повышалась в 1,8 раза, приближаясь к верхней границе нормы III триместра беременности, а функциональная проба (ИН=105,8±20,4 у.е.) и период восстановления (ИН=371,5±28,7 у.е.) свидетельствовали об относительном уравновешивании адаптивных механизмов, сниженных до лечения.

При симпатикотонии напряжение регуляторных систем у беременных в 27 недель было выше нормы этого срока в 1,9 раза. Через месяц, после курса терапии ЦУРС находилась на уровне нормы III триместра беременности. Функциональная проба выявила повышение компенсаторно-защитных механизмов, ослабленных в результате ЖДА.
Гиперсимпатикотония у беременных с ЖДА характеризовалась значительным усилением ЦУРС (в 7 раз выше нормы). При функциональной пробе происходила кратковременная децентрализация управления ритмом сердца направленная на снижение высокой активности симпатического звена регуляции (ИН=322,4±40,5 у.е.) с быстрым введением функциональных резервов в последействии (ИН=1227,8±65,8 у.е.), что указывало на значительное напряжение регуляторных механизмов. После проведенного лечения (О3+Fe) к 30-й неделе беременности функционирование ВНС пациенток в состоянии покоя и в период восстановления (ИН=279,2±23,8 у.е.) приближалось к показателям нормы.
Оценка вегетативной регуляции организма женщин 3-й группы показала, что прием только препарата железа (Fe) существенно не изменял значения КИГ-анализа беременных с нормотонией (табл. 3). При симпатикотонии не отмечено отрицательного действия препарата на вегетативную регуляцию, однако по сравнению с нормой III триместра симпатикотония у обследованных женщин была менее выражена. Гиперсимпатикотония характеризовалась значительным (в 7–8 раз) усилением активности симпатического звена регуляции до и после лечения в состоянии покоя, по сравнению с нормой для беременных, развитием неспецифических компенсаторных реакций, направленных на снижение повышенной активности симпатической нервной системы в ответ на вентиляционную пробу, с еще большим повышением напряжения регуляторных механизмов.
Таким образом, проведенные исследования показали, что в патогенезе ЖДА нарушение вегетативного гомеостаза, несбалансированность которого отражается на адаптационных реакциях организма, играет значительную роль. У женщин с ЖДА в процессе беременности наблюдаются серьезные изменения напряжения регуляторных систем, слабость адаптивных процессов и недостаточность функциональных резервов. Эффективность терапии беременных с ЖДА озоном или озоном с железосодержащим препаратом зависела от исходного вегетативного тонуса больных (ваготония), но в большинстве случаев способствовала нормализации нарушенных регуляторных механизмов, оптимизации взаимодействия и баланса эрготропного и трофотропного звеньев ВНС, оказывая выраженное адаптогенное действие на организм. Это согласуется с полученными нами ранее данными о существенном улучшении состояния общей реактивности организма женщин вне беременности после реконструктивно-пластических операций под влиянием озонотерапии [17]. При лечении пациенток с ЖДА только железосодержащим препаратом нормотония и симпатикотония, имеющие место до лечения, сохранялись на том же уровне, а при гиперсимпатикотонии наблюдалось еще большее повышение напряжения регуляторных механизмов. После курсов терапии у женщин первых двух групп уровень Hb повысился на 17–18%, а в 3-й группе – только на 12%.
Заключение
Полученные положительные результаты применения озона у беременных с ЖДА при нарушении вегетативного гомеостаза обосновывают целесообразность его включения в комплексную терапию и дальнейшее динамическое исследование состояния ВНС больных, с целью более глубокого понимания патогенеза ЖДА и своевременной адекватной коррекции.



