Как известно, более 80 млн супружеских пар по всему миру страдают бесплодием и прибегают к лечению методом экстракорпорального оплодотворения (ЭКО), важным этапом которого является стимуляция суперовуляции. Овариальный ответ широко варьирует у различных пациенток [1].
Возможность более точно прогнозировать особенности ответа яичников на стимуляцию суперовуляции представляет значительный интерес, как клинический, так и научный.
Существуют различные предикторы исходов стимуляции функции яичников: возраст, овариальный резерв, гормональный статус, неблагоприятные экзогенные факторы и другие [2]. Однако эти маркеры не обладают достаточной прогностической способностью [3, 4], в связи с чем поиск оптимальных прогностических факторов не прекращается и в настоящее время. Особое внимание уделяется генетической изменчивости. Показана ассоциация овариального ответа с полиморфизмами более 10 генов, однако до сих пор генотипирование не включено в систему прогнозирования индивидуального характера овариального ответа. Разработка критериев прогнозирования овариального ответа в программах вспомогательных репродуктивных технологий (ВРТ) путем определения индивидуализированных генетических маркеров является современной актуальной и перспективной проблемой.
Целью данного исследования стал поиск генетических маркеров, позволяющих прогнозировать ответ яичников на стимуляцию суперовуляции, характер оогенеза, эмбриогенеза в программах ВРТ.
Материал и методы исследования
 Проведено проспективное исследование случай-контроль на базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Исследовались 10 полиморфных локусов генов, кодирующих: антимюллеровый гормон AMH 146 G>T (Ile49Ser) [rs 10407022]; его рецептор AMHR2 (-482 A>G) [rs 2002555]; эстрогеновый рецептор ESR1 –397 T>C [PvuII] [rs2234693]; ESR1–351 A>G [XBaI] [rs 9340799]; ESR2 G>A [RsaI] [rs 4986938]; рецептор ФСГ FSHR2039 G>A (Ser680Asn) [rs 6166]; рецептор ЛГ/ХГ LHCGR 935 A>G (Asn312Ser) [rs 2293275]; LHCGR 872 A>G (Asn291Ser) [rs 12470652]; сосудисто-эндотелиальный фактор роста VEGFA-634 G>C [rs 2010963]; ингибитор активатора плазминогена SERPINE1 (PAI-1) -675(5G>4G) [rs 1799889]. Генотипирование производилось методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб». ДНК для генотипирования выделяли из образцов периферической крови, взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Проведено проспективное исследование случай-контроль на базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Исследовались 10 полиморфных локусов генов, кодирующих: антимюллеровый гормон AMH 146 G>T (Ile49Ser) [rs 10407022]; его рецептор AMHR2 (-482 A>G) [rs 2002555]; эстрогеновый рецептор ESR1 –397 T>C [PvuII] [rs2234693]; ESR1–351 A>G [XBaI] [rs 9340799]; ESR2 G>A [RsaI] [rs 4986938]; рецептор ФСГ FSHR2039 G>A (Ser680Asn) [rs 6166]; рецептор ЛГ/ХГ LHCGR 935 A>G (Asn312Ser) [rs 2293275]; LHCGR 872 A>G (Asn291Ser) [rs 12470652]; сосудисто-эндотелиальный фактор роста VEGFA-634 G>C [rs 2010963]; ингибитор активатора плазминогена SERPINE1 (PAI-1) -675(5G>4G) [rs 1799889]. Генотипирование производилось методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб». ДНК для генотипирования выделяли из образцов периферической крови, взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
В исследование включены 160 пациенток, соответствовавших критериям включения (возраст 18–36 лет, женское бесплодие трубного происхождения, мужской фактор бесплодия при отсутствии тяжелой патозооспермии, регулярный менструальный цикл) и исключения (эндокринный фактор бесплодия, перенесенные оперативные вмешательства на яичниках, эндометриоз, генетические аномалии, пороки развития половых органов и др.), разделенные на 3 группы в зависимости от типа овариального ответа на стимуляцию суперовуляции: 40 пациенток с «бедным» овариальным ответом (3 и менее фолликулов, согласно ESHRE, 2011) [5], 40 пациенток с «гипер» ответом яичников (более 10 фолликулов, согласно ASRM, 2008) [6; 7], 80 пациенток с нормальным овариальным ответом (4–10 фолликулов).
Стимуляция функции яичников проводилась со 2–3-го дня менструального цикла с использованием препаратов рекомбинантного ФСГ 150 МЕ и препаратов антагониста гонадотропин-рилизинг гормона 0,25 мг.
Эмбрионы классифицировались по морфологическим критериям в соответствии с классификацией, принятой Istanbul consensus workshop on embryo assessment (ESHRE, 2011) («модифицированная» классификация D. Gardner) [8].
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ. Статистическая обработка данных выполнена с помощью пакета прикладных программ SPSS Statistics 17.0. В качестве меры центральной тенденции количественных признаков была выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Результаты представлены в виде Me (L-H). Для оценки значимости межгрупповых различий нескольких независимых выборок использовали тест Крускала–Уоллиса. В случае двух выборок применялся U-критерий Манна–Уитни для несвязанных совокупностей. Оценку соответствия выявленных частот генотипов закону Харди–Вайнберга проводили по критерию χ2 в сравнении с ожидаемыми частотами генотипов равновесного распределения. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию χ2. Статистически значимыми считались различия при р<0,05. Отношение шансов (ОШ) приведено с 95% доверительным интервалом (ДИ).
Результаты исследования
По анамнестическим данным, росто-весовым показателям, типу и этиологии бесплодия группы пациенток были сравнимы между собой. В группе с «гипер» ответом отмечалось увеличение числа пациенток в возрасте моложе 30 лет, тенденция к удлинению менструального цикла и увеличению продолжительности менструации. Уровень ФСГ в крови был ниже, а АМГ выше по сравнению с пациентками с нормальным и «бедным» овариальным ответом. При проведении дальнейшего анализа данные факторы учтены как конфаундеры.
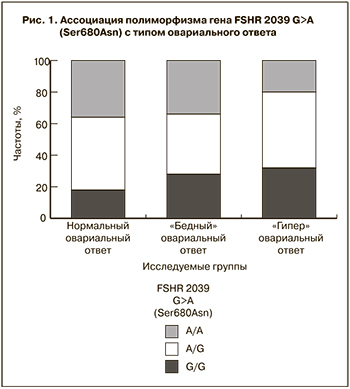
В ходе проведенного анализа ассоциации полиморфизма генов с типом овариального ответа установлено, что наличие генотипа G/G полиморфизма гена FSHR 2039 G>A (Ser680Asn) предрасполагает к «гипер» ответу (c2 с поправкой Бонферрони, р=0,021, ОШ=3,49 (95% ДИ=1,3-11,6)) (рис. 1).
При этом статистически значимой ассоциации полиморфизма гена FSHR 2039 G>A (Ser680Asn) с базальным уровнем ФСГ и АМГ выявлено не было (тест Крускала–Уоллиса, р>0,05). Предположительно связь данного полиморфизма с типом овариального ответа объясняется разным уровнем экспрессии рецептора ФСГ на клетках гранулезы и, как следствие, различной чувствительностью к препаратам ФСГ. Аналогичное предположение высказано в работе Desai и соавт. (2013) [9].
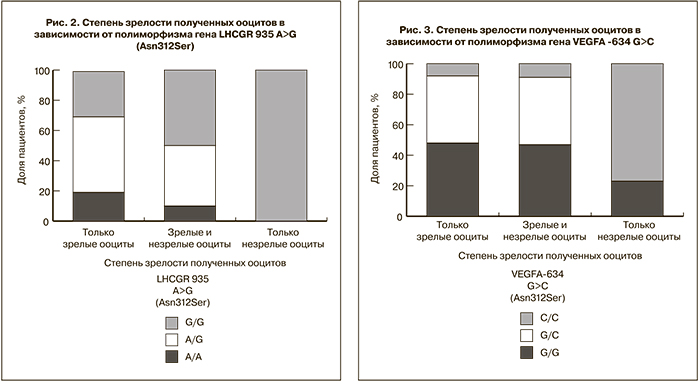
Кроме того, был проведен поиск ассоциации генотипа пациенток с качеством полученных ооцитов. При анализе распределения частоты генотипов исследуемых генов в зависимости от качества ооцитов выявлена статистически значимая ассоциация полиморфизма гена LHCGR 935 A>G (Asn312Ser) со степенью зрелости ооцитов. Так, генотип G/G более чем в 3 раза повышает риск отсутствия зрелых ооцитов (двухсторонний точный тест Фишера, р=0,039, ОШ=3,41(95% ДИ=1,05-11,1)) (рис. 2).
Аналогичная ассоциация выявлена и с генотипом С/С гена VEGFA -634 G>C, у носительниц которого также зафиксирован высокий риск получения только незрелых ооцитов (двухсторонний точный тест Фишера, р=0,040, ОШ= 4,09 ( 95% ДИ=1,3-11,71)) (рис. 3).
При сочетании двух неблагоприятных генотипов вероятность получения зрелых ооцитов составила 62,5%, тогда как для остальных сочетаний генотипов данная вероятность составила 93,4% (двухсторонний точный тест Фишера, р=0,019, ОШ=0,12 (95% ДИ=0,03–0,52)).
Также выявлена ассоциация полиморфизма гена AMHR2 -482 A>G с качеством полученных ооцитов. Носительство генотипа А/А данного полиморфизма более чем в 2 раза повышает риск получения незрелых ооцитов (двухсторонний точный тест Фишера, р=0,025, ОШ=2,23 (95% ДИ=1,1-4,3)).
Далее провели анализ ассоциации генотипа пациенток с качеством эмбрионов. Согласно аутосомно-доминантной модели носительство аллеля G полиморфизма гена ESR1 –351 A>G [XBaI] более чем в 2 раза повышает риск получения эмбрионов класса С (низкого качества) (двухсторонний точный тест Фишера, р=0,022, ОШ=2,3 (95% ДИ=1,1-4,6)).
Ассоциации с частотой наступления беременности в программах ВРТ в ходе нашего исследования выявлено не было.
Обсуждение
Основной задачей стимуляции функции яичников в программах экстракорпорального оплодотворения является получение достаточного числа зрелых ооцитов с целью выбора большего числа высококачественных эмбрионов для переноса в полость матки. Генетическая вариабельность представляется важным предиктором исходов стимуляции суперовуляции и программ ВРТ.
Полученные данные относительно способности генотипа G/G полиморфизма гена FSHR 2039 G>A (Ser680Asn) к предикции «гипер» ответа яичников на стимуляцию суперовуляции сопоставимы с данными исследования, проведенного Boudjena и соавт. в 2012 г., в которое были включены 427 пациентки, и было показано, что женщины, гомозиготные по аллелю G гена FSHR 2039 G>A (Ser680Asn), имели большее число фолликулов и ооцитов, чем гомозиготы по аллелю A (р=0,0009) [10].
Проведенные исследования полиморфизма гена FSHR 2039 G>A (Ser680Asn) демонстрируют результаты, которые могут быть применены в клинической практике, в частности, для персонализации подбора протоколов стимуляции суперовуляции («мягкий» протокол, профилактика синдрома гиперстимуляции яичников и другие). Подтверждением данного вывода служат и мета-анализы Moron и Ruiz (2010), Altmae и соавт. (2011) и La-Marca и соавт. (2013), в которых также предполагается, что полиморфизм гена рецептора ФСГ можно расценивать как потенциальный предиктор овариального ответа [11–13].
Таким образом, полиморфизм гена FSHR представляется важным фактором, позволяющим прогнозировать исход стимуляции функции яичников, и способным дополнить арсенал имеющихся маркеров.
Носительство генотипа G/G полиморфизма гена LHCGR 935 A>G (Asn312Ser), генотипа С/С полиморфизма гена VEGFA -634 G>C, генотипа А/А полиморфизма гена AMHR2 -482 A>G статистически значимо повышает риск получения только незрелых ооцитов. Таким образом, полученные данные могут свидетельствовать о наличии независимых генетических факторов, прогнозирующих степень зрелости ооцитов и качество эмбрионов. Результаты настоящего исследования согласуются с данными, полученными в работе Ayvaz и соавт. (2009) [14].
Ассоциации полиморфизмов генов с частотой наступления беременности в программах ВРТ в проведенном исследовании выявлено не было. Можно предположить, что генетические маркеры определяют качество гамет, но не имплантационную способность эмбрионов и эндометрия. Аналогичные результаты представлены и в опубликованном мета-анализе [15]. Выявленная ассоциация генетических предикторов с эффективностью программы ВРТ опосредуется через детерминацию овариального ответа, качества ооцитов и эмбрионов.
Заключение
Полиморфизм генов FSHR 2039G>A (Ser680Asn), LHCGR 935A>G (Asn312Ser), VEGFA -634G>C, AMHR2 -482 A>G, ESR1 -351A>G [XBaI] является независимым фактором, способным прогнозировать исход стимуляции суперовуляции, качество ооцитов и эмбрионов и может дополнить арсенал уже имеющихся маркеров.
В последнее время особую актуальность приобрело такое понятие, как персонифицированная медицина, являющаяся достаточно новой для отечественной практики, широко внедряющаяся в различные направления здравоохранения. Под этим подразумевают методы профилактики, диагностики и лечения, основанные на данных об индивидуальных особенностях пациентки, в том числе и генетической предрасположенности к тому или иному состоянию или функции организма. Генотипирование пациенток с целью предикции исходов стимуляции суперовуляции и программ ВРТ является перспективным и актуальным методом, позволяет индивидуализировать протоколы стимуляции суперовуляции, эмбриологический этап и повысить качество терапевтического воздействия с минимальным риском осложнений для пациентов.



