Проблема невынашивания беременности находится в центре внимания современной науки о репродукции человека. В настоящее время частота самопроизвольных прерываний беременностей составляет 20–25%, при этом до 80% потерь беременностей приходится на I триместр [1].
Многие исследователи полагают, что спорадические самопроизвольные выкидыши в I триместре являются инструментом естественного отбора, так как при кариотипировании абортусов не менее чем у 60% эмбрионов регистрируются хромосомные аномалии. В то же время, в случаях привычных выкидышей, когда у супружеской пары прерывается две и более беременностей, хромосомные потери не столь часты, а потери обусловлены иными причинами.
Этиологические факторы, приводящие к привычным выкидышам, чрезвычайно разнообразны и помимо генетических причин включают эндокринные, анатомические, инфекционные, аллоиммунные, аутоиммунные, тромбофилические нарушения [2–4].
В большинстве случаев в основе привычного выкидыша лежит сочетание нескольких причинных факторов, поэтому при обследовании и подборе терапии нужно учитывать все этиологические компоненты, приводящие к прерыванию беременности.
В настоящее время получены убедительные данные, свидетельствующие, что у женщин с повторными ранними прерываниями беременностей достоверно чаще встречаются такие поздние гестационные осложнения, как плацентарная недостаточность, задержка роста плода, кровотечения во втором и третьем триместрах, преждевременные роды [5–8]. Одной из патогенетических причин вышеперечисленных осложнений является нарушение инвазии трофобласта на ранних сроках гестации у женщин с привычным выкидышем [9, 10].
Одной из причин нарушения инвазии трофобласта и последующей ограниченной децидуализации является воспаление инфекционного и асептического характера. В то время как воспаление инфекционного генеза и его последствия для дальнейшего протекания беременности достаточно хорошо изучены, патогенез асептического воспаления остается неясным и представляет собой нерешенную проблему [11]. В публикациях последних лет в качестве возможных индукторов асептического воспаления все чаще обсуждается роль факторов митохондриального происхождения, называемых mitochondrial Damage Associated Patterns (mtDAMP). Среди изученных факторов описаны такие молекулы, как митохондриальная ДНК (мтДНК), фактор инициации трансляции мтДНК белок TFAM, аденозинтрифосфат (АТФ), кислые липиды митохондриальных мембран, а также пептидные фрагменты митохондриальных белков, содержащие на N-конце остаток формилметионина, сходные по своей иммуностимулирующей активности с бактериальными белками. Роль данных факторов изучалась и была показана при таких патологических состояниях, как преэклампсия и преждевременные роды, однако прогностическая ценность mtDAMP для осложненной беременности на ранних сроках остается неясной.
Целью данного исследования является определение уровней провоспалительных факторов митохондриального происхождения (mtDAMP) в периферической крови пациенток с угрожающим и привычным выкидышем в сравнении с аналогичными показателями женщин с физиологическим течением беременности.
Материал и методы исследования
В пилотное исследование были включены 24 беременные женщины. Основную группу составили женщины с угрожающим и привычным выкидышем, контрольную – беременные с неотягощенным акушерским и гинекологическим анамнезом. Ретроспективно были отобраны образцы плазмы периферической крови 12 женщин основной группы, чья беременность завершилась самопроизвольным ранним выкидышем, и 12 женщин с физиологическим течением первой половины беременности по достижении срока 22 недель.
 Пациентки основной и контрольной группы были включены в исследование при сроке беременности 6–7 недель от первого дня последней менструации и подтверждении сердцебиения по данным ультразвукового исследования. Критерии включения в основную группу: возраст женщин от 20 до 40 лет; явления угрожающего выкидыша на момент включения в исследование (кровяные выделения из половых путей); два самопроизвольных прерывания беременности и более от одного и того же партнера; самопроизвольное наступление беременностей (отсутствие бесплодия); отсутствие выраженных гормональных нарушений, регулярный менструальный цикл; отсутствие анатомических причин привычного выкидыша, подписанная пациенткой форма информированного согласия на проведение исследования.
Пациентки основной и контрольной группы были включены в исследование при сроке беременности 6–7 недель от первого дня последней менструации и подтверждении сердцебиения по данным ультразвукового исследования. Критерии включения в основную группу: возраст женщин от 20 до 40 лет; явления угрожающего выкидыша на момент включения в исследование (кровяные выделения из половых путей); два самопроизвольных прерывания беременности и более от одного и того же партнера; самопроизвольное наступление беременностей (отсутствие бесплодия); отсутствие выраженных гормональных нарушений, регулярный менструальный цикл; отсутствие анатомических причин привычного выкидыша, подписанная пациенткой форма информированного согласия на проведение исследования.
Контрольную группу составили женщины с физиологическим течением беременности на момент обследования, неотягощенным акушерским анамнезом, подписавшие информированное согласие на проведение исследования.
Критериями исключения в обеих группах были: многоплодная беременность, наличие онкологических, системных аутоиммунных заболеваний, тяжелые экстрагенитальные заболевания.
Для определения уровня mtDAMP белкового происхождения у пациенток исследуемых групп проводили фракционирование венозной крови, выделение микровезикул из полученной плазмы и методом Вестерн-блот анализировали содержание митохондриальных белков. Забор крови проводился натощак из локтевой вены у беременных по стандартной методике в пробирку с ЭДТА. Плазму крови получали методом осаждения форменных элементов крови в течение 10 минут при 3000g, 4°С на центрифуге Eppendorf 5410R (США). Далее проводили выделение из плазмы крови микровезикул методом скоростного ультрацентрифугирования на ультрацентрифуге Beckman Airfuge (США) в течение 2 часов при 190000 g. Анализ осадка микровезикул проводился методом электрофореза в денатурирующих условиях по методу Лэммли в системе Biorad MiniProtean (США) и последующего Вестерн-блот анализа при помощи высокоспецифичных мышиных моноклональных антител (Abcam, США) против следующих митохондриальных белков человека: порина (VDAC1 из внешней мембраны митохондрии), фактора инициации трансляции мтДНК (TFAM, из митохондриального матрика) – субьединицы 1 митохондриальной цитохром с оксидазы (MTCO1 из внутренней мембраны митохондрии), перенесенных на мембрану PVDF (США) методом электротрансфера при 90В, 0,3А, 60 минут в буфере следующего состава 10 мМ CAPS-NaOH, pH 11,0, 20% этанол, 0,1% додецилсульфат натрия. Мембраны с перенесенными белками блокировали 2 часа при комнатной температуре или в течение ночи при 4°С и постоянном покачивании в буфере 50мМ Трис HCl, рН 7,5, 150мМ NaCl, 5% обезжиренное сухое молоко, 0,1% твин-20. Первичные антитела разводили в том же буфере в соотношении 1:1000, в соответствии с рекомендациями производителя. Инкубировали с первичными антителами 2 часа при комнатной температуре и после тройной отмывки по 5 минут в том же буфере без сухого молока, переносили в раствор с вторичными антителами, разведенными 1:20 000. Для проявления первичных антител использовали вторичные антимышиные антитела, конъюгированные с пероксидазой хрена и биолюминесцентную систему визуализации. Количественное определение идентифицированных компонентов DAMP в полосе соответствующего молекулярного веса на поливинилендифторидной мембране проводили при помощи системы Geldoc (США) с нормировкой на общий белок, нанесенный на дорожку. Статистическую обработку полученных данных проводили при помощи программы SPSS по методу ANOVA.
Результаты исследования
В группах женщин с привычным и угрожающим выкидышем и в контрольной группе определяли уровень провоспалительных факторов митохондриального происхождения в плазме периферической крови.
Диагноз «угрожающий выкидыш» ставили только в случае наличия кровяных выделений из половых путей, что свидетельствовало о начавшейся отслойке хориона и формирующейся плаценты. Проводимая терапия включала гестагенную поддержку (дидрогестерон 40 мг в сутки), спазмолитические и гемостатические (при кровотечении) лекарственные препараты.
Проведено динамическое наблюдение за течением и исходами беременностей. Из всех женщин с угрожающим и привычным выкидышем ретроспективно отобраны 12 пациенток с прервавшейся беременностью. Полученные результаты были сопоставлены с данными измерения содержания митохондриальных белков во фракции микровезикул плазмы периферической крови 12 женщин с физиологическим течением беременности.
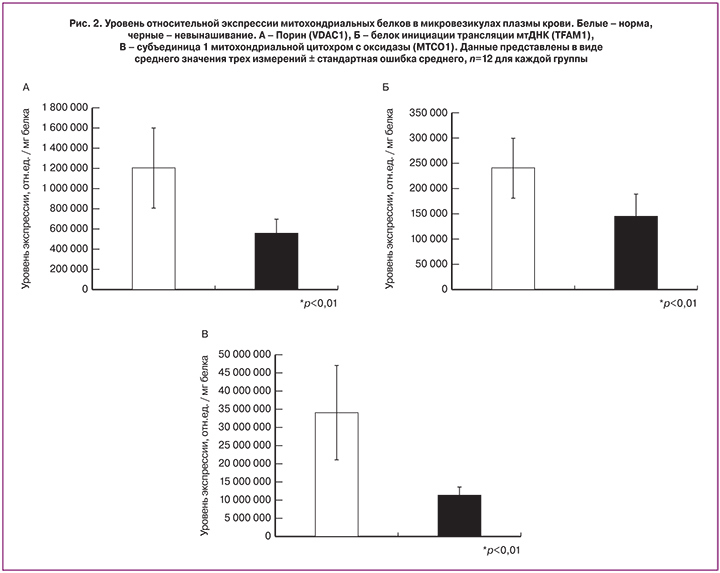
На рис. 1 представлена типичная картина распределения интенсивности свечения полосы белка VDAC1 на мембране после переноса образцов выделенных микровезикул плазмы крови основной и контрольной групп. Данные количественного обсчета содержания исследуемых митохондриальных белков представлены на диаграммах рис. 2.
Сравнительный анализ относительного содержания митохондриальных белков в микровезикулах плазмы крови показал, что для женщин с угрожающим и привычным выкидышем содержание всех трех маркерных белков значительно и достоверно ниже, чем у женщин контрольной группы (р<0,01).
Обсуждение
Значимость воспалительного компонента в развитии иммунотолерантности к антигенам полуаллогенного плода на ранних сроках физиологической беременности к настоящему моменту общепризнана и детально исследована [12, 13]. При определенных условиях избыточный характер воспалительных реакций может оказывать негативное воздействие на течение беременности и приводить к угрожающему выкидышу и ранним потерям. При этом недавно in vivo и в экспериментах in vitro было показано, что микровезикулы, производимые синцитиотрофобластом при преэклампсии, способны модулировать иммунный ответ, оказывать супрессирующее действие в отношении эндотелия сосудов эндометрия, а также локально активировать тромбоциты в зоне инвазии [14]. С другой стороны, как уже упоминалось выше, отсутствие реакции воспаления на ранних этапах беременности приводит к ее завершению и последующей толерантности в отношении данного полового партнера [15].
Предполагаемый механизм подобной воспалительной реакции, приводящей к формированию иммунотолерантности в отношении полуаллогенного эмбриона и дальнейшим успешным имплантации и беременности, состоит в локальной активации инфламмасом в трофобласте через АТФ/АДФ зависимые пуринэргические рецепторы тромбоцитов [16]. Необходимым фактором успешности подобной активации, вероятно, является экспозиция тромбоцитов к адениновым нуклеотидам и митохондриальным белкам, массово попадающим в сосуды эндометрия при инвазии трофобласта и разрушении митохондрий материнских клеток. В рамках пилотного исследования мы показали, что нормальное течение беременности имеет место только в случае достаточно высоких величин содержания митохондриальных белков в периферической крови. В то же время при невынашивании мы регистрировали существенно меньшее и, видимо, недостаточное для активации инфламмасом трофобласта количество митохондриальных белков вследствие неполноценной инвазии трофобласта и низкого уровня клеточной гибели.
Вероятно, жизнеспособное плодное яйцо способно индуцировать в эндометрии сбалансированный провоспалительный ответ, тогда как при угрожающем и привычном выкидыше имеет место нарушение данного взаимодействия, результирующееся в гибель плодного яйца. Полученные нами результаты согласуются с доминирующей в последнее время концепцией о необходимости провоспалительного состояния иммунной системы для успешности процессов имплантации и плацентации в начале беременности и формирования противовоспалительного фона на более поздних ее сроках.
Остаются открытыми вопросы о точном происхождении митохондриальных белковых компонентов микровезикул и их антигенной активности, а также об уровне и титре антимитохондриальных антител на ранних этапах нормальной и осложненной беременности. Исследования в данном направлении будут продолжены.
Необходимы дальнейшие исследования для разработки системы прогнозирования развития беременности на ранних сроках и оценки эффективности проводимого лечения.



