Одной из актуальных проблем современной гинекологической практики является терапия нарушений анатомической целостности и функциональной активности маточных труб [1–4]. Одной из причин, снижающих эффективность лечения, является патология матки и придатков [1–3]. Миома матки, по данным литературы, в 46% случаев ассоциируется с женским бесплодием [4]. Влияние миомы матки с субмукозной и/или интрамуральной локализацией узла на состояние маточной трубы представляет интерес в связи с проведением органосохраняющих операций, репродуктивных технологий и восстановительного лечения.
Цель настоящего исследования – выявление закономерностей макромикроскопических изменений в стенке маточной трубы при миоме матки с субмукозной и/или интрамуральной локализацией узла.
Материал и методы исследования
Ретроспективное, сравнительное исследование проведено на архивных гистологических препаратах 100 маточных труб 50 женщин репродуктивного возраста от 25 до 40 лет. Из них у 25 женщин была диагностирована миома матки и проведено удаление матки и придатков матки, а препараты 50 маточных труб 25 женщин без генитальной патологии, полученных при проведении стерилизации маточных труб с иссечением участка маточной трубы, служили контролем. Для изучения микротопографии и макромикроскопической анатомии маточной трубы использовали серийные гистотопограммы, окрашенные гематоксилин-эозином и по Ван Гизону. Гистотопографическому исследованию подвергали следующие отделы маточной трубы: середину ампулы, участок между ампулой и перешейком маточной трубы, середину перешейка маточной трубы, зону маточно-трубного соединения и маточную часть маточной трубы. Проводили количественную оценку просвета, стенки, различных отделов маточных труб, ее оболочек и слоев, подсчет количества, измерение диаметра и распределение в пределах стенки маточной трубы артериальных и венозных сосудов. Вычисления дистанций, периметров и площадей проводили с использованием компьютеризированной морфометрической системы Magicscan.
Результаты исследования и обсуждение
Морфометричекое исследование позволило выявить изменения толщины стенки маточной трубы, ее оболочек и слоев, а также кровеносных сосудов при миоме матки (рис. 1, 2, 3).
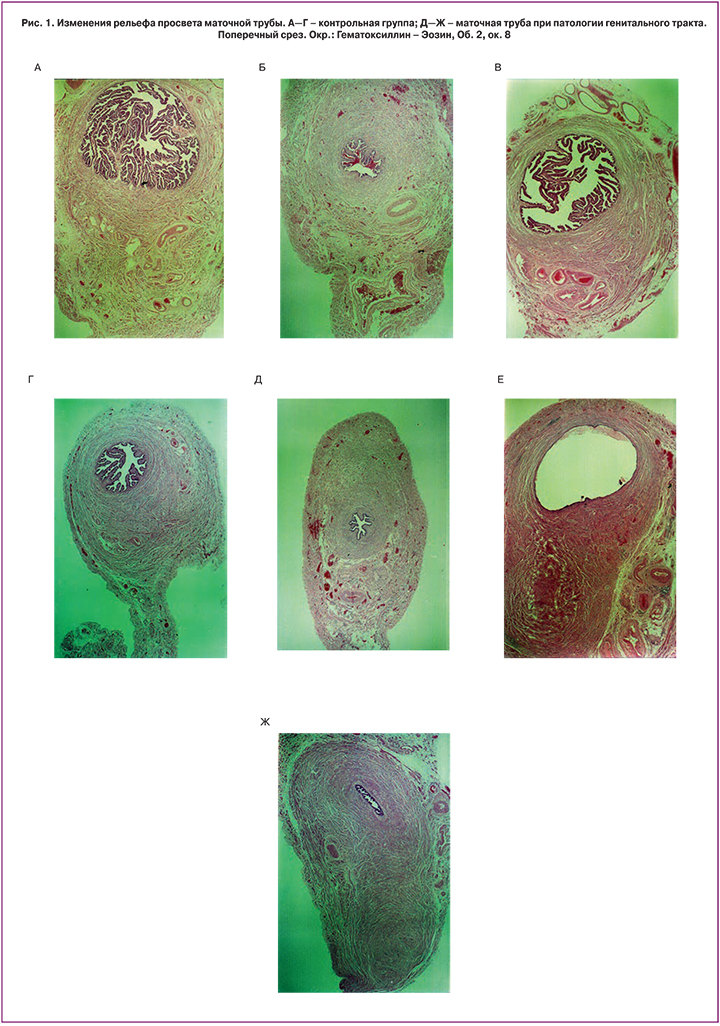
При миоме матки отмечается некоторое увеличение толщины стенки маточной трубы. Так, толщина передней, верхней и задней стенок трубы в области перешейка при миоме матки составляет 1,74±0,25 мм, 2,3±0,3 мм и 2,03±0,28 мм, тогда как в норме толщина стенок трубы, соответственно, равна 1,69±0,13 мм, 2,03±0,13 мм и 1,89±0,14 мм. Такое увеличение толщины происходит за счет роста толщины мышечной оболочки маточной трубы, в основном продольного мышечного слоя. Этот процесс наиболее выражен на протяжении перешейка маточной трубы. В свою очередь, отмечается тенденция к уменьшению толщины слизистой оболочки на протяжении перешейка и ампулы маточной трубы. Для миомы матки характерно уменьшение количества складок слизистой оболочки во всех отделах маточной трубы по сравнению с таковым в контрольной группе (28±4; 8,2±1,1; 4,6±0,6 – в ампуле, перешейке, маточной части при миоме; 34±5; 11,6±1,6; 6,5±0,9 – в контрольной группе). Рельеф слизистой оболочки – наиболее сложный в ампуле маточной трубы, где в просвет выдаются первичные, вторичные и третичные ворсины. При миоме матки отмечается уменьшение или полное отсутствие третичных ворсин, уменьшение количества вторичных ворсин в ампулярном отделе маточной трубы. Характерно увеличение толщины самой ворсины с уменьшением ее ветвистости. Площадь поперечного сечения просвета при миоме матки увеличивается в ампуле (2,6±0,4 мм²) и уменьшается в области перешейка (0,150±0,020 мм²) маточной трубы. Просвет приобретает овальную форму в ампулярном отделе и щелевидную – в области перешейка маточной трубы. В контрольной группе площадь поперечного сечения просвета уменьшается от ампулы к перешейку, составляя соответственно 2,5±0,3 мм² и 0,18±0,03 мм². Размеры просвета в области перешейка и маточной части примерно равны. Если в ампуле просвет имеет овальную форму, то в перешейке и маточной части он приобретает округлую форму.

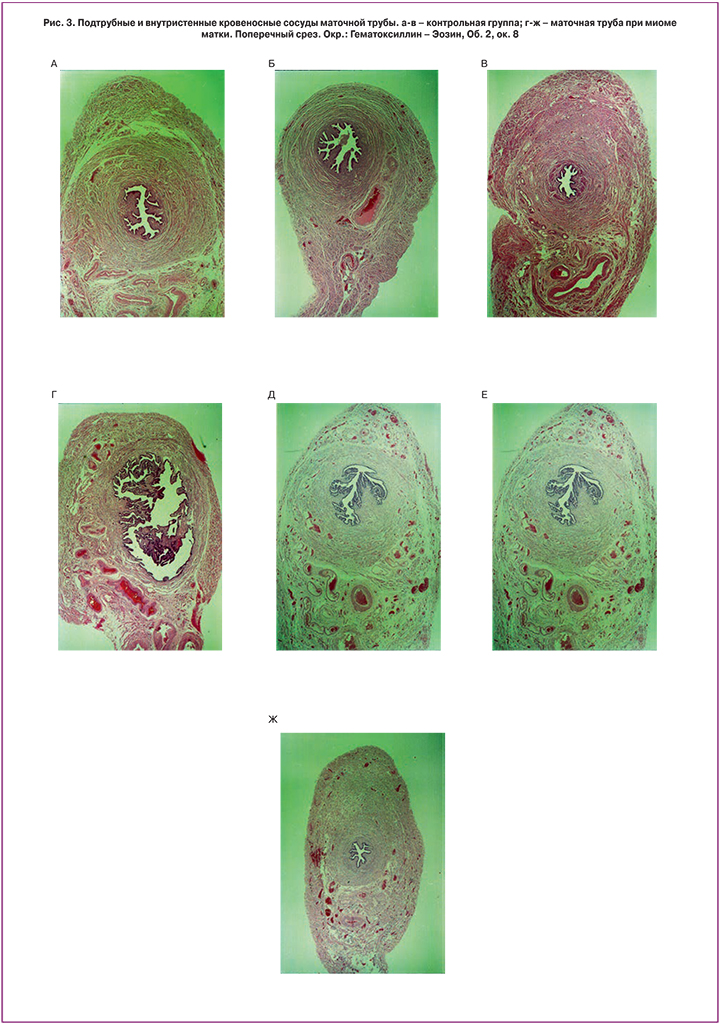
При миоме матки определяется рассыпной тип васкуляризации без каких-либо закономерностей распределения сосудов в пределах стенки маточной трубы. Отмечается перераспределение характера артериального кровоснабжения стенки маточной трубы, от подтрубного сосудистого пучка с концентрацией мелких артерий и капилляров преимущественно по передней и задней стенкам маточной трубы в контрольной группе, к рассыпному принципу представительства мелких артериальных сосудов и капилляров по передней, задней и верхней стенкам маточной трубы, наряду с уменьшением выраженности подтрубного сосудистого пучка и его размеров в группе с миомой матки. Отмечаются явления неоангиогенеза и образования сети коллатерального кровоснабжения в стенке маточной трубы. Наряду с этим отмечается вазодилатация сосудов венозного русла, свидетельствующая о венозном застое в стенке маточной трубы (рис. 3). В этой группе наиболее часто встречаются сосуды диаметром 0,3–0,79 мм. Относительно часто встречаются крупные сосуды в области задней и верхней стенок маточной трубы в дополнение к множественным кровеносным сосудам в области ее нижней стенки. Анализ диаметров кровеносных сосудов контрольной группы выявил, что в ампуле и перешейке маточной трубы чаще всего встречаются сосуды диаметром 0,1–0,39 мм. Наиболее крупные сосуды в этих отделах маточной трубы расположены в области ее нижней стенки.
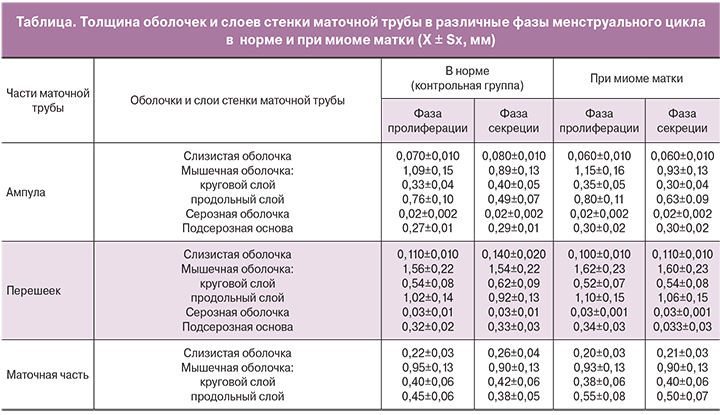
Морфометрические характеристики просвета и стенки маточной трубы динамически изменяются в зависимости от фазы менструального цикла. В контрольной группе просвет ампулы – наибольший в фазу пролиферации (0,35±0,5 мм²) и уменьшается в фазу секреции (2,5±0,4 мм²). Просвет перешейка и маточной части – наибольший в фазу пролиферации (соответственно 0,230±0,020 мм² и 0,27±0,05мм²), он значительно уменьшается в фазу секреции (соответственно 0,13±0,4 мм² и 0,10±0,04 мм²). При миоме матки отмечается значимое увеличение просвета ампулы и перешейка маточной трубы в фазу пролиферации (3,5±0,8 мм²; 0,23±0,01 мм²), секреции (2,4±0,5 мм²; 1,64±0,23 мм²) и уменьшение просвета маточной части в фазу пролиферации и секреции (0,080±0,010 мм²; 0,050±0,010 мм²). Толщина слизистой оболочки – наименьшая в фазу пролиферации и постепенно возрастает во всех отделах в фазу секреции, что отмечено в контрольной группе.
Для миомы матки характерны незначительные динамические изменения толщины стенки маточной трубы в зависимости от фазы менструального цикла при общем нарастании толщины стенки, по сравнению с таковой в контрольной группе (таблица). В контрольной группе мышечная оболочка в области ампулы уменьшается по толщине в фазу секреции по сравнению с фазой пролиферации. В области перешейка и маточной части отмечается уменьшение толщины мышечной оболочки в фазу секреции по сравнению с фазой пролиферации (таблица). При миоме матки круговой мышечный слой стенки маточной трубы имеет морфометрические характеристики, присущие таковым в пролиферативную фазу контрольной группы, без динамических изменений, определяемых в секреторную фазу менструального цикла. В контрольной группе для ампулы, перешейка и маточной части характерно нарастание толщины кругового мышечного слоя в фазу секреции. При миоме матки отмечается увеличение толщины продольного мышечного слоя и незначительные изменения в зависимости от фазы менструального цикла. В контрольной группе толщина продольного мышечного слоя ампулы, перешейка и маточной части уменьшается в фазу секреции (таблица).
Серозная оболочка, покрывающая переднюю, верхнюю и заднюю стенки ампулы и перешейка, имеет одинаковую толщину на протяжении маточной трубы. Толщина подсерозной основы незначительно увеличивается в области перешейка преимущественно за счет утолщения мышечного слоя, входящего в ее состав.
Заключение
Наше исследование позволяет провести сравнительный анализ морфологических изменений маточных труб у женщин репродуктивного возраста, имеющих не трубную генитальную патологию, в частности миому матки. Выводы, сделанные в результате исследования, наиболее важны для оценки состояния маточных труб у пациентов с идиопатической формой бесплодия. Практическое применение нашего исследования может быть выражено в рекомендациях к оперативному удалению или уменьшению размеров миоматозного узла путем ятрогенных интервенций (резектоскопическое удаление узла полости матки, лапароскопическая миомэктомия, эмболизация маточных артерий, ФУЗ-аблация) в комбинации с терапией маточных труб (местная лекарственнная и/или восстановительная физиотерапия) у пациентов с интрамуральной и/или субмукозной формами локализаций миомы матки. Эти рекомендации наиболее важны для пациентов, у которых не удается достигнуть наступления желанной беременности после хирургического вмешательства, либо вспомогательных репродуктивных технологий, не имеющих иных факторов, кроме миомы матки, объясняющих причину беслодия.
Участие маточной трубы в процессах оплодотворения и транспорта оплодотворенной яйцеклетки в полость матки позволяют рассматривать изменения, происходящие в микроархитектонике и васкуляризации стенки маточной трубы при миоме матки, в качестве морфологической основы, объясняющей увеличение частоты трубной беременности при проведении реконструктивно-пластических операций или при перемещении гамет или зиготы в просвет маточной трубы в программе экстракорпорального оплодотворения. Кроме того, данные изменения могут определять низкую эффективность наступления маточной беременности после реконструктивно-пластических операций на маточных трубах или экстракорпорального оплодотворения с последующим перемещением гамет или зиготы в просвет маточной трубы при наличии миомы матки.
Результаты проведенного морфологического исследования позволяют утверждать, что структурные изменения маточной трубы при миоме матки играют важную роль как морфологический субстрат для клинических данных, ассоциирующихся с достаточно низкой эффективностью вспомогательных репродуктивных технологий при сопутствующей миоме матки.
Наше исследование позволяет уточнить алгоритм постановки диагноза и тактики ведения больных с миомой матки в клинике лечения бесплодия.



