В настоящее время заболеваемость серозной карциномой яичника высокой степени злокачественности (СКЯВСЗ), наиболее распространенной среди карцином яичника (>70%), как в России, так и в Западных странах остается высокой, занимая 10-е и 8-е место среди злокачественных заболеваний у женщин, и 4-е и 1-е место среди причин смерти соответственно [1, 2]. Согласно последней классификацией ВОЗ (2014) было выделено два типа серозных карцином яичника – серозные карциномы низкой степени злокачественности (СКЯНСЗ) и СКЯВСЗ. Последние встречаются в большинстве случаев серозных карцином яичника, чаще диагностируются на поздних стадиях и ассоциируются с плохим прогнозом. Существующие методы клинической диагностики опухолей яичников – ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ), сывороточные маркеры – низко информативны, поскольку чувствительны при поздних стадиях, при значительной опухолевой нагрузке. Кроме того, их применение ограничено в аспекте дооперационной дифференциальной диагностики. Надежды, возлагаемые на онкомаркеры (СА-125, индекс ROMA, антиген НЕ 4), для ранней диагностики злокачественных опухолей яичников не оправдались [3–5]. Поэтому поиск новых подходов к решению этой проблемы является приоритетным в области онкологии и онкоморфологии.
В последние годы представления о патогенезе злокачественных эпителиальных опухолей яичника в целом и серозных карцином в частности претерпели существенные изменения; морфологические, иммуногистохимические (ИГХ) и генетические исследования убедительно показали, что наиболее вероятно развитие, по крайней мере, части СКЯВСЗ из серозных трубных интраэпителиальных карцином (СТИК), а СКЯНСЗ – из папиллярной гиперплазии маточной трубы (ПГМТ) [6–8].
Доказательством трубного происхождения СКЯВСЗ могут служить следующие факты: обнаружение аналогичных мутаций в гене ТР53 в области СТИК и СКЯВСЗ [9]; обнаружение СТИК преимущественно в дистальной части маточной трубы как у женщин-носительниц BRCA мутаций, так и у BRCA-негативных пациенток; укорочение теломер в области СТИК, что характерно для предраковых поражений [6, 10]. Если принять их во внимание, становится понятно, что для разработки эффективного скрининга и раннего обнаружения рака яичников необходима основа – легко воспроизводимый метод выявления микроскопических поражений эпителия маточной трубы. Одним из методов, позволяющим определить предраковое поражение маточной трубы, может стать цитологическое исследование эндометрия. Было опубликовано несколько исследований, в которых при помощи данного метода выявляли раннюю инвазивную и даже интраэпителиальную карциному маточной трубы [11–13]. В настоящее время скрининговые программы, включающие цитологическое исследование эндометрия, проводятся сравнительно недавно в ограниченном числе стран, поэтому рано говорить об использовании метода как механизма снижения смертности от рака яичников. Кроме того, лишь в ограниченном числе случаев клетки эпителия маточной трубы попадают в шеечный мазок, следовательно, доля выявляемых таким образом ранних раков маточной трубы/яичника очень мала.
В связи с вышеизложенным целью данного исследования стало изучение цитологических препаратов мазков фимбриального отдела маточной трубы для выявления сравнительных особенностей цитологической картины при серозных опухолях яичника, и возможностей использования метода для диагностики серозного рака яичников на ранних стадиях.

Материал и методы исследования
В исследование была включена 21 пациентка (средний возраст 45,6±13,7 года), у которой были взяты 36 мазков из 36 маточных труб. Критерии включения: возраст 35–80 лет, наличие клинически верифицированных опухолей яичников, условно «здоровые» пациентки, не имеющие патологии, оперативное лечение у которых проводилось с диагностической целью при эндокринном бесплодии. Критерии исключения: операции на маточных трубах, яичниках в анамнезе, верифицированные воспалительные заболевания матки и придатков на момент операции, беременность, злокачественные новообразования другой локализации, проведенная неоадьювантная химиотерапия. Диагноз опухолей яичников был установлен на основании стандартного клинического обследования. Распределение случаев по группам (I – серозные аденокарциномы, II – пограничные опухоли яичников, III – доброкачественные опухоли яичников, IV – условная норма) проводилось с учетом клинического диагноза, после получения результатов окончательного гистологического исследования. Материал для приготовления мазков был получен с помощью интраоперационного забора ткани (эпителия) фимбриального отдела маточных труб с помощью урогенитального зонда. Для этого в стерильных условиях при лапароскопии или лапаротомии рабочая часть урогенитального зонда с напылением из сложных эфиров целлюлозы помещалась в контейнер, расположенный в полой ручке зонда, вводилась в брюшную полость, где конструкция разбиралась, производился забор материала, рабочая часть вновь помещалась в контейнер и извлекалась из брюшной полости (см. рис. 1).
После забора материал сразу же помещался в контейнер с запатентованным концентрирующим раствором, являющимся буферной средой с низким содержанием спирта (метанола). Мазки готовили на аппарате фирмы BD. Метод приготовления заключается в следующем: контейнеры с образцами сначала перемешивали с помощью специального шейкера, что приводило к изоляции отдельных клеток. Далее часть пробы помещали в центрифужную пробирку для центрифугирования в градиенте плотности. В данном процессе клетки разделялись в зависимости от их веса. Гранулоциты, эритроциты и обломки клеток, которые имеют более низкий удельный вес, чем эпителиальные клетки, накапливались выше градиента плотности, а затем удалялись аспиратором. Между тем осевшие формы содержали популяцию клеток, пригодную для диагностики. Осадок переносили в камеру для осаждения, которая была установлена на предметном стекле. На предметном стекле клетки оседали в тонких слоях, а остаток жидкости удаляли. Окрашивание клеточного материала производили по методу Папаниколау.
Всего исследовано 6 мазков от пациенток с серозной карциномой яичника (в 2 случаях исследованы мазки из обеих маточных труб, в 2 – мазок из 1 маточной трубы), 7 мазков от пациенток с серозной пограничной опухолью (в 3 случаях исследованы мазки из обеих маточных труб, в 1 – мазок из 1 маточной трубы), 10 мазков – от пациенток с доброкачественными опухолями яичника (в 4 случаях исследованы мазки из обеих маточных труб, в 2 – мазок из 1 маточной трубы), 13 мазков – от пациенток без поражения яичников (в 6 случаях исследованы мазки из обеих маточных труб, в 1 – мазок из 1 маточной трубы). В ряде случаев проводилась сальпингоэктомия, поэтому 64% (n=23) маточных труб были изучены гистологически.
Все мазки имели достаточное количество клеток для оценки, среди них были выделены малоклеточные (<200 клеток), клеточные (>200–2000 клеток) и гиперклеточные (>2000 клеток). При выявлении атипических железистых клеток проводилось иммуноцитохимическое (ИЦХ) исследование с помощью антител к p16INK4a (клон E6H4, RTU) и Ki67 (клон 274-11AC3, RTU) в виде набора CINtec PLUS (Roche) и антител к р53 (клон DO-7, RTU, Dako). Оценка проводилась следующим образом: экспрессия р53 считалась положительной при умеренной и сильной ядерной коричневой окраске, экспрессия Ki-67 считалась положительной при красной ядерной окраске, экспрессия р16 считалась положительной при сильной ядерной и/или цитоплазматической коричневой окраске. Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 (Abramson J.H. WINPEPI (PEPI-for-Windows): computer programs for epidemiologists. Epidemiologic Perspectives & Innovations 2004, 1: 6), Statsoft Statistica 8.0.725, IBM SPSS Statistics 19.0 for Windows. После проведения теста на нормальность распределения данных для определения статистической значимости различий средних применялись U-тест Манна–Уитни для несвязанных совокупностей.
Результаты исследования
Средний возраст пациенток составил 45,6±13,7 года. Во всех случаях серозных карцином яичников – 4 (19%) диагноз был установлен при срочном гистологическом исследовании, из них предположение о возможной злокачественной природе процесса до операции было вынесено в 3 (14%) случаях. Все случаи пограничных опухолей яичников – 4 (19%) воспринимались при клинической интерпретации как доброкачественные. Все мазки имели достаточно клеток для оценки. Малоклеточные мазки были выявлены в 53% случаях, среднеклеточные – в 30%, гиперклеточные – в 17%. Среди мазков при экстраяичниковой патологии, доброкачественных и пограничных опухолях яичника чаще всего регистрировались малоклеточные мазки (в 70, 50 и 43% случаев соответственно), при СКЯВСЗ все типы мазков выявляли с одинаковой частотой (по 33%). Статистически значимых различий в типе мазка между группами исследования не выявлено (p>0,05) (табл. 1).
Фон мазков был чистым в 56%, с наличием аморфного бесструктурного вещества – в 36%, с наличием бесструктурного вещества и примесью эритроцитов – в 8%. В 19% мазков выявлялись плоские клетки и/или «чешуйки» (были привнесены во время манипуляции).
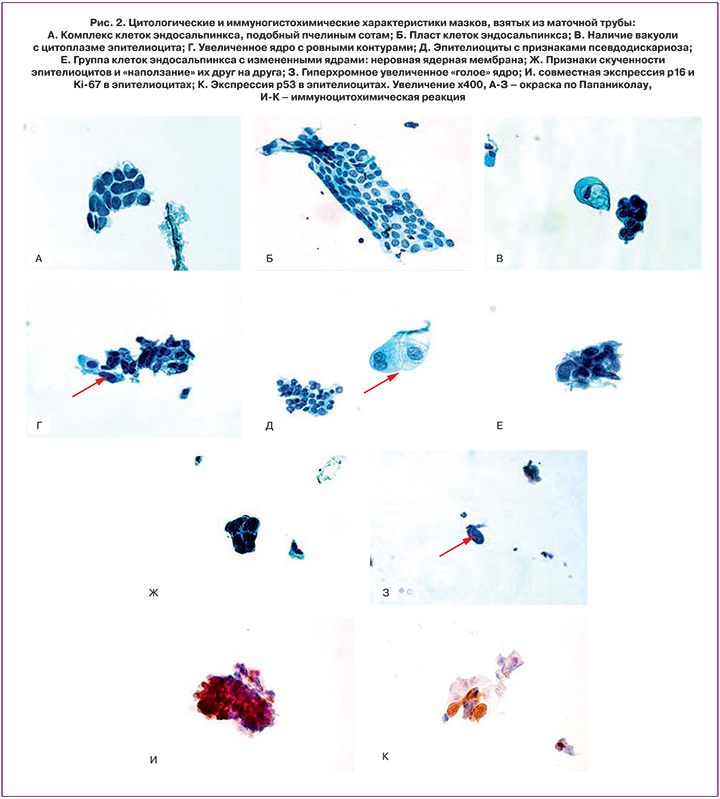
Были выявлены такие цитологические характеристики клеток, как организация клеток в структуры, подобные пчелиным сотам, и пласты клеток (рис. 2А и Б), вакуолизация цитоплазмы клеток (рис. 2В), увеличение размеров ядра при сохранении его нормальной структуры и гладких контурах (рис. 2Г), признаки псевдодискариоза клеток (рис. 2Д). Данные характеристики были отнесены к признакам реактивных изменений. Кроме того, в ряде случаев были отмечены неровные края клеток, их «уродливость» (рис. 2Е), скученность клеток и «наползание» их друг на друга (рис. 2Ж), наличие крупных гиперхромных «голых» ядер (рис. 2З). Данные характеристики были отнесены к истинной атипии, и мазки с такими признаками были исследованы ИЦХ методом. Общая характеристика клеток, выявленных в мазках, представлена на рис. 3. Анизонуклеоз преимущественно отсутствовал при неизменной ткани яичников (в 77%) и был выраженным (умеренным и сильным) – при пограничных опухолях и СКЯВСЗ (в 57 и 83% соответственно).
Ядерный полиморфизм преимущественно отсутствовал при неизмененной ткани яичников и был умеренным и сильным при СКЯВСЗ (в 100%). Не отмечалось неровностей ядерной мембраны при неизмененной ткани яичников (в 85%), в других группах исследования данный показатель был вариабельным. Хроматин был гипохромным преимущественно при неизмененной ткани яичников (в 77%), гиперхромным – в 40% при доброкачественных опухолях, в 50% – при СКЯВСЗ, в 14% – при пограничных опухолях, смешанным – в 57% пограничных опухолей и в 50% СКЯВСЗ. Единичные ядрышки (в 54%) или их отсутствие (в 23%) преобладали при неизмененной ткани яичников, множественные – при пограничных опухолях, СКЯВСЗ и доброкачественных опухолях яичника (в 57, 50 и 50% соответственно). Форма ядер преимущественно была веретеновидной при неизмененной ткани яичников (в 85%) и разной – при СКЯВСЗ (в 83%) (рис. 3).
При ИЦХ оценке мазков с признаками истинной атипии были получены следующие результаты: в 80% единичных атипических клеток или их комплексов отмечалась положительная экспрессия р16, в 50% – положительная экспрессия р53, в 40% – положительная экспрессия Ki-67 (рис. 1И и К).

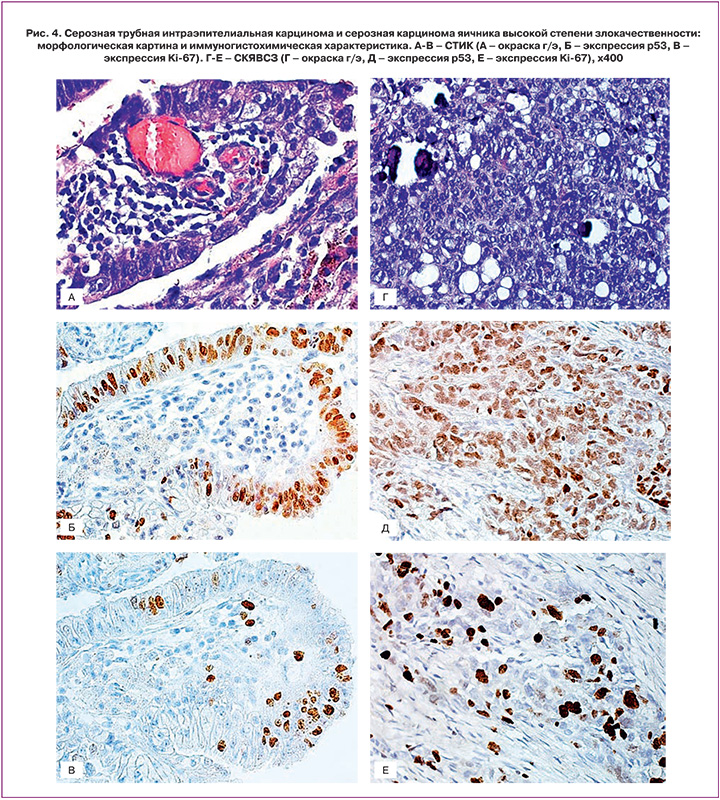
При гистологической оценке удаленных маточных труб были получены следующие результаты: при экстраяичниковой патологии и доброкачественных опухолях яичника выявлены только возрастные изменения маточных труб, при пограничных опухолях яичника во всех случаях была выявлена папиллярная гиперплазия маточной трубы, в маточных трубах пациенток с СКЯВСЗ во всех случаях были выявлены СТИК, в 43% – инвазивная карцинома маточной трубы (табл. 2).
В маточных трубах пациенток с СКЯВСЗ была исследована экспрессия маркеров р53 и Ki-67, на основании которой диагноз СТИК был подтвержден во всех случаях (умеренная или сильная интенсивность окраски р53>75% атипических клеток, экспрессия Ki-67>10%). ИГХ-экспрессия данных маркеров в опухолевой ткани была аналогичной (рис. 4).
Обсуждение
В настоящее время о возможностях цитологического метода в изучении патологии маточной трубы известно немного. Несколько десятилетий назад J. Dudkiewicz (1970) были описаны некоторые особенности эпителия маточной трубы, полученного при интраоперационной аспирации маточной трубы. Цель исследования заключалась в том, чтобы избежать ошибочной интерпретации эпителиоцитов маточной трубы при исследовании рутинных шеечных мазков. Среди визуализированных клеток автор выделил 9 классов, и это затруднило дальнейшее использование данной классификации из-за ее неудобства и низкой воспроизводимости [14]. Небольшое по объему исследование было опубликовано M. Dhanani и соавт. (2014), где авторы описали особенности строения эндосальпингса при доброкачественных опухолях яичников, миоме матки, патологии эндометрия; во всех случаях было отмечено наличие цилиндрических реснитчатых эпителиальных клеток, в 78% – гиперхроматиновые ядра, однако ядерный плейоморфизм, анизонуклеоз ассоциировались только со злокачественной патологией [15]. Представляет интерес работа D. Lum и соавт. (2014), целью которой было описать возможность цитологического исследования эпителия фимбриального отдела маточной трубы после забора «катетером-щеткой» при лапароскопии и гистероскопии. Авторы сравнили результаты при классической и жидкостной цитологии, отметив преимущества последней и выраженные технические сложности, а зачастую невозможность забора материала при гистероскопии [16]. Кроме того, изучались и цитологические особенности клеток маточной трубы, полученных при прямом соскобе их щеткой, данный способ был схож с тем, что применялся в нашем исследовании. Авторами было отмечено, что в полученных таким образом мазках клетки могут располагаться в виде групп, похожих на пчелиные соты, в виде полосок и пластов клеток, а также в виде одиночных клеток. Клетки преимущественно имели фенотип высокого цилиндрического реснитчатого эпителия, единственное круглое или овальное ядро, правильную ядерную мембрану и мелкозернистый хроматин [17]. В большинстве случаев (>80%) в нашем исследовании подобные характеристики отмечались в мазках, полученных от женщин с неизмененными яичниками. Кроме описательных наблюдений, были и исследования, направленные на разработку цитологической диагностики доброкачественных заболеваний маточных труб, ведущих к бесплодию. В частности, взятие материала щеткой из маточной трубы, как было показано, является хорошим методом получения культурального материала для подтверждения диагноза хламидийного сальпингита [18]. Данный метод было предложено использовать также для подтверждения эндометриоза [19] и анализа распространения по маточной трубе злокачественных клеток при раке эндометрия [20]. Однако данные исследования проводились еще до получения доказательств ведущей роли изменений эпителия маточной трубы в развитии серозных опухолей яичника. Так, было показано, что СТИК является непосредственным предшественником СКЯВСЗ, а ПГМТ может являться источником развития пограничных опухолей и далее – СКЯНСЗ [21, 22]. Поэтому в группы исследования включались в основном пациентки с поражениями маточной трубы и эндометрия, в то время как связь между изменениями эпителия маточной трубы и опухолями яичника не изучалась. В то же время цитологический метод может выступать в качестве метода ранней диагностики рака яичников еще до клинических проявлений, а также на стадии поражения только маточной трубы, до распространения опухолевых клеток на яичник и даже на этапе формирования СТИК. Было показано, что на этапе развития СТИК происходят изменения базальной мембраны, приводящие к более легкому отделению пораженного участка от маточной трубы и возможности его имплантации на поверхность яичника [23]. Поэтому в наше исследование были включены именно пациентки с серозными опухолями яичника разной степени злокачественности. Следует отметить, что наибольшее отличие клеточного состава мазков пациенток с незлокачественными (доброкачественными и пограничными) опухолями касалось характеристик ядра. Так, ядерный полиморфизм и неровность ядерной мембраны наблюдались именно в мазках пациенток с СКЯВСЗ (в 100% случаев), мазки с признаками анизонуклеоза в 80% также были получены от женщин с СКЯВСЗ. Такие признаки, как гиперхромия и множественные ядрышки были выявлены в мазках не только пациенток с СКЯВСЗ, но и в мазках пациенток с другими опухолями яичника (в основном с доброкачественными). Поэтому именно полиморфизм ядер, изменения контура ядерной мембраны и анизоцитоз можно назвать наиболее ценными критериями атипичных клеток. Что касается дополнительных методов исследования, то, несомненно, точной верификации атипичных клеток способствует применение ИГХ-метода. В нашем исследовании применялись маркеры р16, р53 и Ki-67, которые, как известно, проявляют позитивную экспрессию при СКЯВСЗ и СТИК. Во всех мазках пациенток с СКЯВСЗ была выявлена позитивная экспрессия данных маркеров в атипичных клетках. Однако к недостаткам примененного варианта ИЦХ-исследования можно отнести тот факт, что в настоящее время возможно лишь совместное исследование экспрессии р16 и Ki-67 в одних и тех же клетках (с помощью набора CINtec PLUS), в то время как экспрессия р53 определялась нами на другом мазке, приготовленном из той же виалы, а значит, и в других клетках. Поэтому в настоящее время нами ведется работа по разработке метода одновременного исследования в клетках р53 и Ki-67, поскольку именно эти маркеры являются наиболее достоверными для подтверждения диагноза СТИК, в то время как р16 может экспрессироваться в так называемых стареющих клетках (aнгл. senescent cells) [24],
а Ki-67 – в пролиферирующем эпителии маточной трубы [25]. Причем данный метод может быть в дальнейшем использован не только для ИЦХ, но и для ИГХ-диагностики, поскольку для верификации интраэпителиальной патологии маточной трубы в соответствии с алгоритмом R. Vang и соавт. [25] необходимо исследование как р53, так и Ki-67, и в настоящее время приходится готовить два гистологических среза. В то же время сложная и тонкая архитектоника фимбриального отдела маточной трубы способствует утрате клеток при приготовлении нового среза и снижению качества диагностики [26].
В зарубежной литературе уже появились первые данные о возможности использования метода цитологической диагностики для скрининга рака яичников, однако предложенный метод не включает ИЦХ-диагностику, в то время как данное дополнительное исследование помогает более точно верифицировать природу цитологических изменений. Следует также отметить, что в нашем исследовании во всех случаях у пациенток с пограничными серозными опухолями была гистологически выявлена ПГМТ, однако специфических признаков данной патологии не выявлено. Это может быть связано, как с деструкцией специфических для данного поражения мелких папиллярных структур в процессе взятия мазка, так и с малым числом наблюдений. Таким образом, в дальнейшем мы планируем провести изучение цитологических мазков из маточной трубы у данных пациенток с формированием более репрезентативной выборки.
Заключение
Таким образом, наше исследование продемонстрировало достаточно широкий спектр изменений эпителиоцитов маточной трубы, которые могут наблюдаться при опухолях яичника различной степени злокачественности. При неизмененных яичниках и доброкачественных опухолях яичника выявлены только возрастные изменения маточных труб. В маточных трубах при пограничных опухолях яичников при гистологической диагностике во всех случаях выявлялась ПГМТ, однако четких цитологических признаков данной патологии выявлено не было. Наиболее характерными были изменения цитологических характеристик клеток при СКЯВСЗ, которые в большей степени касались особенностей ядерного аппарата клеток и были подтверждены ИГХ с помощью маркеров р16, р53 и Ki-67. Данное исследование является пилотным, впервые сфокусированным именно на патологии маточных труб у пациенток с различными серозными опухолями яичника. Дальнейшее изучение цитологических особенностей мазков при интраэпителиальной патологии маточной трубы (ПГМТ, разрастания секреторных клеток (SCOUT), р53-signature, СТИК) необходимо для разработки цитологических критериев для данных поражений, которые позволят диагностировать интраэпителиальные поражения на ранних стадиях, создать платформу для развития новых подходов к поиску ранних диагностических маркеров и оптимизировать тактику ведения пациенток.



