Злокачественные новообразования органов женской репродуктивной системы по-прежнему остаются актуальным предметом для обсуждения во всем мире, что связано с ежегодным увеличением уровня заболеваемости данной группы и сохранением высокой смертности от них. По данным глобального ресурса эпидемиологии рака Международного агентства по изучению рака (МАИР, IARC) GLOBOCAN, в 2020 г. во всем мире было зарегистрировано 7 848 742 новых случаев онкологических заболеваний различной локализации в группе женщин старше 45 лет; при этом от общего количества случаев, рак тела матки составил 4,9% (381 452 новых случаев), а в Российской Федерации количество случаев рака указанной локализации достигло 533 762 (5,3%) случаев, цифра, уступающая только раку молочной железы. Заболеваемость раком эндометрия (РЭ) в группе женщин старше 45 лет резко увеличивается примерно в 3 раза, постепенно достигая своего пика к периоду 55–65 лет. Важно отметить, что более 50% женщин постменопаузального возраста имеют избыточную массу тела, что обуславливает необходимость онкологической настороженности для женщин данной возрастной группы [1].
РЭ относится к гормонально-зависимым опухолям, а наиболее распространенным морфологическим типом РЭ считается эндометриоидная аденокарцинома, выявляемая в 80–85% случаев [2]. На сегодняшний день существует два общепризнанных патогенетических типа РЭ [3].
Опухоли I патогенетического типа встречаются чаще, развиваются на фоне длительной гиперэстрогении и гиперплазии эндометрия; у таких пациенток часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, эстрогенсекретирующие опухоли яичников, синдром поликистозных яичников.
Опухоли II патогенетического типа обычно низкодифференцированные, имеют менее благоприятный прогноз, возникают в старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия.
Только примерно в 5% случаев РЭ ассоциирован с наследственными синдромами, в частности с синдромом Линча [4]. Также выделяют ряд факторов, наличие которых ассоциировано с высоким риском развития РЭ: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, длительная терапия тамоксифеном, менопаузальная гормональная терапия (МГТ) с приемом прогестагенов менее 12–14 дней, а также семейный анамнез РЭ [5–7].
Ожирение неизменно ассоциируется с повышенным риском развития РЭ; поэтому жировую ткань следует рассматривать, как высокоорганизованный, многофакторный компонент в процессе онкогенезе. Жировая ткань функционирует как эндокринный орган; таким образом, ожирение приводит к нарушению секреции провоспалительных цитокинов, адипоцитов, дисфункции и инфильтрации иммунных клеток, индуцируя повреждение нитей дезоксирибонуклеиновой кислоты (ДНК), ангиогенез, клеточную пролиферацию и мутагенез [8]. Согласно результатам мета-анализа Американского института исследований рака при каждом увеличении индекса массы тела (ИМТ) на пять единиц риск развития эндометриоидной аденокарциномы увеличивался на 50% [9]. О значительном увеличении риска сообщила и группа исследователей Bianchini F. et al., авторы выявили линейное увеличение риска РЭ на 200–400% у лиц с ИМТ выше 25 кг/м2 [10].
Однако, длительное избыточное воздействие эстрогенов может быть не только эндогенного генеза, как в случае женщин с ожирением, но также и экзогенного, например, у женщин, принимающих гормональную терапию в период менопаузы. Климактерический период проявляется постепенной перестройкой функционирования организма в условиях снижения и в дальнейшем прекращения функции яичников. На сегодняшний день около 85% женщин в период менопаузы предъявляют жалобы, характерные для климактерического синдрома и требующие назначения препаратов МГТ.
Таким образом, высокая частота распространенности ожирения среди женщин постменопаузального возраста с одной стороны, и широкое внедрение в клиническую практику назначения препаратов МГТ с другой, обуславливают особую актуальность изучения клинико-морфологических особенностей РЭ в данной возрастной группе женщин.
Целью настоящей работы явилось: изучить клинико-морфологические особенности эндометриоидного типа РЭ среди женщин постменопаузального возраста с ожирением (ИМТ от 30 кг/м2) в зависимости от приема препаратов МГТ.
Материалы и методы
В исследование проспективно включили 214 женщин постменопаузального возраста с верифицированным эндометриоидным злокачественным новообразованием эндометрия, которым проводилось хирургическое лечение в отделении гинекологии ФГАУ «НМИЦ ЛРЦ» Минздрава России и онкогинекологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России «Университетская Клиническая Больница № 4» за период 2019–2021 гг. Всем пациенткам был проведен стандартный объем предоперационного обследования и проведено хирургическое лечение в объеме нервосберегающей пангистерэктомии с верхней третью влагалища и тазовой лимфодиссекцией с последующим гистологическим исследованием операционного материала. Стадия рака тела матки определялась в соответствии с системой TNM (UICC, 8-й пересмотр, 2016) и международной классификации FIGO (2009). По степени дифференцировки РЭ разделяли на G1 – высокодифференцированный, G2 – умеренно дифференцированный, G3 – низкодифференцированный рак. Оценка степени ожирения проводилась в соответствии клиническим рекомендациям «Ожирение» от 2021 г., согласно которым ИМТ используется для диагностики избыточной массы тела и ожирения, а также для оценки его степени: ожирение 1-й степени (30,0–34,9 кг/м2); ожирение 2-й степени (35,0–39,9 кг/м2); ожирение 3-й степени (≥40 кг/м2) [11].
В соответствии с ИМТ все пациентки были разделены на 2 группы: в основную группу включили женщин, ИМТ которых составил от 30,0 до 42,6 кг/м2 (140/214; 65,4%); группу сравнения составили 74 женщины с ИМТ от 17,6 до 24,9 кг/м2 (74/214; 34,6%). Средний возраст женщин исследуемых групп составил М (SD): в основной группе 62,9 (7) лет; в группе сравнения – 62,2 (9) лет. По принципу приема препаратов МГТ в каждой группе было выделено по 2 подгруппы: в основной группе 58 (58/140; 41, 4%) женщин принимали препараты МГТ, средняя длительность приема препаратов в непрерывном режиме составила 6 лет 6 месяцев; 82 (82/140; 58,6%) женщины не принимали данных препаратов. В группе сравнения 20 (20/74; 27%) женщин принимали препараты МГТ, средняя длительность приема препаратов в непрерывном режиме составила 8 лет 2 месяца; 54 (54/74; 73%) женщины отрицали прием препаратов МГТ. Все женщины принимали комбинированный эстроген-гестагенный менопаузальный гормональный препарат от 12 месяцев и более. Среди женщин, у которых был отмечен прием препаратов МГТ, средний возраст составил М (SD): в основной группе – 61,6 (3) лет; в группе сравнения – 65,9 (8) лет. Письменное информированное согласие женщин являлось обязательным условием для участия в исследовании. Критерии включения женщин в основную группу: возраст старше 45 лет, ИМТ от 30,0 кг/м2, наличие указаний на прием препаратов МГТ от 12 месяцев в непрерывном режиме, гистологически верифицированный эндометриоидный тип РЭ, отсутствие указаний на наличие злокачественного новообразования иной локализации, на прием тамоксифена. Критерии включения женщин в группу сравнения: возраст старше 45 лет, ИМТ до 24,9 кг/м2, наличие указаний на прием препаратов МГТ от 12 месяцев в непрерывном режиме, гистологически верифицированный эндометриоидный тип РЭ, отсутствие указаний на наличие злокачественного новообразования иной локализации, на прием тамоксифена. Критерии невключения: возраст моложе 45 лет, регулярный менструальный цикл, прием препаратов МГТ менее 12 месяцев, неэндометриоидный тип РЭ по результатам гистологического исследования (серозый, светлоклеточный, злокачественные мезенхимальные и смешанные эпителиальные опухоли), наличие в анамнезе указаний на злокачественные новообразования иной локализации, а также длительный прием тамоксифена, отказ женщины от участия в исследовании.
Статистический анализ
Статистический анализ полученных данных проводился с использованием пакетов прикладных программ MS EXCEL и IBM SPSS 23. По всем исследуемым показателям в каждой группе были подсчитаны параметры распределения (частотный анализ). Оценка значимости различий между исследуемыми группами и подгруппами проводилась с помощью частотного анализа, с применением критерия Хи-квадрат (χ2) Пирсона. Все полученные различия рассматривались на уровне значимости не ниже р≤0,05.
Проведение исследования согласовано локальным Этическим комитетом Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава России (выписка из протокола ЛЭК от 11.02.2021 г. № 03-21). Все пациентки подписали информированное согласие на участие в исследовании и публикацию их медицинских данных.
Результаты и обсуждение
Результаты сравнительного анализа стадии РЭ в соответствии с системой TNM (UICC, 8-й пересмотр, 2016) и международной классификацией FIGO (2009) и степени дифференцировки между исследуемыми группами представлены в таблице 1.
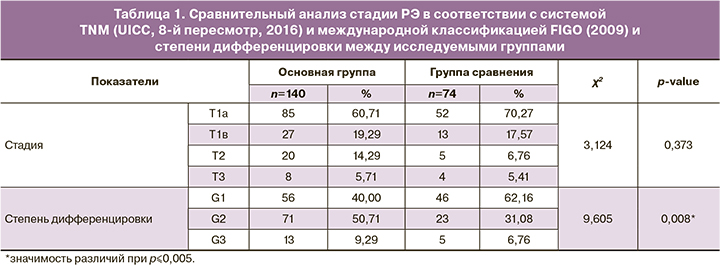
Как видно из представленной таблицы, сравнительный анализ показал статистически значимые различия по степени дифференцировки: высокая степень дифференцировки (G1) значимо чаще встречалась в группе сравнения, в то время как умеренная степень дифференцировки (G2) чаще отмечалась в основной группе (p=0,008).
При проведении сравнительного анализа стадии РЭ в соответствии с системой TNM (UICC, 8-й пересмотр, 2016) и международной классификацией FIGO (2009) и степени дифференцировки между подгруппами женщин, в которых был отмечен прием препаратов МГТ, были получены значимые различия (табл. 2).
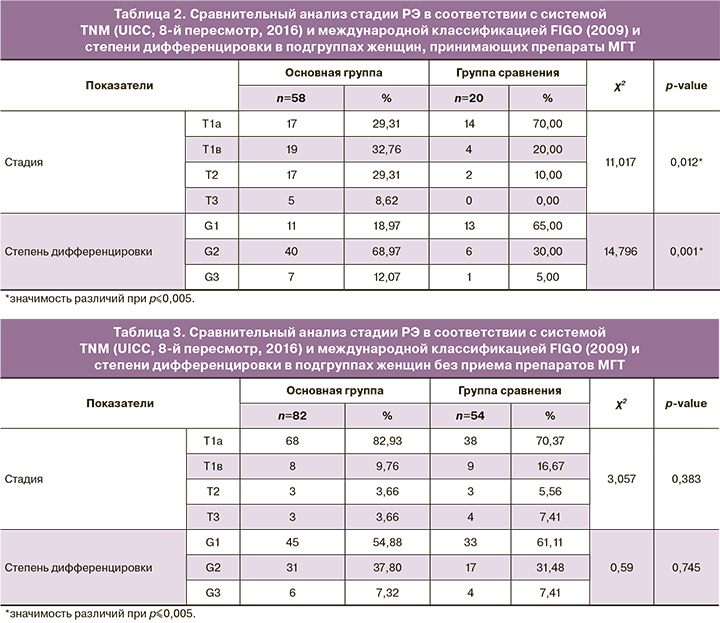
Как видно из данной таблицы, были получены значимые различия по изучаемым параметрам. В подгруппе женщин с нормальной массой тела значимо чаще встречалась стадия с инвазией миометрия менее 50% (Т1а в соответствии с системой TNM (UICC, 8-й пересмотр, 2016), а более поздние стадии РЭ с большей степенью инвазии значимо чаще встречались в основной группе женщин с ожирением (p=0,012). Изучение степени дифференцировки также продемонстрировало значимые различия, а именно: в группе сравнения частота встречаемости высокодифференцированных форм (G1) РЭ была значимо выше, по сравнению с основной группой, где чаще наблюдались умеренно дифференцированные формы (p=0,001).
При проведении сравнительного анализа изучаемых признаков в подгруппах женщин, которые отрицали прием препаратов МГТ, значимых различий обнаружено не было (табл. 3).
На сегодняшний день роль гиперэстрогении в процессе неопластической трансформации эндометрия не вызывает сомнений ввиду наличия достаточно большого количества исследований. Ожирение является не только основным фактором риска развития РЭ I патогенетического типа, но и также значимым фактором, влияющим на прогноз [12]. Именно метаболическое ожирение (ИМТ от 30 кг/м2), а не избыточная масса тела представляет собой основной этиологический фактор; при этом нарушение толерантности к глюкозе, хроническая резистентность тканей к инсулину действуют синергически, повышая в разы риск РЭ [13].
Молекулярные механизмы ассоциации ожирения с риском развития РЭ сложны и до сих пор до конца не изучены. Жировая ткань и ее компоненты посредством сложных сигнальных путей, рецепторов и экспрессии генов не только индуцируют пролиферацию, но также способствуют инвазии и модуляции раковых клеток [8]. На фоне ожирения повышается продукция ароматазы, которая катализирует эндогенное превращение эстрогена из андрогена, что в свою очередь приводит к уменьшению количества глобулина, связывающего половые стероиды, гормона, который связывает и транспортирует эстроген [14]. Тем самым уровень биологически активного эстрогена возрастает еще больше. Онкогенный сигнал эстрогена опосредуется рецепторами эстрогена, модулирующими транскрипционную ядерную сигнализацию [15], таким образом, предполагая связь между сверхэкспрессией рецепторов эстрогена, инвазией и метастазированием эндометриодной аденокарциномы [16]. Yang et al. обнаружили, что эстроген-индуцированная регуляция экспрессии прогибитина представляет собой важный элемент онкогенной трансформации эндометрия, а также сигнального пути эстрогена и его рецепторов; кроме того, высокие уровни прогибитина связаны с плохим прогнозом РЭ [17]. Ожирение связано с рядом метаболических нарушений, которые включают: хроническое воспаление жировой ткани и выработку специфических воспалительных адипоцитокинов, окислительный стресс, периферическую резистентность к инсулину с гиперинсулинемией и дислипидемией [8]. Было обнаружено, что инсулин и инсулиноподобный фактор роста-1 способны влиять на степень дифференцировки опухолей [18]. Адипонектин был признан ключевым посредником, связывающим ожирение и злокачественные новообразования [19]. Большинство эпидемиологических данных ясно свидетельствуют о том, что гипоадипонектинемия связана с повышенным риском злокачественных новообразований, ассоциированных с ожирением, и плохим прогнозом рака [19].
Особенности течения РЭ на фоне метаболического ожирения широко изучаются во всем мире. По результатам исследований отечественных авторов, умеренная степень дифференцировки (в 71,8 % случаев) и глубина инвазии опухоли до ½ миометрия (в 65,3%) рассматриваются, как одна из особенностей течения РЭ на фоне ожирения [20]. Умеренная степень дифференцировки опухолей среди женщин с ожирением значимо чаще встречалась и по результатам нашего исследования (p=0,008), что согласуется с результатами A. Tawfik et al. [21].
В отношении ассоциации приема МГТ и риска РЭ ведется не менее оживленная дискуссия, а результаты проведенных исследований не позволяют сделать однозначного вывода. Ряд исследователей утверждают об увеличении частоты случаев РЭ при приеме препаратов МГТ, результаты работ других исследований повышения данного риска не выявляют [22–26]. Исследование швейцарских ученых J. Simin et al. демонстрирует увеличение риска развития РЭ на 12% среди женщин, которые когда-либо принимали комбинированные препараты МГТ (стандартизированный коэффициент заболеваемости, SIR =1,12, 95% доверительный интервал (ДИ) 1,06–1,19) [27]. Имеющиеся на сегодняшний день данные об ассоциации приема препаратов МГТ с повышенным риском РЭ не позволяют уверенно заключить, может ли прием комбинированных препаратов МГТ устранить избыточный риск РЭ [28].
Заключение
Анализ проведенного нами исследования демонстрирует, что в подгруппе пациенток с ожирением, у которых отмечен прием препаратов МГТ, значимо чаще выявлялись более поздние стадии РЭ с низкой и умеренной степенью дифференцировки (G2–G3). Результаты проведенных исследований свидетельствуют о целесообразности мониторинга ИМТ и своевременной коррекции гормонально-метаболических нарушений у женщин менопаузального возраста перед назначением препаратов МГТ, как с целью снижения частоты развития РЭ, так и минимизации рисков развития более поздних стадий РЭ с низкой и умеренной степенью дифференцировки.



