Одной из причин развития врожденных инфекционных заболеваний (ВИЗ) новорожденных является инфекция Chlamydia trachomatis матери, имеющая несколько стадий (хроническая, персистентная, латентная, острая), которые определяют различные варианты клинического течения заболевания, в том числе: носительство Chlamydia trachomatis (IgM-, IgG в титре >1:60, ПЦР-) или острое бессимптомное (ПЦР+, IgМ+ и/или IgG в титре <1:60) [1–5]. Ведущая роль в защите плода при инфицировании беременной принадлежит плацентарному барьеру, который состоит из эпителия трофобласта, синцития, покрывающего ворсинки хориона плаценты, соединительной ткани ворсинок и эндотелия их капилляров. Клетки трофобласта, составляющие ворсинки хориона плаценты, генерируют субпопуляцию инвазивных экстравиллярных клеток, отделяющих мембраной фетальную кровь от материнской. Слияние дифференцированного цитотрофобласта формирует синцитиотрофобласт, полностью обволакивающий развивающуюся плаценту, и образует эффективный барьер, селективно регулирующий газообмен, а также перенос питательных веществ и экзогенных агентов (лекарств, токсинов, вирусов и пр.). Плотный поляризованный эпителиальный монослой содержит соединения, препятствующие латеральной и парацеллюлярной диффузии субстратов для защиты развивающегося плода; однако ряд вирусов и бактерий способны преодолевать плацентарный барьер, проницаемость которого оценивается по уровням белков в составе околоплодных вод, синтезируемых печенью беременных [6–9].
Chlamydia trachomatis выявляется во всех тканевых структурах плаценты женщин с генитальным хламидиозом. Пораженные хламидиями клетки обнаруживаются в просвете капилляров ворсин хориона, что указывает на возможный гематогенный путь передачи инфекции от матери к плоду (наименее изученный путь, по сравнению с восходящим – через оболочки амниона). В плацентах женщин с генитальным хламидиозом происходит нарушение иммунного гомеостаза с образованием патогенных иммунных комплексов (ПИК), включающих IgM, IgG, IgA и фиксирующих С3-фракцию комплемента как маркер патогенности. Показано, что фиксация ПИК на мембранных структурах плаценты приводит к разрушению мембран синцития и плацентарного барьера [10]. Немаловажную роль в сохранении плотности и целостности трофобластных и эндотелиальных клеток плаценты играют адгезивные межклеточные соединения (окклюзин, VE-кадгерин и β-катенин), которые разрушаются избытком провоспалительных цитокинов – интерлейкина (IL)-1β и трансформирующего фактора роста (TGF) и способствуют развитию хориоамнионита, проникновению инфекционных патогенов к плоду [11]. Повышенная концентрация провоспалительных цитокинов в околоплодных водах является, по мнению некоторых авторов, маркером нарушения плацентарного барьера [12]. Кроме того, Chlamydia trachomatis способна манипулировать множеством процессов, чтобы обеспечить свой цикл развития, активировать сигнальные пути и способствовать высвобождению белков, повреждающих ткани, цитокинов и других биологически активных соединений, а также самостоятельно ремоделировать эпителиальные поверхности путем реорганизации межклеточных адгезий, перепрограммирования мембранного переноса и сигналов иммунного ответа [11].
Следует отметить, что не всякое поражение последа сопровождается развитием внутриутробной инфекции, ВИЗ плода и новорожденного. Большинство детей рождаются в срок, жизнеспособными и даже здоровыми. При этом более чем у 90% инфицированных детей сразу после рождения отсутствуют симптомы заболевания [13]. Поэтому весьма важным является изучение компенсаторных реакций плацентарного барьера, его защитных функций, в том числе и специфических иммунных [10]. Необходимо отметить, что данных по этому вопросу имеется недостаточно, и поэтому по-прежнему остается актуальным поиск методов оценки функционального состояния и проницаемости плаценты у инфицированных беременных еще до родов для прогноза ВИЗ плода и новорожденного, для определения тактики лечения, метода и срока родоразрешения.
По содержанию белков сывороточного происхождения различной молекулярной массы в составе околоплодных вод можно судить о степени проницаемости плацентарного барьера, а уровни синтезируемых при беременности плацентарных белков в крови свидетельствуют о ее функциональном состоянии.
Альфа2-макроглобулин (α2-МГ) и альбумин синтезируются преимущественно клетками печени. Средняя концентрация α2-МГ в крови колеблется в пределах 2–3 г/л, молекулярная масса 720 кДа; белок способен как связывать протеиназы патогенов, препятствуя их инвазии, так и связываться с токсинами патогенов, провоцируя апоптоз клеток. Комплексы α2-МГ с цитокинами оказывают иммуномодулирующее воздействие, в то время как комплексы окисленного (поврежденного) α2-МГ с частично сохранившими литическую активность протеиназами и аутоантителами могут разрушать клетки [14]. Концентрация альбумина в крови составляет 40–60 г/л, молекулярная масса 67 кДа. Через неповрежденные гемотканевые барьеры (плацентарный, спинномозговой) вышеперечисленные белки проникают в незначительных количествах или синтезируются в минимальных концентрациях (нанограммы, пикограммы). Роль синтезируемых трофобластом и плацентой белков в механизмах вынашивания плода и оценке функционального состояния плацентарного барьера активно изучается в настоящее время [15, 16]. Наиболее изучены из них трофобластический β1-глобулин (ТБГ) и ассоциированный с беременностью плацентарный протеин А (РАРР-А).
Цель работы: поиск маркеров проницаемости плацентарного барьера, а также функционального состояния плаценты при беременности, осложненной инфекцией Chlamydia trachomatis при различных вариантах ее течения и состояния новорожденного.
Материалы и методы
Исследование проводилось на базе Перинатального центра г. Новокузнецка (2015–2020 гг.) и иммунологической лаборатории ГОУ ДПО НГИУВ – филиала РМАНПО Минздрава России. Обследовано 125 беременных, поступивших в акушерский стационар в сроке 38–40 недель, с беременностью, осложненной инфекцией Chlamydia trachomatis.
1-я основная группа – 83 беременных имели лабораторные признаки острой хламидийной инфекции (ПЦР+, IgM антитела, IgG в титре <1:60 к Chlamydia trachomatis). Беременным в данной группе антибактериальная терапия в условиях женской консультации не проводилась. Из них у 39 женщин родились дети с ВИЗ. У 44 беременных с острой инфекцией новорожденные были здоровы.
2-я группа наблюдения – 42 беременных с носительством антител класса G к Chlamydia trachomatis в титре >1:60, при обязательном отрицательном ПЦР без клинических проявлений заболевания в течение беременности; из них у 22 беременных родились дети с признаками ВИЗ, у 20 – здоровые дети.
В качестве контрольных значений рассматривались показатели 37 здоровых женщин, родивших здоровых детей.
У всех женщин, участвовавших в исследовании, было получено информированное согласие. Исследование было одобрено Этическим комитетом НГИУВ – филиала ФГБОУ ДПО РМАНПО Минздрава России.
Из исследования исключались беременные, имевшие онкологические, аутоиммунные и хронические воспалительные заболевания органов малого таза в анамнезе, декомпенсированную сердечно-сосудистую, дыхательную, печеночную либо почечную недостаточность, беременность с АВ0- и резус-изосенсибилизацией и ВИЧ-инфекцией, а также воспалительные заболевания органов малого таза нехламидийной этиологии.
Сбор околоплодных вод у рожениц производился в момент спонтанного излития вод либо инструментального вскрытия плодного пузыря. Во всех случаях роды происходили в сроке беременности 38–40 недель.
Сбор крови беременных осуществлялся при поступлении в родильный дом. Полученная сыворотка замораживалась и использовалась единовременно для выполнения анализов в одних условиях.
Содержание α2-МГ в сыворотке крови определяли методом количественного низковольтного ракетного иммуноэлектрофореза с использованием моноспецифических поликлональных кроличьих антисывороток против данного белка. Показатели альбумина в крови исследовали колориметрическим методом с реагентом «бромкрезоловый зеленый» (тест-системы Spinreact, Испания).
Концентрацию плацентарных белков – РАРР-А и ТБГ определяли методом иммуноферментного анализа (ИФА) (тест-системы «Вектор-Бест, Новосибирск). Уровни α2-МГ в околоплодных водах изучались методом ИФА, альбумина – количественным ракетным иммуноэлектрофорезом с использованием исследовательских тест-систем, сконструированных в НИЛ иммунологии ГБОУ ДПО НГИУВ.
Статистический анализ
Проверка нормальности распределения (применялся критерий Шапиро–Уилкса) выявила статистически значимые отклонения от нормального закона распределения для всех рассматриваемых признаков. Описательная статистика количественных признаков представлена медианой и интерквартильным размахом – Me (Q1–Q3). Сравнение 4 групп между собой проводилось с помощью критерия Краскела–Уоллиса, апостериорные сравнения проводились критерием Данна. Коррекция на множественные сравнения осуществлялась в рамках контроля FDR (доля ложных отклонений гипотез) с помощью алгоритма Бенджамини–Крюгера–Йекутили (Benjamini, Krieger and Yekutieli correction). Сравнение показателя в каждой из групп с медианой, измеренной у здоровых женщин, проводилось одновыборочным критерием Вилкоксона.
Для качественных признаков находили абсолютные и относительные (в %) частоты. Сравнение групп по качественным номинальным показателям проводили в ходе анализа таблиц сопряженности критерием Хи-Квадрат (χ2).
Различия считали статистически значимыми при p≤0,05. Статистическая обработка данных производилась с использованием пакета прикладных программ GraphPad Prism 9 (GraphPad Software, Inc., San Diego, CA).
Результаты
В 1-й группе беременных с лабораторными признаками острой хламидийной инфекции (ПЦР+, наличие антител IgМ или IgG в титре <60) у 39 женщин отмечено рождение детей с оценкой по шкале Апгар 7/8 баллов. В раннем неонатальном периоде были диагностированы следующие нозологические формы хламидийной инфекции: генерализованная хламидийная инфекция, респираторный дистресс-синдром 2 типа, пневмония, конъюнктивит, дерматит, кардит, отит. У 44 беременных с признаками острой инфекции родились здоровые дети с высокой оценкой по Апгар (8–10 баллов).
Во 2-й группе беременных – носительство Chlamydia trachomatis (ПЦР-, наличие IgG в титре>1:60) в 22 случаях имело место рождение детей с низкой оценкой по шкале Апгар (6/7) и признаками ВИЗ как хламидийной, так и не хламидийной этиологии: врожденная бактериальная пневмония, генерализованная кандидозная инфекция, конъюнктивит, везикулярный дерматит, бактериальный менингит, хламидийная кардиопатия. У 19 женщин новорожденные были здоровы, с оценкой при рождении по Апгар 8–10 баллов.
При гистологическом исследовании плацент у матерей, инфицированных Chlamydia trachomatis, как при острой инфекции, так и при носительстве патогена и рождении детей с ВИЗ выявлены морфологические признаки инфекции I–III степени: 1) восходящая инфекция I ст. (серозный хориоамнионит) – 21/61 (35%); 2) восходящая инфекция II ст. (гнойный хориоамнионит, хориодецидуит) – 10/61 (16%); 3) восходящая инфекция III ст. (гнойный хориоамнионит, флебит, артериит сосудов пуповины, экссудативный фуникулит) – 4/61 (6%). У беременных групп наблюдения, родивших здоровых детей, при гистологическом исследовании выявлены: восходящая инфекция I ст. – 3/64 (5%); серозный хориоамнионит, патологическая незрелость ворсин – вариант дифференцированных промежуточных ворсин хориона – 4/64 (6%); гиперплазия плаценты, вторичная хроническая плацентарная недостаточность, плацентарная гипертензивная форма (облитерационная ангиопатия), компенсация – 8/64 (13%), зрелая плацента – 35/64 (55%).
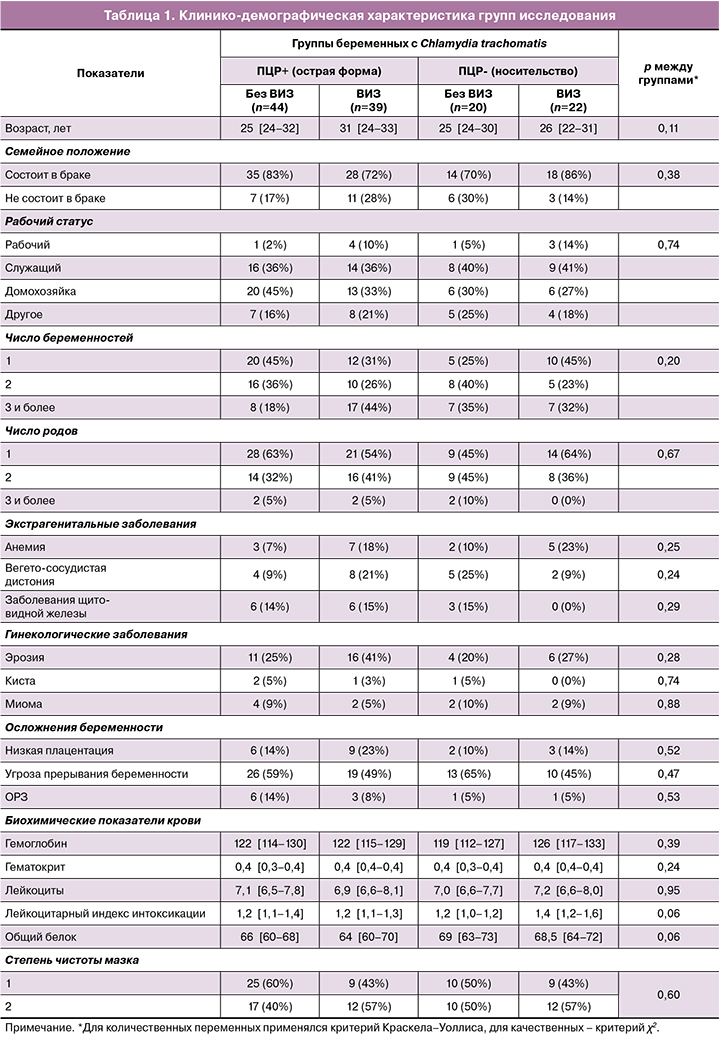
Группы исследования были сопоставимы между собой по возрасту, сопутствующим заболеваниям, биохимическим показателям крови (табл. 1).
Результаты исследований белков сывороточного происхождения в составе околоплодных вод позволили выявить определенные закономерности и сделать заключение о проницаемости плацентарного барьера в случаях рождения детей с ВИЗ или без них у беременных с наличием инфекции Chlamydia trachomatis в различных вариантах течения. Средняя концентрация высокомолекулярного α2-МГ (молекулярная масса 720 кДа) в околоплодных водах беременных 1-й основной группы наблюдения (ПЦР+) с рождением детей с ВИЗ была сопоставима с контрольными показателями и статистически значимо не отличалась от показателей женщин, родивших детей без ВИЗ (табл. 2). Однако у женщин с носительством инфекции уровень данного белка был статистически значимо выше в группе ВИЗ по сравнению с женщинами, родившими детей без ВИЗ (55,0 (25,4–111,4) мг/л против 13,8 (5,5–37,2) мг/л; p=0,03), а также статистически значимо выше контрольных значений (p=0,001 в группе ВИЗ, p<0,001 в группе без ВИЗ) и превышал показатели в группе женщин с острой инфекцией (p=0,005 в группе ВИЗ, p<0,001 в группе без ВИЗ).

Несколько другая картина наблюдалась при изучении показателей в околоплодных водах другого белка сывороточного происхождения – низкомолекулярного альбумина (молекулярная масса 67 кДа). Установлено статистически значимое повышение уровня альбумина при рождении детей с врожденной инфекцией независимо от варианта инфекционного процесса как в сравнении с контролем, так и по сравнению с группами без ВИЗ у новорожденных. Наличие хламидийной инфекции при беременности и рождение больных детей было ассоциировано с повышенными показателями альбумина в околоплодных водах: 5,5 (2,3–11,5) г/л против 1,8 (1,2–2,9) г/л в группе без ВИЗ при носительстве Chlamydia trachomatis (p=0,003) и 3,3 (2,3–7,4) г/л против 1,8 (1,0–2,2) г/л у матерей, родивших детей без ВИЗ, при острой инфекции (p<0,001).
При анализе изученных показателей в сыворотке крови не выявлено зависимости уровня альбумина у беременных от варианта течения инфекционного процесса и состояния новорожденного: показатели в группах значимо не различались между собой и не отличались от показателей здоровых беременных. В то же время концентрация α2-МГ у беременных с признаками острой хламидийной инфекции и рождением детей с ВИЗ была максимально высокой, статистически значимо отличаясь от контрольных значений (p<0,001) и значений показателя в других группах наблюдения: 3,3 (2,9–3,6) г/л против 2,5 (2,3–2,7) г/л в группе без ВИЗ при острой инфекции и против 2,4 (1,9–3,0) г/л в группе с ВИЗ при носительстве Chlamydia trachomatis.
Содержание ТБГ в крови беременных при наличии Chlamydia trachomatis было стабильным и статистически значимо не отличалось от показателей у здоровых. При этом уровни РАРР-А в крови беременных с носительством Chlamydia trachomatis были значимо снижены при рождении детей с инфекционным заболеванием как по сравнению с контролем (p<0,001), так и по сравнению с группой женщин, родивших детей без ВИЗ: 86 195 (48 470–89 689) мЕд/л против 139 423 (133 221–184 893) мЕд/л (p=0,03).
Обсуждение
Для изучения характера проницаемости плацентарного барьера нами был избран методический подход, заключающийся в определении двух белков сывороточного происхождения (высокомолекулярного α2-МГ и низкомолекулярного альбумина) в околоплодных водах, синтез которых тканями фето-плацентарной системы ничтожно мал, в то время как концентрации данных белков в крови достаточно высоки. Кроме того, высокомолекулярный α2-МГ через неповрежденные гистогематические барьеры не проникает. Поэтому наличие в составе околоплодных вод высоких концентраций низко- и высокомолекулярных белков свидетельствует о повышенной неселективной проницаемости плацентарного барьера.
Согласно полученным результатам, при беременности, осложненной хламидийной инфекцией, и рождении детей с ВИЗ увеличивается неселективная проницаемость плаценты, что сопровождается существенным повышением белков сывороточного происхождения в составе околоплодных вод – от 2 до 20 раз. Повышение α2-МГ наблюдалось только при носительстве Chlamydia trachomatis, максимальные значения данного показателя наблюдались при рождении детей с ВИЗ. Повышение уровня альбумина в околоплодных водах при рождении детей с ВИЗ наблюдается как при носительстве Chlamydia trachomatis, так и при острой хламидийной инфекции. Полученные данные согласуются с ранее опубликованными клиническими наблюдениями [17].
Мы полагаем, что повышение концентрации α2-МГ в крови беременных при остром течении заболевания и рождении детей с инфекцией обусловлено длительной циркуляцией образующихся иммунокомплексов с поврежденными при воспалении молекулами данного ингибитора протеиназ (в том числе бактериальных гидролаз) за счет нарушения скорости их утилизации [18, 19], чего не наблюдается при носительстве Chlamydia trachomatis.
Снижение РАРР-А в крови беременных при носительстве Chlamydia trachomatis и рождении детей с ВИЗ указывает на поражение плацентарной ткани и нарушении ее функциональной состоятельности, что, в свою очередь, подтверждает предположение о ведущей роли плаценты в развитии ВИЗ у новорожденных и ее компенсаторных возможностях [10].
Выводы
1. Белками-маркерами оценки проницаемости плацентарного барьера могут быть высоко- и низкомолекулярные сывороточные белки в составе околоплодных вод. При беременности, осложненной хламидийной инфекцией, и рождении детей с ВИЗ усиливается неселективная проницаемость плацентарного барьера. Особенно выражен этот процесс при носительстве Chlamydia trachomatis, что свидетельствует о глубоком поражении плацентарной ткани, несмотря на отсутствие клинических признаков заболевания у беременных, и сопровождается более тяжелыми формами ВИЗ новорожденного.
2. При беременности, осложненной хламидийной инфекцией и остром варианте ее течения, в крови повышается концентрация α2-МГ, что может повлиять на его функции иммуномодулятора и ингибитора протеиназ. При носительстве Chlamydia trachomatis уровень данного белка не отличается от контрольных показателей здоровых беременных.
3. Максимально низкие показатели плацентарного белка РАРР-А выявлены в крови беременных с носительством Chlamydia trachomatis при рождении детей с ВИЗ, что указывает на компенсаторную защитную функцию плаценты при инфицировании беременных.



