Кадмий (Cd) и свинец (Pb) являются химическими элементами высокой токсичности. Соли кадмия обладают мутагенными и канцерогенными свойствами и представляют потенциальную генетическую опасность [1–3]. Избыток Cd приводит к дефициту кальция, цинка, меди и селена [4]. Установлено, что пренатальный и неонатальный периоды являются столь чувствительными для токсического воздействия Cd, что даже незначительные его концентрации, проникающие к плоду, способны вызывать изменения в функционировании глутатионовой системы, нарушать процессы свободнорадикального окисления и становиться причиной увеличения количества мутаций в генофонде [1, 2, 5]. По рекомендации ВОЗ Cd как биомаркер получил высокие баллы по критериям важности, обоснованности и достоверности и рекомендован для определения в моче и крови беременных женщин [1].
Неблагоприятное действие Pb на репродуктивную систему проявляется в бесплодии, выкидышах, задержке роста плода (ЗРП), пороках развития новорожденных [6, 7]. Под воздействием ацетата Pb в период беременности происходит уменьшение количества эритроцитов и концентрации гемоглобина в цельной крови, морфофункциональные изменения в печени [8, 9]. Длительная свинцовая интоксикация материнского организма инициирует замедление темпов остеопластического процесса и внутренней реконструкции трубчатых костей после рождения. В условиях свинцовой интоксикации морфофункциональные изменения гемато-плацентарного барьера приводят к уменьшению массы плаценты и ЗРП [6, 7]. Уровень Pb в пуповинной крови является биомаркером, обеспечивающим прогнозирование его долговременного воздействия на здоровье человека [1].
Глутатион (GSH) играет важную роль в метаболизме ряда тяжелых металлов [10–12]. Такие металлы как ртуть, Cd или Pb связываются с GSH с образованием конъюгатов путем процесса, катализируемого глутатион-S-трансферазами (GST). Конъюгаты затем выводятся из организма с калом и мочой [13, 14]. GSTs являются метаболизирующими ксенобиотики ферментами II фазы, которые катализируют конъюгацию различных электрофильных соединений с GSH [15]. Гены глутатион-S-трансферазы M1 (GSTM1) и глутатион-S-трансферазы T1(GSTT1) являются полиморфными в человеческой популяции [16]. Так называемые нулевые варианты генов GSTM1и GSTT1 (GSTM1-null и GSTT1-null) получаются в результате двух гомозиготных делеций, что приводит к отсутствию гена и потере его функциональной активности. Наличие GSTM1-null и GSTT1-null генотипа у матери может приводить к увеличению содержания тяжелых металлов в организме как матери, так и ребенка [17].
Также тяжелые металлы вызывают оксидативный стресс вследствие образования свободных радикалов или повреждения антиоксидантных систем на клеточном уровне. Оксидативный стресс оказывает негативное влияние на рост плода [18, 19]. GSH удаляет свободные радикалы кислорода, образованные под действием тяжелых металлов, и генотипы GSTM1-null и GSTT1-null приводят к усилению оксидативного стресса [10, 20].
В настоящее время идет активное изучение механизмов влияния тяжелых металлов на рост плода при различных полиморфизмах генов GSTM1 и GSTT1. В литературе есть данные по влиянию нулевых вариантов этих генов на содержание ртути в крови матери и пуповинной крови и сочетанного влияния этих факторов на массу тела новорожденного [11, 17]. Однако данных по влиянию на массу тела новорожденных других тяжелых металлов, таких как Cd и Pb, при различных генотипах GSTM1/GSTT1 недостаточно.
В связи с этим мы провели исследование, целью которого стало выявление связи между пренатальной экспозицией к Cd и Pb, делецией генов глутатион-S-трансфераз (GSTM1 и GSTT1) и массой тела детей при рождении.
Материал и методы исследования
В популяционное одномоментное исследование были включены 166 родильниц, отобранных случайным образом из популяции беременных женщин, поступивших для родоразрешения в родильные дома г. Читы. Все женщины были в возрасте от 20 до 40 лет и проживали в Чите и Читинской области не менее 5 лет. Женщины с пороками развития плода, многоплодием, сахарным диабетом, преэклампсией/эклампсией не включались в исследование. Все пациентки подписали информированное согласие на участие в исследовании.
Обследование пациенток включало анкетирование, забор венозной крови в момент родов и забор суточной мочи в первые сутки после родов. Обследование новорожденных заключалось в измерении роста и массы тела при рождении и заборе суточной мочи в первые дни после родов. Анкетирование пациенток содержало данные о факторах риска, влияющих на массу тела новорожденных. В качестве возможных факторов риска малой массы тела новорожденных рассматривались возраст, образование, курение и прием алкоголя во время беременности, гинекологические и соматические заболевания, осложнения и заболевания во время настоящей беременности. Информация о весе и росте пациенток в 1-м триместре беременности извлекалась из обменных карт родильниц. Гестационный возраст рассчитывался путем вычитания даты первого дня последней менструации из даты родов. Первый день последней менструации устанавливался путем опроса родильниц, а также рассчитывался путем сопоставления данных ультразвукового исследования, проведенного в первом триместре беременности. Масса тела новорожденных замерялась при помощи электронных весов с точностью до 10 г. Малая масса тела новорожденного для соответствующего гестационного возраста устанавливалась, если масса тела при рождении была ниже 10-го перцентиля распределения массы тела для данного гестационного возраста (МКБ-10, Р05.0).
Исследование Pb и Cd в моче производилось методом атомной абсорбционной спектрометрии 21, 22]. Пределом обнаружения Pb была концентрация 0,0012 мг/л, Cd – 0,0004 мг/л. Забор суточной мочи матерей и их новорожденных детей производился по описанной методике [23].
Выделение ДНК для генотипирования проводили из периферической крови по методике «Проба ГС Генетика» (ООО «НПО ДНК-Технология», Россия) согласно прилагаемой инструкции.
Определение генотипов GSTM1 и GSTT1 проводилось c помощью коммерческих ПЦР (полимеразная цепная реакция) тест-систем (ООО «НПО ДНК-Технология», Россия). Данная методика основана на использовании 5’-экзонуклеазной активности полимеразы (TaqMan Assay). Использовались ДНК-пробы, комплементарные участку анализируемого гена. В случае наличия соответствующего гена во время стадии элонгации флуоресцентная метка отделяется от гасителя, и ее свечение может быть детектировано. ПЦР проводилась с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Для статистического анализа использовались пакеты статистических программ SAS v.9 (США) и Statistica 10 (США). Расчет объема выборки был основан на данных литературы о корреляции между массой тела новорожденного и пренатальной экспозицией к Cd [24]. Первичной конечной точкой явилась средняя масса тела новорожденных в зависимости от уровня Cd/Pb и генотипов GSTM1/GSTT1. Вторичными конечными точками были коэффициенты регрессии сочетанного влияния Cd/Pb и GSTM1/ GSTT1 на массу тела новорожденных.
Были рассчитаны медианы и перцентили для распределения Cd/Pb в моче женщин и их новорожденных детей. Отношения между концентрацией Cd/Pb и факторами риска, массой тела новорожденных и факторами риска были определены с помощью рангового теста Крускала–Уоллиса. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Пирсона.
Для оценки влияния уровня Cd/Pb в материнской и детской моче на массу тела новорожденных в зависимости от генотипа GSTM1/GSTT1 был применен многофакторный регрессионный анализ. Для этого концентрации Cd/Pb были логарифмически преобразованы вследствие сильно скошенного распределения данных. Для оценки совместного влияния генотипа и Cd/Pb на массу тела новорожденных были созданы сочетанные показатели Cd/Pb и генотипа. Также был проведен стратификационный анализ в зависимости от генотипа GSTM1/GSTT1, и регрессионный анализ комбинированного влияния GSTM1/GSTT1 на массу тела новорожденных. При применении метода линейной регрессии с помощью метода наименьших квадратов была рассчитана средняя масса тела новорожденных в зависимости от генотипа GSTM1/GSTT1 и концентрации Cd/Pb. Для сравнения средних показателей в группах была применена поправка Бонферрони. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05. Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. Кулакова Минздрава России.
Результаты исследования
В исследование были включены 166 женщин, средний возраст которых составил 26,1±5,6 года. Распространенность генотипов GSTM1-null и GSTT1-null составила соответственно 51,2 и 16,9%. Сочетание генотипов GSTM1-null и GSTT1-null было выявлено у 13 женщин (7,8%). Так как в данном исследовании не различали гетерозиготных и гомозиготных носителей делеций, соотношение между генотипами согласно равновесию Харди–Вайнберга не было определено.
Средняя масса тела новорожденных была 2630,6±518,3 г при среднем гестационном возрасте 38,9±1,7 недели. 83,1% детей родились в срок (после 376 недель). Масса тела детей при рождении увеличивалась при увеличении индекса массы тела (ИМТ) матерей в конце беременности и снижалась при курении и приеме алкоголя во время беременности (табл. 1). Она не отличалась значимо у матерей с наличием и отсутствием делеции GSTM1, но была погранично значимо ниже у женщин с наличием делеции GSTT1 (р=0,0609).
Распределение концентрации Cd и Pb в моче пациенток и их новорожденных детей представлено в табл. .
Медиана концентрации Cd и Pb в моче женщин составила 0,0030 мг/л и 0,0044 мг/л соответственно. Содержание этих металлов в моче новорожденных детей коррелировало с концентрацией в моче матерей, хотя медианы этих показателей в моче детей были несколько выше (r=0,84, p<0,001 для Cd, r=0,88, p<0,001 для Pb).
В табл. 3 представлены данные о содержании Cd и Pb в моче в зависимости от материнских факторов риска.
Концентрация Cd и Pb в моче женщин и детей была значимо выше у курящих и потребляющих алкоголь матерей, имеющих более низкий ИМТ, а также при наличии делеции GSTT1. Наличие делеции хотя бы одного из генов или обоих генов сочеталось с двукратным возрастанием концентрации тяжелых металлов в моче, хотя и не статистически значимо. Также концентрация Pb была значимо выше в моче матерей и их новорожденных детей, родившихся преждевременно.
Данные по оценке сочетанного влияния концентрации Cd/Pb и делеций GST-генов на массу тела новорожденных представлены в табл. 4. Для этого проводился регрессионный скорректированный анализ с учетом ИМТ, гестационного возраста, курения и приема алкоголя во время беременности. Масса тела при рождении значимо снижалась при повышении концентрации Cd и Pb в моче как женщин, так и детей. Сочетанный показатель GSTT1*Cd в моче детей значимо влиял на массу детей при рождении, сочетанные показатели GSTT1*Cd в моче матерей и GSTM1*Cd в моче матерей и детей погранично значимо влияли на массу новорожденных детей.
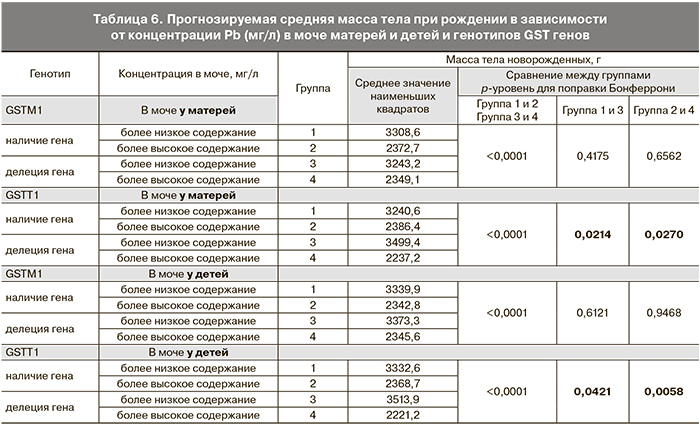
Нами был проведен анализ по сравнению прогнозируемого среднего значения наименьших квадратов массы тела при рождении при одновременном действии факторов наличия или отсутствия делеции каждого из изучаемых генов и концентрации Cd и Pb. Для этого были созданы бинарные переменные содержания тяжелых металлов в моче матерей и детей с порогом отсечки, соответствующим 25-й перцентили распределения данных по указанным показателям. При сравнении массы тела новорожденных в группах с отсутствием или наличием делеций генов GSTM1 и GSTT1 между подгруппами с более высоким и более низким содержанием тяжелых металлов как у матерей, так и у детей масса тела значимо уменьшалась при увеличении концентрации Cd и Pb (p<0,0001). Однако при сравнении массы тела новорожденных в группах с более низким и более высоким содержанием тяжелых металлов между подгруппами с отсутствием или наличием делеции гена GSTM1 не было выявлено значимой разницы. Тогда как в подгруппах с отсутствием или наличием делеции гена GSTT1 масса тела значимо отличалась среди матерей и детей с более высоким и низким содержанием Cd и Pb в моче. При этом в группах с низким содержанием как Cd, так и Pb масса тела детей была даже несколько выше при наличии делеции, тогда как более высокое содержание Cd и Pb у пациенток с наличием делеции гена GSTT1 сочеталось со значимым снижением массы тела новорожденных детей (табл. 5, 6, рисунок).
Нами также был проведен анализ по сравнению прогнозируемого среднего значения наименьших квадратов массы тела при рождении при одновременном действии факторов наличия или отсутствия делеции обоих изучаемых генов и концентрации Cd и Pb. Для этого были созданы категориальные переменные содержания тяжелых металлов в моче матерей и детей с порогами отсечки, соответствующим 25-й и 75-й перцентилям распределения данных по указанным показателям. При сравнении массы тела новорожденных в группах с отсутствием, наличием null-генотипа обоих или хотя бы одного из генов GSTM1 и GSTT1 между подгруппами с более высоким и более низким содержанием тяжелых металлов, как у матерей, так и у детей масса тела значимо уменьшалась при увеличении концентрации Cd и Pb (p<0,0001). Однако при сравнении массы тела новорожденных в группах с более низким и более высоким содержанием тяжелых металлов между подгруппами с отсутствием, наличием обоих или хотя бы одного null-генотипа генов GSTM1/GSTT1 не было выявлено значимой разницы.
Обсуждение
В нашем исследовании мы выявили, что полиморфизм генов, кодирующих GST, могут модифицировать взаимосвязь между экспозицией к Cd/Pb и массой тела при рождении. Сама по себе повышенная концентрация изучаемых тяжелых металлов была ассоциирована с более низкой массой тела новорожденных детей. Этот тренд был особенно выражен при выявлении GSTT1-null генотипа. Мы не нашли других исследований в литературе, в которых бы проводилась оценка влияния Cd и Pb на массу тела при рождении в зависимости от полиморфизма GST генов.
Вначале мы провели оценку содержания Cd и Pb в моче матерей и новорожденных. Медианы уровня металлов были низкими, но несколько выше у детей. Эти данные соответствуют данным некоторых исследований, в которых было продемонстрировано более высокое содержание тяжелых металлов в биологических жидкостях плодов/новорожденных по сравнению с их матерями [2, 17, 25]. Объяснением этого феномена может служить то, что моча, являясь ультрафильтратом крови, отражает более высокий уровень гематокрита и сродства тяжелых металлов к гемоглобину плода. Следствием может явиться более высокое содержание Cd и Pb в крови и, как следствие, в моче новорожденных детей по сравнению с их матерями.
Результаты исследований по влиянию экспозиции тяжелых металлов на исходы беременности весьма противоречивы. Ряд авторов отрицают негативное влияние Cd и Pb на массу тела детей при рождении [1, 4]. В других работах показаны отрицательные корреляции между уровнями тяжелых металлов и массой тела новорожденных [2–4, 24]. В нашем исследовании мы выявили отрицательную зависимость между уровнем как Cd, так и Pb, и массой тела при рождении. При проведении регрессионного анализа с учетом факторов, независимо влияющих на массу тела детей (ИМТ матерей, курение и прием алкоголя во время беременности, гестационный возраст при рождении) было выявлено, что повышение уровня Cd и Pb в моче матерей и их новорожденных детей, статистически значимо снижает массу тела при рождении.
Однако нас интересовало, будет ли выявленная зависимость отличаться у женщин с наличием или отсутствием GST генов. При первоначальном анализе были выявлены значимые корреляции между делецией гена GSTT1 и уровнем Сd у матерей и детей и уровнем Pb у матерей. Аналогичных корреляций между делецией гена GSTM1 и содержанием тяжелых металлов получено не было. При оценке влияния делеций генов на массу тела детей было также показано, что делеция только GSTT1, но не GSTM1 гена, погранично значимо влияла на снижение массы тела при рождении. Масса тела детей у матерей с GSTT1-null генотипом была в среднем на 100 г ниже, чем у детей, чьи матери имели данный ген. Мы создали сочетанные показатели наличия/отсутствия изучаемых генов и уровней Cd и Pb в моче. В регрессионном анализе по оценке влияния данных показателей на массу тела детей было выявлено, что только сочетанное влияние делеции GSTT1 гена с повышенным уровнем Cd в моче новорожденных снижало массу тела детей с высокой степенью статистической значимости.
Далее мы провели стратификационный анализ, в котором оценили массу тела при рождении в зависимости от наличия /отсутствия делеций GST генов и уровней Cd и Pb выше или ниже заданного порога отсечки. Было выявлено, что масса тела детей значимо уменьшалась при увеличении концентрации Cd и Pb в группах как с отсутствием, так и с наличием делеций генов GSTM1 и GSTT1, что было закономерно и соответствовало предшествующему анализу. Более интересным был тот факт, что при сравнении массы тела новорожденных между группами с отсутствием или наличием генов, она значимо снижалась (на 100–150 г) при делеции гена GSTT1 у женщин, в моче которых определялся более высокий уровень как Cd, так и Pb. Аналогичная зависимость выявлялась при повышенном уровне металлов в моче новорожденных. У женщин с более низким содержанием Cd/Pb в моче делеция гена GSTT1 не приводила к снижению массы тела детей. Напротив, в этом случае масса тела детей при рождении была даже несколько выше у женщин с наличием варианта гена GSTT1-null. Что касается гена GSTM1, стратификационный анализ не выявил каких-либо отличий в массе тела детей, рожденных у женщин с делецией этого гена вне зависимости от уровня тяжелых металлов в моче. Также не было выявлено значимого влияния на массу тела детей делеции обоих генов в группах с более низким или более высоким содержанием тяжелых металлов, что, по-видимому, объясняется отсутствием влияния делеции гена GSTM1 на массу тела при рождении через модификацию уровня Cd и Pb.
Таким образом, пренатальная экспозиция к Cd и Pb может оказывать влияние на массу тела новорожденных детей в зависимости от наличия GSTT1-гена. Генетически обусловленное нарушение системы детоксикации, обусловленное делецией GST-генов, приводит к повышению чувствительности к неблагоприятным факторам внешней среды, таким как загрязнение тяжелыми металлами. Полученные данные позволяют рекомендовать определение полиморфизма GST-генов в группе женщин с повышенной экспозицией к тяжелым металлам для выявления групп риска по развитию задержки роста плода и своевременной профилактике рождения детей с низкой массой тела.



