ВИЧ-инфекция вышла за пределы уязвимых групп населения и активно распространяется в общей популяции. По состоянию на 31 октября 2019 г. кумулятивное количество зарегистрированных случаев выявления ВИЧ-инфекции среди граждан Российской Федерации (РФ) составило 1 408 264 человек, из которых 347 711 умерли. В настоящее время в РФ наиболее высокий уровень пораженности ВИЧ-инфекцией среди населения наблюдается в возрастной группе 30–44 года. В гендерной структуре преобладают мужчины (63%), из них 3,28% находятся в возрасте 35–39 лет, большинство планируют реализацию репродуктивной функции [1].
Использование антиретровирусной терапии (АРВТ) позволяет безопасно реализовать репродуктивную функцию в данной группе пациентов, в том числе и самостоятельно, без использования вспомогательных репродуктивных технологий (ВРТ). Однако существует мнение, что АРВТ может оказывать негативное влияние на показатели спермы, что проявляется в снижении концентрации, подвижности сперматозоидов, увеличении количества патологических форм, как результат – снижении фертильности ВИЧ-инфицированных мужчин [2]. Одним из возможных механизмов негативного влияния АРВТ, в частности нуклеотидных ингибиторов обратной транскриптазы (НИОТ), на качество спермы могут быть изменения метаболизма сперматозоидов в связи с токсическим повреждением митохондрий [3, 4, 5]. Известно, что зрелый сперматозоид человека содержит приблизительно 50–75 митохондрий, в каждой из которых содержится одна копия мтДНК. Именно митохондрии являются главным источником энергии для осуществления двигательной активности в сперматозоидах млекопитающих [6]. В исследованиях Santos (2009), Pelliccione (2011) показано, что относительное содержание мтДНК значительно снижается в сперме мужчин с олиго- и астенозооспермией [7, 8]. Ряд авторов полагают, что неблагоприятное воздействие АРВТ связано с развитием оксидативного стресса [9]. Образование активных форм кислорода (АФК) увеличивает перекисное окисление липидов и приводит к повреждению хроматина сперматозоидов и нарушению целостности ДНК сперматозоидов [10, 11]. Помимо этого, АФК повреждают мембрану сперматозоидов, в результате чего снижается их подвижность и способность оплодотворять яйцеклетку [12]. Van Leeuwen E. et al. (2009), напротив, показали, что количество копий мтДНК в сперматозоидах ВИЧ-инфицированных мужчин, получающих АРВТ, повышается по сравнению с ВИЧ-инфицированными, никогда не принимавшими АРВТ и серонегативными мужчинами [13].
Таким образом, противоречивые данные о влиянии АРВТ на число копий мтДНК сперматозоидов у мужчин с ВИЧ-инфекцией послужили основанием для проведения данного исследования.
Цель исследования – изучить содержание мтДНК в образцах спермы ВИЧ-инфицированных мужчин, принимающих АРВТ.
Материалы и методы
Проведено проспективное клиническое исследование у 190 мужчин, которые обратились для оценки фертильности и реализации репродуктивной функции в 1-е гинекологическое отделение (руководитель – к.м.н. Абубакиров А.Н.) ФГБУ «НМИЦ АГП имени академика В.И. Кулакова». Основную группу исследования составили 94 ВИЧ-инфицированных мужчин, контрольную – 96 пациентов без ВИЧ-инфекции. Количественная оценка мтДНК, лишенной делеций (mtDNAdel-), тотальной мтДНК (mtDNAtotal) и их соотношения (mtDNAtotal/mtDNAdel-) проведена в 58 и 96 образцах спермы соответственно. Критерии включения в основную группу: наличие ВИЧ-инфекции, 3 субклиническая, 4а, 4б, 4в стадии, фаза ремиссии; прием АРВТ, неопределяемая вирусная нагрузка в 2 последовательных исследованиях, сделанных с интервалом не менее 3 месяцев; информированное согласие на участие в настоящем исследовании. Критерии исключения: коинфекция вирусными гепатитами В, С, отсутствие АРВТ. Критерии включения в группу контроля: ВИЧ-серонегативный статус.
Статус пациентов по ВИЧ-инфекции оценивали на основании данных о стадии и фазе заболевания, уровне вирусной нагрузки, CD4+, CD8+ лимфоцитов и длительности, а также составе АРВТ.
Сбор эякулята производился путем мастурбации после 3–4 дней полового воздержания в стерильный пластмассовый контейнер. Оценка параметров спермограммы производилась в соответствии с нормативами ВОЗ (2010) [14].
Далее образцы спермы были разделены на нормозооспермию, субфертильную и тяжелую патозооспермию. Критерии выраженной патологии спермы: концентрация сперматозоидов до 12 млн/мл, сперматозоиды с прогрессивным движением (А+В) – менее 29%, количество патологических форм – более 97%. Субфертильная сперма: концентрация сперматозоидов 12–15 млн/мл, сперматозоиды с прогрессивным движением (А+В) – 30–32%, количество патологических форм – не более 97%.
Исследование копийности мтДНК проводилось по следующей методике: в асептических условиях с использованием инвертированного микроскопа сперматозоиды отмывали в стерильном фосфатно-солевом буфере, а затем помещали в индивидуальные пробирки, содержащие данный буфер. Определение абсолютного числа копий мтДНК осуществляли с помощью полимеразной цепной реакции (ПЦР) в реальном времени. Для этого из образца спермы выделяли ДНК. Клетки лизировали буфером с гуанидин тиоцианатом в течение 10 минут при температуре 65 °С. После этого осуществляли осаждение ДНК изопропанолом в присутствии соосадителя путем центрифугирования образцов при 13 тыс. об./минуту в течение 10 минут (набор «Проба-НК-плюс», ООО «ДНК-Технология», Россия). Далее осадок промывали двумя промывочными растворами, высушивали и ресуспендировали в 50 мкл элюирующего раствора. Для подсчета копий мтДНК проводили ПЦР в реальном времени с использованием олигонуклеотидов и TaqMan-проб для амплификации и количественного определения специфических фрагментов мтДНК (ген MT-ND2 – mitochondrially encoded NADH dehydrogenase 2 и ген MT-ND4 – mitochondrially encoded NADH dehydrogenase 4). Использование праймеров к гену MT-ND2 позволило оценить содержание тотального пула мтДНК (mtDNAtotal), а праймеров к гену MT-ND4 – содержание пула полноразмерной мтДНК, лишенной делеций в данном регионе (mtDNAdel-), в частности del mtDNA4977. Нормировка осуществлялась на геномную ДНК (ген LTC4S – leukotriene C4 synthase). Количество мтДНК относительно геномной определяли методом сравнения пороговых циклов (2∆Сt) и представляли в относительных единицах (о.е.) по формуле 1:
mtDNA/gDNA = 2Ct gDNA - Ct mtDNA,
где Ct gDNA – значение порогового цикла амплификации геномной ДНК; Ct mtDNA – значение порогового цикла амплификации мтДНК. TaqMan-пробы для фрагментов митохондриальной и геномной ДНК были помечены разными флуорофорами (FAM и HEX), что позволило проводить реакцию в одной пробирке (мультиплексная ПР) в двух повторах для каждого образца. Для обеспечения «горячего старта» использован парафин. В работе использованы реактивы, олигонуклеотиды и TaqMan-пробы и детектирующие амплификаторы «ДТпрайм» (ООО «ДНК-Технология», Россия). Режим амплификации: 80 °С в течение 1 минуты, инкубирование при 95 °С в течение 1 минуты, а затем 50 циклов: 94°С в течение 15 с и 64 °С в течение 20 с с измерением уровня флуоресценции на каждом цикле.
Проведена оценка копийности тотальной мтДНК (mtDNAtotal) в эякуляте, мтДНК, лишенной делеций (mtDNAdel-), а также определено соотношение mtDNAtotal/mtDNAdel-, большее значение которого свидетельствовало об увеличении содержания делеций мтДНК.
Статистическая обработка данных выполнена с использованием программы IPM SРSS Statistics, версия 22. Оценка вида распределения данных проводилась с использованием теста Колмогорова–Смирнова. Поскольку в данном исследовании данные имели распределение, отличное от нормального, определяли медиану и квартили (Ме (Q1;Q3)). Для оценки различий в группах применяли методы непараметрической статистики (тест Манна–Уитни). Для сравнения категориальных данных, а также для оценки значимых различий между ними использовали тест χ2. Зависимые данные оценивались с помощью коэффициента корреляции Пирсона. Различия считали статистически значимыми при уровне достоверности p<0,05.
Результаты
Медиана возраста ВИЧ-инфицированных мужчин составила 37 лет (33;39), «стаж» заболевания – 5 лет (2;11). Диагноз ВИЧ-инфекции был поставлен в возрасте 29 лет (26;32), преобладала 3 субклиническая стадия заболевания (64,9%). Пациенты со стадиями заболевания 4а (23,4%), 4б (4,3%) и 4в (7,5%) находились в фазе ремиссии не менее 6 месяцев. Комбинированную АРВТ получали 79 из 94 пациентов (84%), из них 38 (48,1%) принимали препараты группы НИОТ в сочетании с ненуклеотидными ингибиторами обратной транскриптазы, 35 (44,3%) – НИОТ+ингибиторы протеазы, 5 (6,3%) пациентов – НИОТ+ингибиторы интегразы и 1 (1,3%) пациент – три препарата группы НИОТ. Медиана продолжительности приема препаратов составила 2 года (1;5). Иммунологический статус ВИЧ-серопозитивных пациентов представлен в таблице 1.
У 36 из 94 (38,2%) ВИЧ-серопозитивных мужчин выявлен сопутствующий гепатит С. Далее эти пациенты были исключены из исследования.
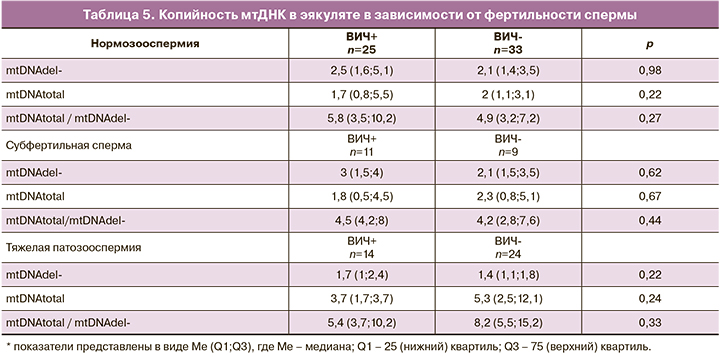
Анализ копийности мтДНК в эякуляте показал, что количество мтДНК, лишенной делеций (1,9 (0,9;5,9) и 2,4 (1,9;5,6) о.е.; р=0,54), уровень тотальной мтДНК (5,4 (3,7;9,8) и 5,5 (3,5;8,2) о.е.; р=0,62) и соотношение mtDNAtotal /mtDNAdel- (2,4 (1,5;3,9) и 1,9 (1,3 и 3,0); р=0,09) были сопоставимы между группами (табл. 2).

Далее образцы спермы были разделены на нормозооспермию, субфертильную сперму и тяжелую патозооспермию (табл. 3).
В группе ВИЧ-инфицированных мужчин нормозооспермия встречалась в 56,9% случаев, субфертильная сперма – в 19%, выраженная патология спермы – в 24,1%; в контрольной группе – в 65,6%, 9,4% и 25% соответственно (р=0,22). Статистически значимых различий в структуре патозооспермии выявлено не было, в обеих группах преобладала тератозооспермия (20,7% и 16,7%; р=0,56) (табл. 4).
Как видно из данных, представленных в таблице 5, содержание тотальной мтДНК, мтДНК, лишенной делеций, и их соотношение были сопоставимы между группами.
При оценке силы взаимосвязи в группе тяжелой патологии спермы была обнаружена отрицательная корреляция между длительностью АРВТ и копийностью тотальной мтДНК (r=-0,627; р=0,01), а также длительностью АРВТ и уровнем мтДНК, лишенной делеций (r=-0,542; р=0,04). Выраженная отрицательная корреляция была выявлена между уровнем CD4+ и соотношением mtDNAtotal/mtDNAdel- (r=-0,629; р=0,03).
Обсуждение
Возможность самостоятельного зачатия у ВИЧ-инфицированных мужчин, принимающих АРВТ, обосновывает необходимость изучения особенностей фертильности в данной группе пациентов. Однако большинство исследований свидетельствует о снижении способности к зачатию у мужчин с ВИЧ-инфекцией [2, 4]. Обсуждается роль как самого вируса, так и АРВТ в генезе нарушений репродуктивной функции ВИЧ-инфицированных пациентов. Следует также учитывать, что у ВИЧ-позитивных пациентов часто имеется ряд других факторов, негативно влияющих на фертильность, таких как депрессия, тревога, употребление психотропных препаратов, воспалительные заболевания половых органов, заболевания, передающиеся половым путем. При этом АРВТ может вызывать серьезные побочные эффекты, некоторые из которых опосредованы негативным воздействием препаратов на митохондрии. Наибольшее влияние на митохондрии оказывают препараты группы НИОТ, которые могут отрицательно влиять на количество копий мтДНК, главным образом за счет подавления фермента репликации мтДНК – гамма-полимеразы, вызывая истощение мтДНК [13]. В связи с этим мы провели оценку тотальной мтДНК, мтДНК, лишенной делеций, и их соотношения у ВИЧ-инфицированных мужчин, принимающих АРВТ, по сравнению ВИЧ-серонегативными пациентами. Ограничением данного исследования явилась невозможность оценить содержание мтДНК в сперме ВИЧ-инфицированных мужчин без АРВТ.
В нашу работу включены мужчины в возрасте 37 лет (33;39) с небольшим «стажем» заболевания (5 лет (2;11)) и недлительной АРВТ – 2 года (1;5). При анализе спермограммы было показано, что более чем у половины ВИЧ-инфицированных мужчин (56,9%) наблюдалась нормозооспермия, субфертильная сперма и тяжелая патозооспермия встречались в 19% и 24,1% случаев соответственно. Полученные результаты согласуются с данными литературы. В ряде исследований также не было выявлено никаких существенных различий в образцах спермы ВИЧ-положительных и ВИЧ-отрицательных мужчин [15, 16], за исключением тех случаев, когда резко ухудшалось общее состояние пациентов по причине прогрессирующей иммуносупрессии [17]. В данной работе у всех мужчин фиксировалась неопределяемая вирусная нагрузка в крови, уровень CD4+ лимфоцитов (535 (383–679)) свидетельствовал об относительно «благополучном» состоянии иммунной системы у большинства, однако следует отметить низкий иммунорегуляторный индекс (Ме 0,56) и низкие относительные показатели CD4+ лимфоцитов (25,5 (20,2–31)).
В структуре патологии спермы преобладала тератозооспермия (20,7%). Снижение процента морфологически нормальных сперматозоидов было показано и в исследованиях Dondero et al. (1996), Muller et al. (1998), Nicopoullos et al. (2004), Bujan et al. (2007) [2, 4, 18, 19]. В работе Dulioust E. et al. (2002), напротив, показано, что у пациентов с ВИЧ-инфекцией процент морфологически нормальных сперматозоидов сопоставим с ВИЧ-серонегативным контролем [20].
Анализ копийности мтДНК в эякуляте показал, что у ВИЧ-инфицированных пациентов количество мтДНК, лишенной делеций (1,9 (0,9;5,9) и 2,4 (1,9;5,6) о.е.; р=0,54), уровень тотальной мтДНК (5,4 (3,7;9,8) и 5,5 (3,5;8,2) о.е.; р=0,62) и соотношение mtDNAtotal/mtDNAdel- (2,4 (1,5;3,9) и 1,9 (1,3;3,0); р=0,09) были сопоставимы с ВИЧ-серонегативным контролем. Возможно, отсутствие изменений в содержании мтДНК у ВИЧ- инфицированных связано с тем, что в данное исследование включены пациенты с недлительным приемом препаратов (2 года (1;5)). Поскольку в исследование были включены пациенты с различными показателями спермограммы, мы разделили образцы спермы на нормозооспермию, субфертильную сперму и тяжелую патологию спермы. Различий в содержании тотальной мтДНК и мтДНК, лишенной делеций, между группами также не было выявлено. Однако при тяжелой патозооспермии у мужчин с ВИЧ-инфекцией было показано, что чем длительнее АРВТ, тем меньше содержание тотальной мтДНК (r=-0,627; р=0,01) и мтДНК, лишенной делеций (r=-0,542; р=0,04). Более того, чем ниже уровень CD4+ лимфоцитов в крови, который отражает состояние иммунной системы, тем больше делеций мтДНК в сперме, определяемых по соотношением mtDNAtotal/mtDNAdel- (r=-0,629; р=0,03). Другими словами, чем длительнее прием АРВТ, тем меньше количество митохондрий в сперматозоидах, а по мере развития патологического процесса и снижения содержания CD4+ возрастает mtDNAtotal/mtDNAdel-, свидетельствующее о появлении мтДНК с делециями. Wu H. et al. (2019) полагают, что увеличение количества делеций мтДНК в сперматозоидах является маркером патозооспермии и отражает негативные изменения показателей спермы [21]. Таким образом, и в нашем исследовании снижение тотальной мтДНК и увеличение делеций мтДНК отражало именно выраженные изменения в сперме у ВИЧ-инфицированных мужчин, длительно принимающих АРВТ.
Известно, что у мтДНК, в отличие от геномной, отсутствуют защитные гистоны и богатая антиоксидантами цитоплазма [22], которые способствуют репарации ДНК, что делает мтДНК более уязвимой для делеций и повреждений [23]. Препараты АРВТ могут ингибировать репарацию дефектов, возникающих в структуре мтДНК, тем самым приводя к повышению количества копий мтДНК и mtDNAdel+ [24]. Также препараты АРВТ способствуют образованию АФК и увеличивают перекисное окисление липидов, приводя к развитию окислительного стресса и повреждению хроматина сперматозоидов и сперматогенеза, что, в свою очередь, приводит к повышению mtDNAdel+ и развитию митохондриальной дисфункции в сперматозоидах [9]. В литературе представлены противоречивые данные. Так, исследования Diehl S. et al. (2003) свидетельствуют об отсутствии различий в содержании мтДНК между пациентами с ВИЧ-инфекцией, получающими и не получающими АРВТ по сравнению с ВИЧ-отрицательными мужчинами [25]. В исследовании White D.J. et al. (2010), напротив, было продемонстрировано, что у пациентов, длительно принимающих АРВТ, определяются делеции в мтДНК сперматозоидов, в отличие от пациентов с ВИЧ, никогда не получавших терапию [26].
Заключение
В данном исследовании не было выявлено статистически значимых различий в копийности мтДНК в сперматозоидах у мужчин с ВИЧ-инфекцией по сравнению с контрольной группой при нормозооспермии, а также в случае субфертильных показателей спермы и тяжелой патозооспермии. Однако при выраженной патологии спермы уровни тотальной мтДНК и мтДНК, лишенной делеций, в сперме ВИЧ-инфицированных имели обратную зависимость от длительности АРВТ, а содержание мтДНК с делециями отрицательно коррелировало с состоянием иммунной системы пациентов. Таким образом, поскольку у ВИЧ-инфицированных больных предполагается пожизненное использование АРВТ, после достижения неопределяемой вирусной нагрузки в крови целесообразно рекомендовать проведение ВРТ и/или криоконсервацию спермы.



