Внутриутробная гипоксия и асфиксия новорожденных остаются ведущими причинами смертности и инвалидизации доношенных детей [1]. По данным ВОЗ за 2017 г., асфиксия занимает 3-е место среди основных причин смерти новорожденных. В России, согласно исследованиям, проведенным Федеральной службой государственной статистики в 2017 г., младенческая смертность от внутриутробной гипоксии и асфиксии в родах составила 2,2 на 10 тысяч родившихся живыми. 30% судебных исков в акушерстве связано с данным осложнением. По результатам многочисленных исследований, внутриутробная гипоксия и асфиксия в родах, как факторы, лежащие в основе ишемии мозга и гипоксемии, являются основной причиной гипоксически-ишемической энцефалопатии (ГИЭ) [2, 3].
Объективные данные о частоте ГИЭ в зависимости от географических и медико-социальных факторов можно было бы получить только при наличии единых критериев диагностики, что является проблемой в настоящее время. По данным литературы, до сих пор не решен вопрос о различии ГИЭ и неонатальной энцефалопатии. В связи с этим диагностические критерии, разработанные различными неврологическими и неонатологическими школами, отличаются, что влияет на результаты, полученные при изучении эпидемиологии данного патологического состояния [4, 5].
За последние годы наметилась выраженная тенденция к снижению заболеваемости ГИЭ, что связано с увеличением внимания к профилактике состояний, способствующих развитию внутриутробной гипоксии и асфиксии в родах, совершенствованием методов диагностики состояния плода и методов родоразрешения, а также с улучшением качества оказания помощи новорожденным на этапе реанимации и интенсивной терапии.
Для внедрения и повышения эффективности методов лечения ГИЭ первостепенное значение имеют патофизиологические аспекты гипоксии плода. Клинические и экспериментальные исследования показали [5], что в результате гипоксии гибель нейронов наступает не одномоментно. Эпизод гипоксии является лишь пусковым механизмом, который приводит к нарушению мозгового кровотока (первичное повреждение и первичный энергетический дефицит), после чего запускается патофизиологический каскад, связанный с реперфузией мозговой ткани и развитием реперфузионных вторичных повреждений.
В исследованиях [3, 6, 7] доказано, что изменения в центральной нервной системе (ЦНС) при гипоксии происходят в 2 фазы. 1 фаза – латентная, во время которой в результате действия эпизода гипоксии восполнение энергии осуществляется путем увеличения мозгового кровотока и анаэробного гликолиза, что приводит к расходу фосфокреатинина, недостатку АТФ-азных механизмов (вторичный энергетический дефицит), нарушению Na+/K+-насоса, накоплению Na+ и Ca2+ в интрацеллюлярном пространстве и внутри ядра клетки. Внутриядерное накопление Ca2+ способствует активации перекисного окисления липидов клеточных и внеклеточных мембран с образованием токсичных свободных радикалов. Накопление Ca2+ внутриядерно способствует также активации проапоптотического фактора («рецептор смерти» DR5), приводящего к гибели нейронов. Латентный период продолжается не менее 6 ч. Его можно считать «терапевтическим окном». Затем наступает 2 фаза − отсроченная нейрональная гибель [7], обусловленная митохондриальной недостаточностью и дополнительным повышением количества свободных радикалов, способствующих некротическим процессам и нейрональной смерти [3, 7].
Представленный патофизиологический каскад, протекающий в 2 фазы, позволяет разрабатывать методы нейропротекторной терапии, используя которые до развития вторичного энергетического дефицита (во время «терапевтического окна»), возможно снизить тяжесть поражения нервных клеток [8]. В качестве одного из таких методов рассматривается контролируемая гипотермия.
В России использование краниоцеребральной гипотермии (КЦГ) в неонатологии впервые предложено Г.М. Савельевой и соавт. в 1973 г.; в дальнейшем Н.Н. Расстригин поддержал эти начинания. Были получены данные об эффективности лечения гипоксически-ишемических поражений ЦНС. Однако впоследствии наладить производство необходимой для КЦГ аппаратуры не удалось, что не позволило использовать методику в широкой практике [9]. Американская ассоциация кардиологии (AHA) и Международный комитет по связям в области реанимации (ILCOR) санкционировали использование лечебной гипотермии интраоперационно после остановки сердца лишь в 2003 г.
В основе положительного влияния гипотермии на организм новорожденного лежат следующие нейропротективные механизмы: уменьшение повреждающего действия свободных радикалов на нейроны, ингибирование активности апоптоза, снижение воспаления, подавление экспрессии провоспалительных цитокинов, супрессия активации микроглии и астроциоза, создание условий для эндогенной репарации клеток [10, 11].
Результаты крупных рандомизированных контролируемых исследований показали, что терапевтическая гипотермия, как локальная, так и тотальная, снижает показатели смертности и инвалидизации детей после энцефалопатии [12].
Основополагающим для использования КЦГ является тот факт, что головной мозг новорожденного продуцирует 70% общего тепла тела; при этом тотальное охлаждение может оказаться физиологически вредным для больного новорожденного. Как считали Battin M.R. et al., для сведения к минимуму неблагоприятных последствий системного охлаждения следует охлаждать головной мозг, а не все тело [13]. Однако моделирование охлаждения головы новорожденного, проведенное G.M. Van Leeuwen в 2000 г. [14] для изучения распределения температуры, показало, что единственная ситуация, при которой достигается значительное снижение температуры головного мозга, это охлаждение всего тела до температуры 34°C. Указанное свидетельствует о том, что с целью полноценного охлаждения всего головного мозга необходимо снижение общей температуры. Тотальная гипотермия (ТГ) выполняет это условие и обеспечивает достижение одинаковой температуры тела и головного мозга. В Кокрановском систематическом обзоре 2013 г. было показано, что применение КЦГ у детей после перенесенной гипоксии не привело к значимому снижению задержки психомоторного развития, в то время как использование ТГ продемонстрировало значительное улучшение отдаленных исходов в отношении указанной патологии. При этом были выявлены статистически значимые положительные результаты в отношении профилактики и предотвращения задержки умственного развития после использования обеих методик гипотермии по сравнению со стандартными методами лечения [15].
В связи с недостаточностью отражения в литературе методов терапевтической гипотермии, целью нашего исследования явилось сравнение эффективности различных методов контролируемой гипотермии в комплексной терапии ГИЭ у детей, родившихся в асфиксии.
Материалы и методы
Проведен ретроспективный анализ 73 историй родов и историй развития новорожденных, родившихся в асфиксии в период с 2013 по 2017 гг. В комплексной терапии всех детей применялась методика контролируемой гипотермии. В зависимости от вида используемой гипотермии сформированы 2 группы: I группа − 46 новорожденных после применения КЦГ с использованием аппарата Olympic CoolCap®; II группа – 27 новорожденных после ТГ аппаратом CritiCool®.
Определялся комплекс клинических и лабораторных маркеров: значение pH, лактата, дефицит оснований (BE) в пуповинной крови, неврологические нарушения, степень полиорганной недостаточности в раннем неонатальном периоде.
Тяжесть асфиксии определялась согласно Международной классификации болезней (МКБ) X пересмотра (Женева, 1989). Асфиксия средней степени (умеренная) устанавливалась при оценке по шкале Апгар 4–7 баллов через 1 минуту после рождения; тяжелая ‒ 0–3 балла через 1 минуту после рождения.
Для оценки степени тяжести ГИЭ использовалась шкала Sarnat Н., Sarnat М. (1976) в модификации Stoll B., Kliegman R. (2004) [16]. Согласно данной классификации, учитывались уровень сознания, мышечный тонус, поза, периостальные рефлексы, миоклонусы, рефлекс Моро, реакция зрачков, наличие судорог, данные электроэнцефалографии (ЭЭГ), длительность течения симптомов ГИЭ.
Критериями включения в исследование были:
- гестационный возраст 36 недель и более;
- масса тела при рождении более 1800 г;
- перенесенная асфиксия умеренной или тяжелой степени;
- возраст новорожденных менее 6 ч от рождения. Критерии исключения:
- гестационный возраст менее 36 недель;
- масса тела при рождении 1800 г и менее;
- возраст новорожденных 6 ч и более от рождения;
- внутричерепные кровоизлияния (по данным нейросонографии);
- пороки развития, несовместимые с жизнью;
- пороки развития, требующие немедленной хирургической коррекции.
Методы лечения новорожденных соответствовали стандарту оказания реанимационных мероприятий в раннем неонатальном периоде ‒ Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 921н «Об утверждении Порядка оказания медицинской помощи по профилю “неонатология”» [17].
Всем новорожденным проводилась первичная реанимация в родильном зале, а также последовательная оценка по группам критериев «A», «B» и «C» (табл. 1) c целью выявления показаний для применения лечебной гипотермии. При выявлении хотя бы одного критерия из группы переходили к оценке по критериям из следующей группы. Решение о проведении терапевтической гипотермии принималось в случае выявления хотя бы одного критерия из группы «А» плюс хотя бы один критерий из группы «В» плюс хотя бы один критерий из группы «С». При наличии нескольких признаков, входящих в группы «А» и «В», критерии из группы «С» возможно не учитывать. В нашем исследовании этому соответствовали 100% детей (см. табл. 1).

Изучение экспериментальной модели асфиксии на животных K.H. Polderman показало, что начало охлаждения до 1,5 ч от момента воздействия гипоксии снижает количество погибших нервных клеток на 70%; при старте гипотермии до 5,5 ч количество погибших нервных клеток снижается на 50%; при начале после 6 ч оно не является статистически значимым [18]. В нашем исследовании в группе с применением КЦГ процедура была начата у 18 (39,1%) новорожденных в течение 1,5 ч жизни, у 25 (54,4%) – от 1,5 до 5 ч; в группе с использованием ТГ – у 6 (22,2%) новорожденных до 1,5 ч жизни и у 21 (77,8%) – от 1,5 до 5 ч жизни.
Процедура КЦГ и ТГ проводилась согласно протоколу, опубликованному Российским обществом неонатологов в «Проекте клинических рекомендаций по проведению терапевтической гипотермии у новорожденных детей» (2016 г.).
В качестве методов контроля проводимой терапии дополнительно к общепринятым методам использовались нейросонография, ЭЭГ, ультразвуковое исследование брюшной полости, рентгенография органов грудной клетки.
Статистический анализ проводился при помощи программного пакета IBM SPSS Statistics 23.0. Для оценки эффективности терапии были рассчитаны относительные риски и 95% доверительные интервалы на основе неврологических результатов детей на I этапе выхаживания на момент окончания терапевтической гипотермии, при выписке со II этапа выхаживания и к году жизни в группе новорожденных с проведением КЦГ, по сравнению с детьми после тотальной ТГ.
Описательная статистика для количественных переменных представлена в формате среднее арифметическое и стандартное отклонение – M (SD).
Нормальность распределения переменной определяли при помощи построения частотных диаграмм и проверяли при помощи критерия Колмогорова–Смирнова.
Различия между несвязанными группами анализировались с помощью критерия хи-квадрат Пирсона, который использовался для сравнения двух относительных качественных показателей, характеризующих частоту определенного признака, имеющего два значения. Статистически значимыми считались данные при p<0,05.
Результаты исследования и обсуждение
Возраст беременных варьировал от 20 до 39 лет в группе с КЦГ и от 22 до 42 лет – в группе ТГ. У половины пациенток в обеих группах он составил более 30 лет. Возраст первородящих колебался от 20 до 37 лет в группе КЦГ, из них 22 (47,8%) были в возрасте старше 30 лет; в группе ТГ – от 22 до 36 лет, старше 30 лет – 3 (11,1%).
Большинство беременных, родивших детей в асфиксии, были первородящими – 33 (76,7%) и 17 (63,0%) в группах КЦГ и ТГ соответственно. Среди повторнородящих в обеих группах превалировали вторые роды.
При анализе причин гипоксии плода были выявлены следующие состояния, представленные в таблице 2, приводящие к асфиксии.
Частота патологического прелиминарного периода в нашем исследовании (в группе КЦГ – 11 (23,0%), ТГ – 7 (25,9%)) выше в 1,5–2,8 раза по сравнению с популяцией (12,0%).
У большинства пациенток (в группе КЦГ – 38 (82,6%), ТГ – 23 (85,2%)) роды были своевременными. Запоздалые роды с рождением детей с признаками перенашивания на 41–42 неделе гестации и аспирацией мекониальными водами отмечались у 8 (17,4%) и 4 (14,8%) соответственно, что в 1,5–2,3 раза чаще, чем в популяции (3,0%).
У 21 (45,7%) и 12 (44,4%) пациенток из групп КЦГ и ТГ соответственно роды велись через естественные родовые пути. У 18 (39,1%) при КЦГ и у 13 (50,0%) при ТГ роды закончились путем операции кесарева сечения в экстренном порядке. Показания к операции в I периоде родов у 16 (88,9%) и 12 (92,3%) пациенток из групп КЦГ и ТГ соответственно: преждевременная отслойка нормально расположенной плаценты, острая гипоксия плода, хроническая гипоксия плода в сочетании со слабостью родовой деятельности, разрыв матки по рубцу после кесарева сечения; во II периоде родов – у 2 (9,1%) пациенток при КЦГ и у 1 (7,7%) – при ТГ: клинически узкий таз, острая гипоксия плода.
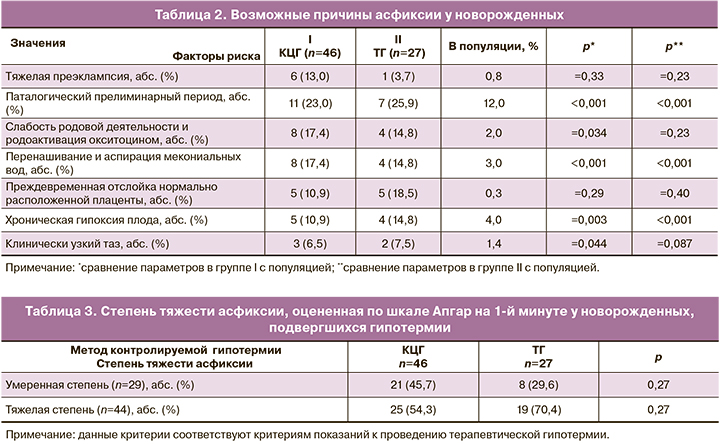
У всех новорожденных диагностирована асфиксия умеренной или тяжелой степени. Частота степени тяжести перенесенной асфиксии статистически значимо не отличалась в группах с КЦГ и ТГ (табл. 3). Хотя следует отметить, что при ТГ асфиксия тяжелой степени наблюдалась у 2/3 пациенток.
Данные, представленные в таблице 4, свидетельствуют об изменении метаболических показателей – маркеров гипоксических поражений в тканях. По количеству пациентов с резкой выраженностью нарушений метаболизма группы статистически значимо не отличались, за исключением частоты детей со значением лактата в пределах 17–22 ммоль/л. При использовании КЦГ число детей с высокими значениями лактата было 10, при ТГ – всего 1.
Комплекс клинических и лабораторных маркеров, представленных в таблицах 4 и 5, свидетельствует о гипоксическом поражении ЦНС и развитии ГИЭ различной степени.
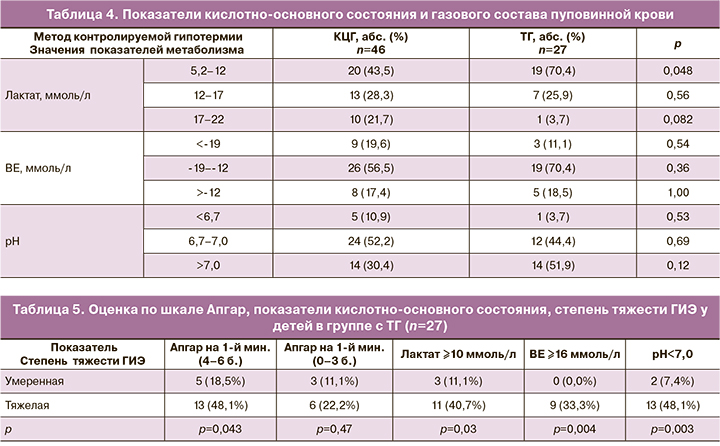
В нашем исследовании ГИЭ умеренной степени тяжести диагностирована у 21 новорожденного (45,7%) из I группы и у 8 (29,6%) – из II; ГИЭ тяжелой степени – у 25 (54,3%) из I группы и у 19 (70,4%) – из II (p=0,27).
Данные, указанные в таблице 5, свидетельствуют о том, что как при умеренной, так и при тяжелой степени ГИЭ у пациентов в группе с ТГ возможны одинаковые значения показателей шкалы Апгар. Полученные нами результаты согласуются с исследованиями Американской коллегии акушеров и гинекологов (ACOG) [19, 20], которые также подтверждают невозможность оценки степени тяжести ГИЭ, основываясь только на оценке по шкале Апгар.
По данным нейросонографии, у большинства (94,5%) новорожденных из обеих групп наблюдались умеренные и тяжелые гипоксически-ишемические изменения головного мозга; только у 4 новорожденных при нейросонографии не было отмечено структурной патологии. При этом ни у одного ребенка не было выявлено внутрижелудочковых кровоизлияний, которые являются противопоказаниями для начала проведения гипотермии.
Наши данные подтверждают результаты исследований Glass H.C. et al. (2019), которые свидетельствовали о том, что наличие судорожного синдрома ассоциировано с ухудшением исходов в отношении психомоторного развития и указывали на то, что судорожный синдром является одним из важных критериев для оценки степени тяжести постгипоксических поражений ЦНС [21–24]. У 62 (86,6%) новорожденных из обеих групп в первые часы жизни наблюдались судорожный синдром или повышенная судорожная готовность (у 39 и 23 детей из I и II групп соответственно). Из них у 33 (84,6%) и у 18 (78,3%) (p=0,77) соответственно выявлена судорожная активность на ЭЭГ, т.е. различия в проявлениях судорожного синдрома до начала терапии были статистически недостоверными.
В течение 6 ч после рождения всем детям была начата процедура контролируемой гипотермии. В течение первых 3 ч после рождения ТГ была проведена статистически значимо чаще (25 новорожденных (92,6%)) по сравнению с КЦГ (32 новорожденных (69,6%)) (p=0,045).
На протяжении периода гипотермии, несмотря на использование медикаментозной седации, судорожная активность сохранялась у всех (n=39) детей на фоне КЦГ и только у 4 из 23 (17,4%) (p<0,001) новорожденных на фоне ТГ. К моменту окончания проведения гипотермии судороги полностью купированы у 11 (28,2%) детей при использовании КЦГ и у большинства – 19 (82,6%) (ОР 0,34; 95% ДИ 0,23–0,60; р<0,001) – при ТГ; у остальных детей (28 – 71,8%) после применения КЦГ к 4–9 суткам жизни; у 3 (11,1%) и 1 (3,7%) ребенка при ТГ – к 4 и 9 суткам соответственно.
Анализируя полученные данные, мы выявили, что использование ТГ в комплексной терапии детей, родившихся в асфиксии, эффективнее КЦГ в отношении сроков купирования судорожного синдрома за счет более быстрого купирования судорог. Кроме того, при проведении ТГ быстрее достигалась положительная динамика в неврологическом статусе детей по сравнению с КЦГ.
Возможно, это связано с тем, что при использовании ТГ (II группа) процедуру гипотермии начинали ранее (в течение 3 ч после рождения), чем при использовании КЦГ (I группа). Данное предположение подтверждается и исследованиями, изучающими зависимость количества неповрежденных нервных клеток от времени начала процедуры гипотермии [12, 25, 26].
Все (n=73) дети с ГИЭ сразу после рождения были переведены на искусственную вентиляцию легких (ИВЛ), средняя продолжительность которой составила 5,97 (2,1) и 5,81 (1,47) суток в I и II группах соответственно (табл. 6). Среднее количество дней, проведенных на ИВЛ, значимо не отличалось между двумя группами (p=0,95). Однако выявлена статистически значимая разница между группами в отношении распределения по количеству дней ИВЛ: при ТГ почти у половины детей (48,1%) количество дней с использованием ИВЛ было менее 5; при КЦГ – только у каждого пятого (21,7%) (p=0,037) (см. табл. 6).

Hamid Aslami et al. (2010) указывали на то, что применение ТГ во время ИВЛ улучшает работу легких и оксигенацию тканей за счет снижения скорости метаболических процессов. Данное утверждение неоднозначно, так как есть другие исследования, которые указывали на отсутствие разницы между ТГ и КЦГ в отношении влияния на восстановление функционирования легочной ткани [27]. Так же, как и K.H. Polderman, мы считаем, что ТГ, в сравнении с КЦГ, обеспечивает лучший контроль за поддержанием достигнутой температуры. Данные результаты согласовываются с гипотезой о том, что снижение скорости метаболизма во время применения ТГ может оказывать положительное влияние на пациентов с повреждением легких (в частности, с аноксической этиологией), у которых снижение минутной вентиляции легких приводит к гиперкапнии [18, 25, 28].
Одним из основных неблагоприятных последствий контролируемой гипотермии в нашем исследовании явилась гипокоагуляция. В связи с данными коагулограммы или клиническими проявлениями геморрагического синдрома, 22 (47,8%) и 15 (55,6%) (p=0,69) новорожденным из I и II групп соответственно вводили от 1 до 3 доз свежезамороженной плазмы. У 12 (26,1%) новорожденных из I группы применялось комплексное введение свежезамороженной плазмы и эритроцитарной массы; во II группе – у 1 (3,7%) (р=0,036) новорожденного.
Все дети из наблюдаемых групп выжили и были переведены на II этап выхаживания: в I группе на 9–12 сутки, во II группе – 6–11 сутки. При выписке со II этапа выхаживания 23 (50,0%) ребенка из группы КЦГ (I группа) на основании данных нейросонографии, ЭЭГ, осмотра невролога и педиатра неврологически здоровы. Во II группе после ТГ 26 (96,3%) детей выписаны с положительной динамикой в неврологическом статусе (ОР 0,53; 95% ДИ 0,49–0,72; р<0,001) и благоприятным исходом к 1 году жизни по заключению невролога. По данным отделения катамнеза, к 1 году у 9 (28,1%) детей из группы КЦГ (I группа) наблюдался неблагоприятный исход в отношении умственного и психомоторного развития (ОР 0,13; 95% ДИ 0,007–0,89; р=0,032).
Следует отметить, что, по данным Azzopardi D. (2014), у детей, перенесших тяжелую и умеренную асфиксию, после стандартного лечения частота детского церебрального паралича составляет 30% [29], что в 2,0–2,5 раза выше, чем при использовании гипотермии. Аналогичные данные были указаны в Кокрановском систематическом обзоре 2013 г. [30].
Заключение
Таким образом, данная работа подтверждает целесообразность использования терапевтической гипотермии в комплексном лечении доношенных детей, родившихся в асфиксии среднетяжелой степени с гипоксически-ишемическим поражением ЦНС. КЦГ и ТГ предотвращают развитие тяжелых неврологических последствий в последующем, что является основанием использования их в практической деятельности. ТГ имеет преимущества перед КЦГ за счет уменьшения периода нахождения детей на ИВЛ, более быстрого купирования судорог и благоприятных исходов детей к году жизни.



