В соответствии с приказом Минздрава России № 572н [1] от 12 ноября 2012 г., регламентирующим порядок и протокол ведения беременных и гинекологических больных на всех этапах оказания медицинской помощи, в рубрику А (обязательный минимум обследования) у больных с воспалительной патологией половых органов (код N70 по МКБ-10), помимо обследования на инфекции, передаваемые половым путем (ИППП), входит микробиологическое исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы. «Отделяемым женских половых органов» могут быть влагалищные и цервикальные выделения, секрет полости матки, а также отделяемое из маточных труб. Наиболее доступным, а потому широко используемым в клинической практике является культуральное исследование материала из влагалища и цервикального канала. Изучение микробного пейзажа влагалища у беременных и женщин с клиническими проявлениями влагалищного дисбиоза проводится с целью определения терапевтической тактики [2] и является одним из главных направлений профилактики репродуктивных нарушений. Однако ведение женщин с острыми воспалительными заболеваниями придатков матки (ОВЗПМ) предполагает назначение антибактериальной терапии до получения бактериологических результатов [3–5]. Распространенность ОВЗПМ, подверженность этому заболеванию именно молодых женщин [5–7] делает актуальным определение достаточного, соответствующего надлежащему качеству медицинской помощи, но не избыточного объема обследования этой категории больных.
Цель исследования: сопоставить результаты культурального исследования условно-патогенной микрофлоры материала из цервикального канала и маточных труб и оценить клиническое значение исследования условно-патогенной флоры цервикального канала у молодых женщин с острыми гнойными воспалениями придатков матки.
Материал и методы исследования
Произведен ретроспективный анализ результатов бактериологического исследования на аэробные и факультативно-анаэробные микроорганизмы у 87 пациенток, госпитализированных в период с 2004 по 2010 гг. в отделение гинекологии ДГКБ № 5 им. Н.Ф. Филатова Санкт-Петербурга с диагнозом «Острый сальпингоофорит». Лечебно-диагностическая лапароскопия предпринималась в соответствии с принятой в настоящее время тактикой, которой предусмотрено проведение санационной хирургической эндоскопической процедуры всем молодым нерожавшим женщинам с подозрением на гнойный характер ОВЗПМ [8–11].
Всем пациенткам при поступлении проведен клинико-лабораторный комплекс обследования, позволивший поставить клинический диагноз и определить тактику ведения, и включающий помимо выявления возбудителей ИППП, исследование на флору и чувствительность к антибиотикам материала из цервикального канала при поступлении и отделяемого из маточных труб во время санационной лапароскопии. Выявление N. gonorrhoeae и T. vaginalis проводилось микроскопией высушенных мазков из цервикального канала после окраски по Граму, а выделение С. trachomatis – методом полимеразной цепной реакции (ПЦР).
Микробиологические исследования материала из цервикального канала и материала из маточных труб проводили в отделе микробиологии лаборатории ДГКБ № 5 им. Н.Ф. Филатова в соответствии с действующим приказом об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений [12], и методическими указаниями по технике сбора и транспортирования биоматериалов в микробиологические лаборатории [13]. Для определения чувствительности к антибиотикам применялся диско-диффузионный метод. При возникновении затруднений при использовании этого метода, чувствительность к антибиотикам исследовали методом серийных разведений на анализаторе «AutoSceptor» (Becton Dickinson, США) и «Vitek-Compact» (Bio-Merieux, Франция). При культуральном выделении из образца материала микроогранизмов разных видов, принимали во внимание те виды, рост которых отмечен как умеренный или обильный.
Для оценки межгрупповых различий применяли t-критерий Стьюдента, χ2-критерий Пирсона и точный метод Фишеpа. Статистически достоверными считали различия, для которых значение вероятности p не превышало 0,05.
Результаты исследования
Средний возраст включенных в исследование больных составил 16,2±0,9 года. Во всех случаях гнойный характер воспаления в маточных трубах у пациенток подтвержден лапароскопически. Гнойный сальпингоофорит, осложненный формированием тубоовариального абсцесса (ТОА), имел место у 32 (36,8%) больных из 87.
Клинический диагноз «цервицит» при поступлении был поставлен 21 (24%) больной. Цервикальный лейкоцитоз при микроскопии цервикального мазка ≥10 в поле зрения (увел. ×1000) имел место у 54 пациенток из 87 (62,1%). Инфекции, вызванные T. vaginalis, выявлены у 3 (3,4%) больных, N. gonorrhoeae – у одной (2,3%), С. trachomatis – у 28 пациенток (32,2%).
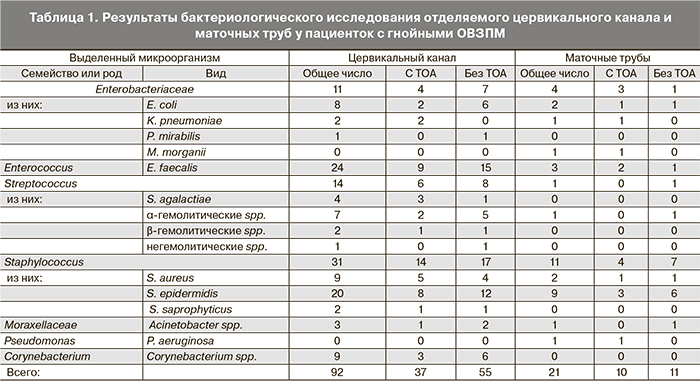
Бактериологические посевы из цервикального канала не дали роста у 4 больных из 87 (4,6%). У остальных 83 больных получены 92 позитивных результата посевов, при этом у 60 пациенток микроорганизм выявлен в монокультуре, а в 23 случаях выявлены ассоциации 2–4 видов микрофлоры (табл. 1). Качественный состав микробного пейзажа цервикального канала был следующим: бактерии семейства Enterobacteriaceae и энтерококки (E. coli, Klebsiella spp., P. mirabilis, M. morganii, E. faecalis) получены в 25 (27,2%) из 92 образцов. Флора, относящаяся к родам Staphylococcus (S. aureus, S. epidermidis, S. saprophyticus) и Streptococcus (S. agalactiae, α-гемолитический, β-гемолитический, негемолитический spp.), выделена почти в половине цервикальных образцов – 45 (48,9%) из 92. Рост микрофлоры рода Corynebacterium spp. выявлен в 9 (9,8%), Acinetobacter spp. – в 3 (3,3%) случаях из 92.
Культуральное исследование отделяемого из маточных труб дало позитивный результат у 19 больных из 87 (21,8%) включенных в исследование, то есть доля негативных результатов посевов составила 78,2%. В материале одной пациентки была ассоциация 3 микроорганизмов, и таким образом был получен 21 позитивный образец. Структура результатов посева материала из маточных труб почти не отличалась от таковой для цервикальных образцов. Так, бактерии семейства Enterobacteriaceae и энтерококки выделены в 7 (33,3%) случаях из 21, Staphylococcus spp. и Streptococcus spp. – в 12 (57,1%). В одном случае получен рост A. baumanii (4,8%), P. aeruginosa выделен также в одном случае (4,8%).
Различий в результатах культуральных исследований материала из цервикального канала у больных с ТОА и без ТОА не выявлено.
Санирующие хирургические вмешательства в 1–2-е сутки предприняты почти у половины пациенток: у 50 (57,5%). На 3–5-е сутки оперированы 21 (24,1%), на 6–11-е сутки – 16 (18,3%) человек из 87. Показанием к отсроченным лапароскопическим вмешательствам была необходимость верификации диагноза и объективной оценки характера воспалительных изменений в придатках матки у пациенток с упорным болевым синдромом, у которых первоначально показания к диагностической и санационной лапароскопии не были поставлены.
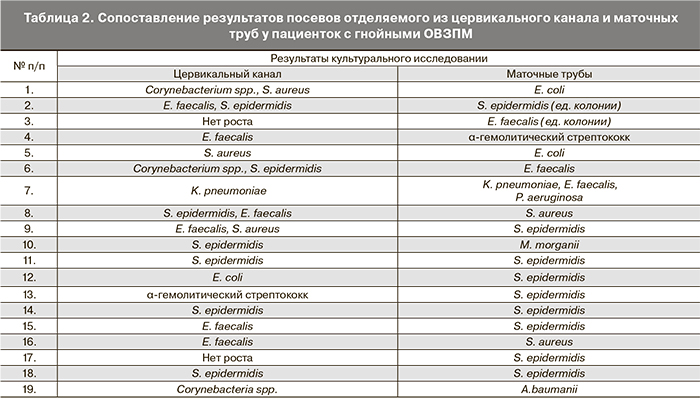
Наиболее важной частью исследования было определение соответствия микрофлоры цервикального канала и маточных труб. Среди 19 больных с позитивными бактериальными посевами из маточных труб соответствие микробных агентов верхних и нижних отделов генитального тракта установлено лишь у 5 пациенток (26,3%) (табл. 2).
Следует отметить, что в 4 (80,0%) из пяти случаев совпадений микрофлоры цервикального канали и маточных труб имел место рост S. epidermidis (образцы № 2, 11, 14, 18) и в одном случае (20,0%) – K. pneumoniaе (образец № 7).
Для выявления возможных факторов, влияющих на результативность посевов отделяемого из маточных труб у обследованных больных, с учетом большой доли негативных результатов посевов, проведен сравнительный анализ групп больных с наличием (группа 1 – 19 пациенток) и отсутствием роста микрофлоры из маточных труб (группа 2 – 68 больных). Длительность дооперационного периода и, соответственно, продолжительность дооперационной терапии антибиотиками в стационаре в группах больных не различалась: в группе 1 – 3,2±2,5 дня, в группе 2 – 2,8±2,2 дней (t1-2=0,64; p>0,05). При изучении анамнестических данных установлено, что за врачебной помощью до госпитализации обращалась почти треть больных, а именно – 26 (29,9%) из 87 пациенток, из них к гинекологам – 14 больных, к педиатрам – 8, к хирургам – 3, к инфекционисту – 1. Этими специалистами на догоспитальном этапе была назначена антибактериальная терапия 15 (57,7%) больным из 26, в том числе 9 (64,2%) из 14 обратившихся к гинекологу, 5 (62,5%) из 8 обратившихся к педиатрам, 1 из 3 (33,3%) консультированных хирургом. Оказалось, что в группе 1 антибактериальную терапию на амбулаторном этапе получала только 1 (5,3%) больная из 19, а в группе 2 – 14 (20,5%) человек из 68. Статистический анализ не доказал достоверности этих различий (χ21-2=1,49; p=0,222; точный метод Фишера: p=0,174), однако невозможно игнорировать выявленную тенденцию.
Обсуждение
Цервикальный канал не является в норме стерильным локусом, в отличие от содержимого плевральной, брюшной, перикардиальной, суставной полостей [14, 15], поэтому само по себе наличие не гонококковых и не хламидийных бактериальных агентов в материале из этого отдела полового тракта не является признаком заболевания. Основными проблемами бактериологического исследования материала из половых путей женщин являются контаминация и получение негативных результатов. В значительной степени контаминация может быть предупреждена соблюдением правил забора материала. Получение негативных, то есть неинформативных для клинициста результатов посева – это более комплексная проблема. Например, в работе C.A. Parker [16] доля негативных результатов бактериальных посевов из цервикального канала у женщин с цервицитом достигала 58%. S. Lurie и соавт. [17]
сравнили в динамике результаты посевов из цервикального канала у женщин с воспалительными заболеваниями органов малого таза (ВЗОМТ) через двадцатилетний интервал: в 1988 и 2008 гг. в одном и том же стационаре. Было установлено отсутствие какой-либо динамики в доле получения негативных результатов этих посевов, которая равнялась 32%. В нашем исследовании число негативных результатов посевов материала из цервикального канала было невысоким (4,6%), в то же время доля негативных результатов материала из маточных труб составила 78,2%, то есть посев был информативен лишь у 21,8% пациенток. Возможную причину получения негативных результатов посевов авторы упомянутых исследований видели в том, что в ряде случаев присутствует флора, для роста которой не создано специфических условий [17–19], особенно это касается условий культивирования анаэробной флоры.
Интерес к микрофлоре влагалища как к «зеркалу» микрофлоры верхних отделов полового тракта в норме и патологии привел к проведению ряда исследований [14–20]. К настоящему времени получены данные о том, что нет причинно-следственной связи между бактериальным вагинозом и инфекциями верхних отделов половых путей [2, 21, 22]. Также показано, что отсутствует специфичность микробного пейзажа цервикального канала при цервиците и ОВЗПМ [6, 14, 16, 17].
Установлено, что доля совпадений результатов бактериологического исследования цервикального канала и полости матки у женщин с хроническим эндометритом, подтвержденным гистероскопически и гистологически, составила лишь 32% [18]. Опыт, накопленный в результате широкого использования лапароскопических методов диагностики и лечения ОВЗПМ, позволил выявить, что доля соответствия результатов цервикальных и трубных культур не превышает 50% [23]. Учитывая приведенные литературные данные, становится понятен результат нашего наблюдения, в котором доля видового совпадения микрофлоры материала из цервикального канала и материала из маточных труб у молодых женщин с гнойными ОВЗПМ составила лишь 26,3%. Столь явные различия в микрофлоре ниже- и вышележащих отделов генитального тракта при восходящих воспалительных процессах находят в различной способности микрооганизмов к выживанию в определенной микроэкологической нише, а также в том, что микробные агенты, в том числе представители сапрофитной микрофлоры, имеют разную степень устойчивости к проводимой или проведенной антибактериальной терапии [14, 17, 18]. Практическим подтверждением такого предположения, с одной стороны, может быть установленный нами факт четырехкратного возрастания доли негативных результатов посевов материала из маточных труб у пациенток, получавших антибактериальную терапию на догоспитальном этапе (20,5 против 5,3%), а с другой – преимущественный высев представителей сапрофитной флоры (80%) среди случаев совпадения результатов посевов из цервикального канала и маточных труб.
Американские и европейские стандарты по ведению женщин с ВЗОМТ не содержат рекомендаций по исследованию условно-патогеннной флоры цервикального канала у этой категории больных [4, 5].
Стандарты микробиологического обследования при ВЗОМТ, принятые в Великобритании, также не включают исследование не относящейся к ИППП цервикальной микрофлоры. Рекомендовано исследование аспирационного материала маточных труб, абсцессов, брюшной полости [15, 23] и при разработке или коррекции индивидуальной программы антибактериальной терапии у женщин с ВЗОМТ рекомендовано учитывать результаты посева материала только из очага воспаления.
Безусловно, нарушения на преаналитическом этапе микробиологической диагностики, связанные с забором и доставкой материала в лабораторию, которые трудно исключить в работе ургентного стационара, могли внести свой вклад в снижение информативности проводимых культуральных исследований. Но представленные литературные данные, отражающие результаты более фундаментальных работ, показали, что существуют и объективные предпосылки, ограничивающие информативность культуральных исследований условно-патогенной микрофлоры цервикального канала у молодых женщин с ОВЗПМ.
Выводы
- Доля неинформативных культуральных исследований условно-патогенной микрофлоры цервикального канала молодых женщин, подвергнутых санирующим лапароскопическим вмешательствам по поводу ОВЗПМ, составила 4,6%, при исследовании материала из маточных труб – 78,2%. Неинформативные результаты посевов из маточных труб в четыре раза чаще получены у больных, получавших антибактериальную терапию на амбулаторном этапе лечения.
- Совпадение результатов бактериальных посевов из цервикального канала и маточных труб у молодых женщин с гнойными ОВЗПМ имело место лишь в 26,3%.
Заключение
Таким образом, исследование условно-патогенной флоры цервикального канала у молодых женщин с ОВЗПМ не является клинически значимым, поскольку и ранее установлено, что отсутствует достоверная связь между характером микробной флоры влагалища, шейки матки и верхних отделов генитального тракта при ОВЗПМ [2, 6, 15, 17–19, 22, 23]. Тактика ведения молодых женщин с ОВЗПМ не может строиться на учете результатов культуральных исследований материала из цервикального канала. При наличии клинических показаний к проведению санационной лапароскопии существенно бо'льшее клиническое значение имеет исследование характера микробной флоры отделяемого из маточных труб, результат которого и следует учесть при разработке индивидуальной программы антибактериальной терапии.



