Катастрофический антифосфолипидный синдром (КАФС, синдром Рональда Ашерсона) − наиболее тяжелая форма антифосфолипидного синдрома (АФС), которая проявляется множественными тромбозами жизненно важных органов и развитием полиорганной недостаточности на фоне высокого титра антифосфолипидных антител (АФА) [1]. Впервые синдром был открыт как явление в 1992 г. Рональдом Ашерсоном [2]. Хотя КАФС развивается менее чем у 1% пациентов с АФС, это состояние является угрожающим жизни и поэтому требует неотложной терапии. Оптимального лечения КАФС не разработано, и смертность достигает 50% [3].
По инициативе Европейского форума по вопросам АФС под руководством Asherson в 2000 г. был создан международный регистр случаев КАФС, который включает описание клинической картины, лабораторных показателей, тактики лечения. Он постоянно пополняется новыми данными. Свободный доступ к регистру в Интернете по адресу: http://www.med.ub.es/MIMMUN/FORUM/CAPS.НТМ [4]. Периодический анализ данных регистра позволит расширить знания по проблеме КАФС. К настоящему времени зарегистрировано уже 280 случаев КАФС.
Описание клинического наблюдения
Пациентка З., 24 года, поступила в родильный дом с диагнозом: Беременность 27–28 недель. Головное предлежание. Преэклампсия легкой степени тяжести. Отягощенный акушерский анамнез.
Из анамнеза: данная беременность – 2-я. Первая беременность была 4 года назад и завершилась поздним самопроизвольным выкидышем в сроке 25 недель. Первая половина данной беременности протекала без осложнений. Во второй половине появилась пастозность голеней, одутловатость лица.
По данным УЗИ – преждевременное созревание плаценты. В связи с нарастанием отечного синдрома и появления белка в моче 20.03 врачом женской консультации больная была направлена в родильный дом для проведения терапии в условиях стационара.
25.03 в 16 ч в родильный дом больная пришла самостоятельно. При поступлении – состояние средней степени тяжести. АД – 120/80 мм рт. ст. Пульс – 88 уд/мин. Голова не болит. Зрение ясное. Носовое дыхание не затруднено, шевеление плода ощущает. Имелись выраженные отеки передней брюшной стенки, верхних конечностей, нижних конечностей, анасарка. Воды не подтекают. Был выставлен диагноз: Беременность 27 недель. Головное предлежание. Преэклампсия средней степени тяжести. Анасарка. Фетоплацентарная недостаточность, компенсированная форма. Отягощенный акушерский анамнез. Была переведена в отделение патологии беременных для обследования и проведения терапии, направленной на улучшение реологических свойств крови и маточно-плацентарного кровотока в течение 24 ч и решения вопроса об экстренном родоразрешении. В анализах при поступлении – гемоглобин 136 г/л, гематокрит 40, общий белок 78,7 г/л, белок в моче 19,7 г/л.
25.03 в 18 ч произошел приступ эклампсии. АД 190/110 мм рт. ст., пульс 110 уд./мин, частота дыхательных движений (ЧДД) 24/мин. Беременная переведена в палату интенсивной терапии родильного блока, где начата подготовка к экстренному родоразрешению. Проведена инфузинная терапия в объеме 900 мл, из которых – 500 мл свежезамороженная плазма (СЗП). 25.03 в 20 ч начата операция: нижнесрединная лапаротомия. Малое кесарево сечение. Под эндотрахеальным наркозом в 20 ч извлечена глубоко недоношенная девочка, массой 980,0 г, длиной 34 см. Операция прошла без технических трудностей. Кровопотеря 700,0 мл.
Учитывая тяжесть состояния, продолжена искусственная вентиляция легких (ИВЛ) в режиме гипервентиляции. Проведенная терапия: инфузионная, включая СЗП, антиагрегантная, противотромботическая терапия низкомолекулярным гепарином (НМГ), гипотензивная, глюкокортикоиды, седативная, диуретическая, утеротоническая, антибактериальная. За 1-е сутки введено 3600,0 мл, из них белков 1200,0. Мочи получено 2270,0. Осмотрена выездной бригадой реанимации и, учитывая положительную динамику, переведена на самостоятельное дыхание 26.03 в 22:00. За 2-е сутки введено внутривенно 1944,0 мл, из них белков – 1140,0, мочи выделено – 3100,0. Протеинурия – 0,66 г/л. Почасовой диурез – 50–70 мл/ч. АД – 130/80 мм рт. ст.
С 20:00 27.03 – нарастание дыхательной недостаточности (одышка, ЧДД – 26–28 в мин, в легких – влажные хрипы). Глазное дно – отека сетчатки нет, артерии сужены. В связи с начинающимся альвеолярным отеком легких больная вновь переведена на ИВЛ. Продолжена интенсивная комплексная терапия преэклампсии, направленная на устранение метаболических нарушений, водно-электролитных изменений, коррекцию кислотно-щелочного баланса.
28.03 – АД 130/80 мм рт. ст., пульс 80–100 уд./мин, центральное венозное давление 200–250 мм вод. ст., отеки уменьшились, в легких хрипов нет. Проводилась стимуляция кишечника – без эффекта. ЭКГ: неполная блокада левой ножки пучка Гиса, изменения миокарда. 29.03 в связи с крайне тяжелым состоянием, обусловленным тяжелой формой преэклампсии, полиорганной недостаточностью осмотрена выездной бригадой экстренной детоксикации НИИ им. Склифосовского. В связи с развитием дыхательной недостаточности, периферических отеков решено провести ультрафильтрацию с дефицитом жидкости 1,5–2 л. 30.03 состояние сохранялось крайне тяжелое. Диурез – 2555,0 мл, введено 1200,0 мл, из них белков – 100,0 мл.
31.03 (на 5-е сутки), учитывая адекватное самостоятельное дыхание, наличие сознания, стабильных показателей гемодинамики, удовлетворительный диурез, произведена экстубация трахеи. Состояние тяжелое, стабильное, с положительной динамикой. Больная в сознании, контактна, адекватна. Очаговой неврологической симптоматики нет. АД – 120/80 мм рт. ст. пульс – 100 уд. в мин, ЧДД – 18 в мин.
1.04 – состояние стабильное, средней степени тяжести. АД 130/80 мм рт. ст., пульс – 84–90, перистальтика отчетливая, диурез адекватный. В моче – белок – 1,65 г/л, лейкоциты – 5–6, глюкозы нет. Общий анализ крови: гемоглобин 68 г/л, гематокрит – 20, лейкоциты – 13,8, тромбоциты – 156 тыс., СОЭ – 60. Биохимия крови – общий белок – 73 г/л, мочевина – 7,4, глюкоза – 4,4, альбумины – 37,0. Активированное частичное тромбопластиновое время – 27 сек, протромбиновый индекс – 75%, фибриноген – 2,44 г/л.
Был проведен скрининг на АФА: 1) антитела к кардиолипину IgM – положительный, IgG – отрицательный, 2) антитела к фосфатидилсерину – IgM – слабоположительные, IgG – отрицательные, 3) антитела к фосфатидилэтаноламину IgM положительные, IgG – отрицательные, 4) антитела к фосфатидилхолину IgM – резкоположительные, IgG – отрицательные. Циркуляция волчаночного антикоагулянта (ВА) резко положительная. Обследование на антитела к белкам-кофакторам АФА показало следующие результаты:
- антитела к протромбину IgG 56,01 Ед/мл, IgM 13,7 Ед/мл (N<10 Ед/мл);
- антитела к β2-гликопротеину I IgG – 81,1 Ед/мл, IgM 4,5 (N<5 Ед/мл);
- антитела к аннексину V IgG 2,4 Ед/мл, IgM 1,3 Ед/мл (N<5 Ед/мл).
Проведено исследование на генетические формы тромбофилии: мутации в гене протромбина G20210A, мутации MTHFR C677T, мутации FV Leiden обнаружены не были.
На 7-е сутки переведена во 2-е акушерское отделение, где была продолжена терапия НМГ, антибактериальная терапия, терапия препаратами, улучшающими мозговое кровообращение. Диурез положительный. АД 120/80 мм рт. ст. Швы сняты на 9-е сутки, заживление первичным натяжением. Антибиотики отменены на 10-е сутки.
На 17-е сутки больная выписана в удовлетворительном состоянии.
 Анализ данного случая позволяет заключить, что под привычным диагнозом тяжелой формы преэклампсии мог быть КАФС. Очень высокий уровень АФА, антител к β2-гликопротеину I, антител к протромбину, стойкая циркуляция ВА при наличии клинической симптоматики (полиорганная недостаточность на фоне тяжелого течения преэклампсии), гистологическое подтверждение окклюзии сосудов плаценты дают основание предполагать ретроспективно, что у женщины было развитие КАФС. Антикоагулянтная терапия в сочетании с плазмаферезом и детоксикационной терапией оказали благоприятный эффект.
Анализ данного случая позволяет заключить, что под привычным диагнозом тяжелой формы преэклампсии мог быть КАФС. Очень высокий уровень АФА, антител к β2-гликопротеину I, антител к протромбину, стойкая циркуляция ВА при наличии клинической симптоматики (полиорганная недостаточность на фоне тяжелого течения преэклампсии), гистологическое подтверждение окклюзии сосудов плаценты дают основание предполагать ретроспективно, что у женщины было развитие КАФС. Антикоагулянтная терапия в сочетании с плазмаферезом и детоксикационной терапией оказали благоприятный эффект.
В описанном случае КАФС мог быть спровоцирован одновременно несколькими факторами:
- стойкая циркуляция ВА, высокий уровень АФА и антител к β2-гликопротеину I;
- наличие гипергомоцистеинемии, которая способствует развитию тромботических осложнений и утяжеляет течение АФС;
- пациентка относится к группе высокого риска в отношении оперативных вмешательств; даже несмотря на адекватную профилактику с помощью антикоагулянтов, велик риск тромботических осложнений, включая КАФС.
В течение последующих 2 лет больная находилась на антикоагулянтной терапии под нашим пристальным вниманием – клексан в дозе 0,6 мл в течение 2 месяцев с постепенным переходом на варфарин с поддержанием международного нормализованного отношения в пределах 2–3. Варфарин применялся в течение 6 месяцев.
Через 2 года она обратилась с желанием повторной беременности. Учитывая наличие тромбофилии, преэклампсии и эклампсии в анамнезе, начиная с фертильного цикла, женщина получала витамины, низкомолекулярный гепарин в дозе 0,4 мг/сут, аспирин в малых дозах 75 мг/сут., омега-3. Следующая беременность наступила при нормальном уровне АФА и антител к кофакторам АФА, нормальном гормональном фоне и отсутствии вирусной инфекции. С наступлением беременности пациентка в течение 24 недель получала микронизированный прогестерон, показанием к которому стала циркуляция АФА, возможно – антител к хорионическому гонадотропину, и вторичная прогестероновая недостаточность. Беременность протекала без осложнений на фоне применения антикоагулянтной и антиоксидантной терапии под постоянным контролем системы гемостаза на протяжении всей беременности, а также приема препаратов натурального прогестерона. На сроке 39 недель пациентка родоразрешена с помощью операции кесарева сечения. Родился живой доношенный мальчик, весом 3200 г и ростом 51 см. Оценка по шкале Апгар 8/9 баллов.
В настоящее время пациентка находится на постоянной контролируемой терапии варфарином.
Благоприятный исход у описанной выше пациентки стал возможным только благодаря терапии НМГ и детоксикационной терапии. Только антикоагулянты имеют решающее значение в предотвращении смерти больных с КАФС.
Анализ всех случаев КАФС показывает, что лучшие результаты терапии были получены при комбинации антикоагулянтов, кортикостероидов, заместительной терапии СЗП и внутривенного введения иммуноглобулина. Если есть подозрение на КАФС, терапия должна быть начата незамедлительно.
Весьма интересным представляется вопрос о возможной ассоциации различных видов АФА с повышенным риском развития полиорганной недостаточности и худшими исходами у пациентов с различными критическими состояниями. Данный случай демонстрирует роль не только высоких титров АФА в развитии тяжелых осложнений беременности, но и циркуляцию одновременно нескольких видов АФА (triple positivity). Циркуляция нескольких антител одновременно строго ассоциируется с развитием тромбозов и акушерских проблем по сравнению с присутствием лишь одного или двух видов АФА [5].
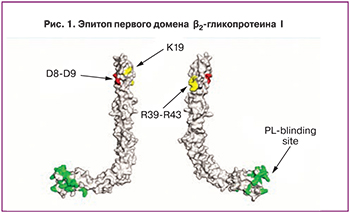
Присутствие одновременно трех видов антител (ВА, антикардиолипиновых антител и антител к β2-гликопротеину I) означает наличие антител, направленных именно против эпитопа Gly40-Arg43 на первом домене β2-гликопротеина I, который, как известно, и ответственен за ВА активность и строго ассоциирован с тромбозами (рис. 1). Лишь ВА-зависимые антитела (будь то антикардиолипиновые, анти-β2-гликопротеиновые или антипротромбиновые) ассоциируются с артериальными и венозными тромбозами [6].
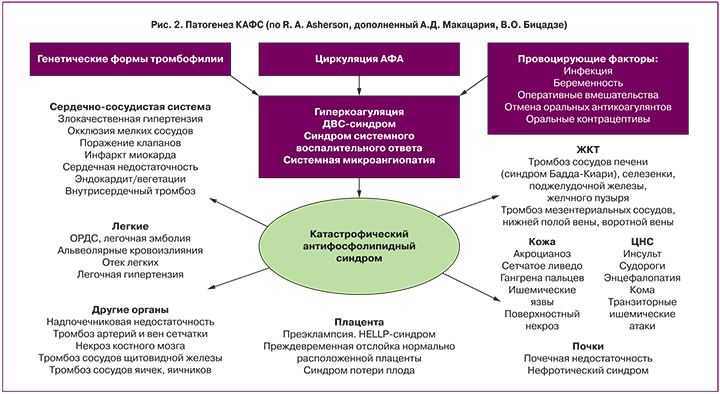
Обобщая современные знания о патогенезе КАФС, можно сделать вывод, что при наличии АФС и генетических форм тромбофилии, нередко под влиянием различных провоцирующих факторов (беременность, инфекция, отмена оральных антикоагулянтов, прием оральных контрацептивов, гормональная стимуляция в протоколе ЭКО) создаются условия для декомпенсации системы гемостаза [7]. Клиническая манифестация АФС в виде тромбозов чаще всего происходит при наличии существующих у данного пациента других факторов риска [8]. Абсолютное число венозных тромбозов во время беременности встречается не ранее, чем в конце II – начале III триместров. Возможно, фоном является физиологическая гиперкоагуляция, наблюдаемая при беременности. Беременность, длительная иммобилизация, хирургическое вмешательство, генетическая тромбофилия чаще являются факторами риска развития венозных тромбозов. Наличие таких традиционных сосудистых факторов риска, как артериальная гипертензия, гиперхолестеринемия, курение, прием оральных контрацептивов, больше ответственно за развитие артериальных тромбозов у АФА-позитивных пациентов. Неизвестно, какие факторы предопределяют, какая же часть артериального и/или венозного русла будет вовлечена в тромбоз. Тем не менее, наличие АФА является серьезным фактором риска тромбозов как обычной, так и необычной, менее распространенной локализации [8]. При этом происходит формирование системного воспалительного ответа и протромботического фенотипа с развитием системной эндотелиальной дисфункции и синдрома диссеминированного внутрисосудистого свертывания (ДВС) [9]. Эти процессы являются патогенетической основой для развития КАФС и полиорганной недостаточности.
Мультидисциплинарный подход и знание проблемы позволили купировать опасные проявления КАФС и наметить патогенетическую профилактику повторных осложнений беременности (рис. 2).
Заключение
АФС является системным процессом, поражающим все органы и ткани организма. Во время беременности в качестве важнейшего органа выступает плацента. Нарушения функции плаценты вследствие эндотелиальной дисфункции, ишемии, микротромбозов являются причиной развития акушерских осложнений: преэклампсии, HELLP-синдрома, отслойки плаценты [10]. Появление акушерских осложнений у пациенток с АФС всегда подозрительно в отношении КАФС. Крайне важным, с нашей точки зрения, является определение АФА у пациенток с такими угрожающими жизни состояниями, как ДВС-синдром, сепсис, тяжелые акушерские осложнения преждевременная отслойка нормально расположенной плаценты, гестозы, HELLP-синдром), так как они могут быть проявлением КАФС [11, 12]. Это поможет своевременно установить диагноз КАФС и незамедлительно начать оптимальную разработанную на сегодняшний день терапию.
На сегодняшний день важной остается проблема диагностики КАФС, которая немыслима без определения АФА. Исходя из классификационных критериев КАФС, вероятная форма КАФС присутствует при преэклампсии, гнойно-септических заболеваниях, хориоамнионите, септическом шоке и критических состояниях в акушерской практике. Поэтому выявление АФА должно быть обязательным у всех беременных с преэклампсией, привычным невынашиванием, начальными проявлениями гнойно-септических заболеваний. Проблема диагностики заключается в том, что вышеназванные состояния возникают внезапно, и для правильной диагностики и понимания патогенеза нет времени для проведения серологических методов исследования. Поэтому было бы крайне желательным определение АФА во всех группах риска заранее. Это имеет огромное клиническое значение, так как преэклампсия, септический шок, тромбозы и другие критические состояния с циркуляцией АФА —это практически различные, с точки зрения патогенеза, прогноза и исхода, состояния, сопровождающиеся микроциркуляторными повреждениями жизненно важных органов, в основе которых лежит микротромбоз. Кроме того, наличие АФА определяет резистентность к терапии и большой риск рецидива. Такие же изменения происходят и в плаценте. Поэтому клиника и морфология безапелляционно указывает на присутствие в данных случаях КАФС. Имеет ли это значение для практики? Безусловно. Это меняет терапию. Это объясняет необходимость профилактики в группах риска, более широкое использование плазмафереза с замещением плазмы [13]. Наконец, это объясняет и высочайший риск летальных исходов при вышеназванных патологических состояниях, несмотря на «героическую», но не патогенетическую терапию.
У всех беременных с АФС и наследственной тромбофилией наиболее целесообразной является ранняя патогенетическая противотромботическая и противовоспалительная терапия с применением НМГ, как во время беременности, так и минимум в течение 6 недель после родов. Указанный подход позволяет осуществить профилактику потерь плода и тромботических осложнений, обеспечить более адекватное развитие плаценты, провести профилактику развития внутриутробной задержки роста плода, а также предотвратить развитие самого грозного осложнения АФС − КАФС. Своевременная диагностика КАФС позволит назначить адекватную терапию с применением НМГ, СЗП, плазмафереза и избежать необоснованных и зачастую неэффективных вмешательств (экстирпация матки и др.).



