Кровотечение является основной причиной материнской смерти во всем мире, на его долю приходится более 30% материнских смертей в Африке и Азии [1]. Кроме того, оно является существенной причиной материнской заболеваемости и может иметь долгосрочные последствия для женского здоровья. Для контроля кровотечения в наиболее сложных случаях может быть выполнена гистерэктомия. Кровотечение у матери возможно в антенатальном, интранатальном и постнатальном периодах. Согласно ВОЗ, послеродовое кровотечение (ПРК) определяется как кровотечение из половых путей после родов в объеме от 500 мл и более. Однако некоторые исследования определяют ПРК как кровопотерю от 1000 мл и более, что представляет большую клиническую значимость [2]. В отсутствие лечения кровотечение у матери вызывает негативные последствия для здоровья, такие как почечная недостаточность и анемия, и может негативно сказаться на психологическом состоянии женщины [3, 4].
Преэклампсия (ПЭ) – состояние, развивающееся при беременности, которое характеризуется гипертензией и протеинурией; при этом гипертензией считается повышение артериального давления более 140/90 мм рт. Ст., после 20-й недели гестации; протеинурия определяется либо как присутствие в суточной моче более 300 мг белка, либо как 3 мг/дл (≥1+ по результату экспресс-пробы с импрегнированным субстратом) белка в двух отдельных образцах мочи [5].
По оценке Всемирной организации здравоохранения (ВОЗ), преэклампсия и эклампсия являются причиной по крайней мере 16% материнских смертей в учреждениях с ограниченными ресурсами, которые испытывают недостаток в квалифицированных специалистах и оборудовании, необходимых для профилактики, выявления и лечении данного состояния [6].
Eskild и Vatten продемонстрировали, что массивное ПРК (>1500 мл) в два раза чаще отмечалось у женщин с преэклампсией, чем у женщин с нормальным артериальным давлением (P<0,005). ПРК >500 мл отмечалось в 1,6 раза чаще (P<0,005) у женщин с преэклампсией, чем у женщин с нормальным артериальным давлением [7].
Мизопростол – оральный аналог простагландина E1, который может назначаться сразу после родов, предлагается в качестве важной альтернативы для профилактики ПРК в учреждениях и родильных домах с ограниченными ресурсами, где окситоцин отсутствует или его использование не представляется возможным. Для введения мизопростола не требуется оборудования для инъекций или квалифицированных специалистов. Мизопростол не нужно охлаждать и поэтому его можно хранить и предоставлять пациенткам там, где нет электричества. Данные факторы способствуют тому, что программы по профилактике ПРК с применением мизопростола, возможно достигнут высокого уровня охвата и использования, в частности, среди женщин, проживающих удаленно от медицинского учреждения [8, 9].
Карбетоцин является синтетическим аналогом окситоцина пролонгированного действия, который может быть назначен в виде однократной инъекции либо внутривенно, либо внутримышечно. У введенного внутривенно карбетоцина период полураспада равен приблизительно 40 мин, то есть в 4–10 больше, чем у окситоцина. При введении внутримышечно карбетоцин достигает максимальной концентрации в плазме менее чем через 30 мин, и его биодоступность составляет 80% [10, 11].
Влияние различных внутривенных и внутримышечных доз карбетоцина на матку после родов было исследовано с помощью токографии у 40 женщин через 24–48 часов после своевременных естественных родов [12]. Однократная внутривенная болюсная инъекция 8–30 мг или однократная внутримышечная инъекция 10–70 мг карбетоцина вызывает тетаническое маточное сокращение в течение 2 мин после введения лекарства [13]. После внутримышечной инъекции матка продолжала сокращаться в среднем в течение 120 мин, а после внутривенной инъекции – в среднем в течение 60 мин [12]. Таким образом, эти данные демонстрируют, что карбетоцин начинает действовать быстро независимо от способа введения, но его действие более продолжительно после внутримышечной инъекции. Оптимальная доза карбетоцина (внутривенно или внутримышечно) составляет 100 мг [13]. Мы провели данное рандомизированное исследование, чтобы сравнить эффективность и безопасность внутривенного применения карбетоцина и сублингвального применения мизопростола женщинам с тяжелой преэклампсией с целью снижения частоты ПРК в третьем периоде родов.
Материал и методы исследования
Мы проводили данное проспективное рандомизированное исследование в отделении акушерства и гинекологии в больнице университета Бенха, г. Бенха, Египет, с января 2013 г. по июль 2015 г. после утверждения протокола исследования локальным этническим комитетом. Перед введением препаратов пациентки, включенные в исследование, подписывали информированное согласие.
Критериями включения были женщины с тяжелой преэклампсией с одноплодной беременностью, сроком гестации больше 28 недель и родами через естественные родовые пути. Преэклампсия считается тяжелой при наличии любого из перечисленных признаков:
- Систолическое артериальное давление постоянно >160 мм рт. ст. или диастолическое артериальное давление >110 мм рт. ст.;
- Белок в моче >5 мг/сутки;
- Олигурия (<400 мл/сутки);
- Содержание тромбоцитов <100,000/мм3;
- HELLP-синдром;
- Церебральные нарушения или нарушения зрения;
- Постоянная сильная боль в эпигастральной области;
- Кровоизлияния в сетчатку глаза, экссудат или папиллоэдема;
- Задержка внутриутробного развития плода;
- Отек легких.
Критерии исключения: HELLP-синдром, эклампсия, отслойка плаценты, многоводие, рубец на матке, хориоамнионит, неправильное положение плода и многоплодная беременность. Состояние всех пациенток было стабильным (без признаков гемодинамических нарушений у матери или дистресса плода), и их последующее лечение соответствовало принятым в нашей стране стандартам и действующим рекомендациям по лечению гипертонических нарушений во время беременности.
При гипертоническом кризисе сначала вводился гидралазин (5 мг внутривенно каждые 15 мин, общая максимальная доза составила 20 мг), в случае его неэффективности назначался нифедипин: от 10 до 20 мг перорально в течение 30 мин (максимум – 50 мг), затем по 10–20 мг каждые 4–6 ч (максимум – 120 мг/день) или лабеталол (20 мг каждые 10 минут, общая максимальная доза – 300 мг). Пациентки не нуждались в дополнительном лечении, которое потребовало бы перевода в блок интенсивной терапии. Состояние пациенток оценивалось каждые 60 минут, и они получали сульфат магния в целях профилактики эклампсии во время беременности, а также в течение как минимум суток после родов.
Все 80 пациенток с тяжелой преэклампсией были обследованы, но лишь 60 были включены в исследование. Пациентки были отобраны случайным образом и разделены на две группы. Группа A (n=30) получила однократную дозу карбетоцина (100 мкг) путем медленного внутривенного струйного введения в течение 1 минуты, в то время как группа B (n=30) получила мизопростол сублингвально (600 мкг, 3 таблетки) после родов.
В третьем периоде родов осуществляли пережатие и пересечение пуповины, ожидание признаков отделения плаценты и рождение последа с помощью контролируемых тракций за пуповину. Документировали продолжительность третьего периода родов. В течение часа пациентка находилась под наблюдением; отмечались любые жалобы, такие как тошнота, рвота, лихорадка, головная боль, озноб, диарея и дрожь. В случае атонии матки (диагностированной по данным физикального исследования и наличию непрерывного ПРК) проводили массаж матки, назначали и отмечали прием дополнительных утеротоников (окситоцин и/или простагландин, на усмотрение лечащего врача). Также фиксировали потребность в ручном отделении плаценты или переливании крови.
При госпитализации и после родов проводились лабораторные исследования (уровня гемоглобина, гематокрита, тромбоцитов), исследования функции почек и печени. Жизненно важные показатели (артериальное давление, частота сердечных сокращений и дыхания) и диурез измерялись каждые 60 минут в течение по крайне мере суток после родов.
Чтобы собрать всю кровь, потерянную после родов, под ягодицы пациентки подкладывали чистую впитывающую простыню с пластиковой вставкой. Простыня менялась необходимое количество раз. Пациентка оставалась лежать на простыне или ее просили носить прокладку в течение следующих 60 минут. В случае обильного кровотечения мы следовали общепринятым рекомендациям по лечению послеродового кровотечения, все назначения документировали. Все простыни и прокладки взвешивали на электронных весах. Поскольку 1 мл крови приблизительно весит 1 г, вес в граммах за вычетом массы сухой ткани считался равным общей кровопотере в мл.
Уровень гемоглобина и гематокрит измеряли при госпитализации и через сутки после родов, а показатели документировали в медицинской карте. Пациенток осматривали на предмет возможных побочных эффектов лекарств, таких как рвота, диарея, дрожь, лихорадка и головная боль.
Всем пациенткам на сутки в мочевой пузырь устанавливали катетер Фолея, каждый час проводили мониторинг диуреза.
Данное исследование было проведено без внешнего источника финансирования. Ни один из авторов не имел каких-либо потенциальных контактов, которые могли бы представлять конфликт интересов.
В качестве первичного исхода мы оценивали ПРК, определяемое как кровопотеря ≥500 мл. Мы проанализировали кровопотерю, а также уровни гемоглобина при выписке. Вторичные исходы включали применение других утеротоников, переливание крови, реакцию на лекарства (такие как головная боль, рвота, боль в животе, зуд, уменьшение вкуса и брадикардия), тяжелые осложнения (такие как судорожные припадки или необходимость перевода в блок интенсивной терапии) или смерть матери.
Для статистической мощности 90% необходимо было, чтобы в каждой группе было по 30 пациенток. Результаты выражались как среднее ± стандартное отклонение, диапазон значений, абсолютные и относительные значения. Данные внутри группы были статистически проанализированы с помощью t-критерия, а анализ данных между группами был проведен с помощью критерия χ2. Статистический анализ проводился с использованием статистической программы SPSS (Версия 10, 2002). Различия оценивались как статистически значимые при p≤0,05.
Результаты исследования
Все 80 женщин с тяжелой преэклампсией подверглись обследованию, но только 60 женщин, отвечавших критериям включения, были включены в исследование. 30 женщин в группе А получили однократную дозу карбетоцина (100 мкг), в виде внутривенной болюсной инъекции в течение 1 минуты, в то врем как группа B (30 женщин) после родов получала мизопростол сублингвально (600 мкг, 3 таблетки).
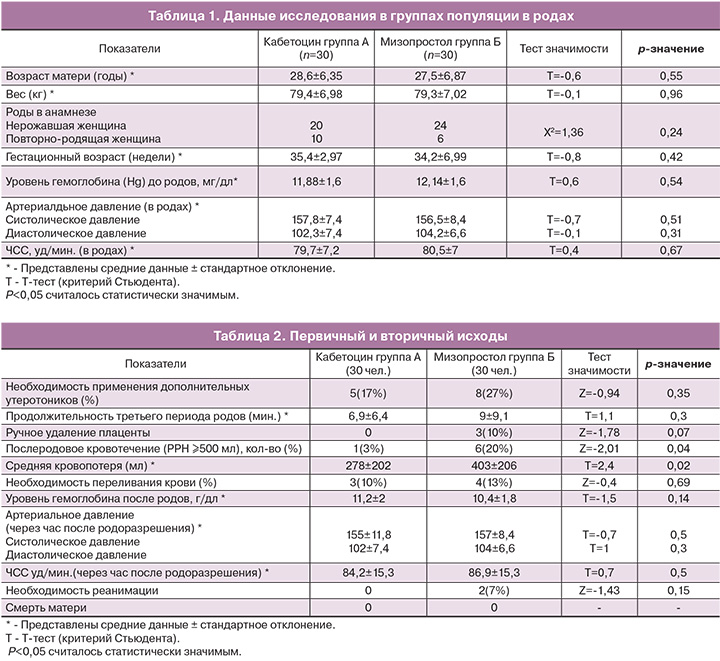
В данном исследовании исходные характеристики двух групп были сходными, так же как и акушерские интранатальные показатели (табл. 1). Уровень гипертензии и частота сердечных сокращений были сходными в обеих группах. До приема препаратов существенных различий между двумя группами не отмечалось.
Частота случаев первичного ПРК в группе, применявшей карбетоцин (A), была значительно ниже (3%), чем в группе, применявшей мизопростол (В) (20%) (P=0,04). Все случаи ПРК были отмечены либо сразу, либо в течение 1 часа после родов, пока женщина еще находилась в родильной палате (табл. 2). Была существенная разница в показателе ожидаемой кровопотери, данный показатель был ниже в группе А (278±202 мл), по сравнению с группой B (403±206 мл) и p=0.02 (табл. 2). Не было различий между группой, принимавшей карбетоцин, и группой, принимавшей мизопростол, в таких показателях, как содержание гемоглобина, уровень артериального давления или частота сердечных сокращений после родов (табл. 2).
Частота переливания крови, дополнительных инъекций утеротоников, затяжного третьего периода (≥30 минут) и ручного отделения плаценты была сходной в обеих группах (табл. 2). Также не было различий в таких показателях, как необходимость перевода в блок интенсивной терапии или смерть матери.
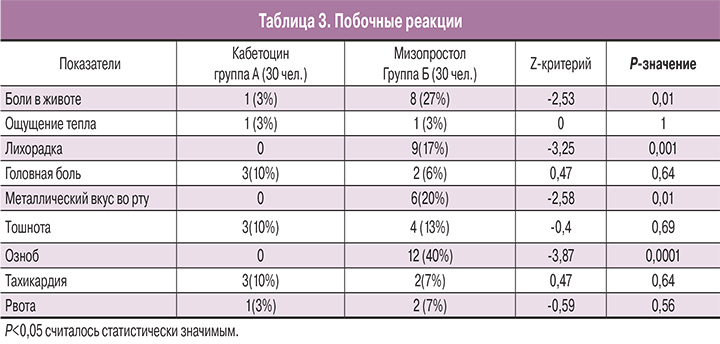
Побочные эффекты представлены в табл. 3. Боль в животе (3% в группе A против 27% в группе B; p=0,01), лихорадка (0% в группе A против 17% в группе B; p=0,001), металлический привкус во рту (0% в группе A против 20% в группе B; p=0,01) и дрожь (0% в группе A против 40% в группе B; p=0,0001) встречались значительно реже в группе, принимавшей карбетоцин. Головная боль, тошнота, тахикардия, рвота и ощущение жара встречались одинаково часто в обеих группах.
В наше исследование мы включали симптомы, о которых сообщали пациентки, только если они не наблюдались до применения препарата и если они появлялись сразу после его приема. Если симптом не исчезал в течение более чем 24 часов, мы делали вывод о малой вероятности его связи с приемом препарата, и симптом не считался побочным эффектом.
Обсуждение
Мы провели данное исследование, чтобы сравнить эффективность и безопасность внутривенного приема карбетоцина и сублингвального приема мизопростола в качестве профилактики первичного ПРК у пациенток с тяжелой преэклампсией. Карбетоцин – недавно разработанный аналог окситоцина пролонгированного действия, частота побочных эффектов которого низкая, а переносимость сравнима с внутривенным окситоцином. Частота побочных эффектов со стороны желудочно-кишечного тракта также была ниже, чем после приема окситоцина с эргометрином. Оказалось, что у карбетоцина меньше побочных эффектов со стороны сердечно-сосудистой системы по сравнению с окситоцином и синтометрином. Несмотря на то, что мизопростол является эффективным утеротоническим препаратом, который применяется в целях профилактики первичного ПРК, он имеет побочные эффекты, такие как тошнота, рвота, гипертензия и спазм коронарной артерии.
Насколько нам известно, это единственное исследование, сравнивающее эффективность и безопасность внутривенного введения карбетоцина и сублингвального применения мизопростола при профилактике первичного ПРК у пациенток с тяжелой преэклампсией.
Результаты многих исследований применения карбетоцина заслуживают внимания, и предполагается, что карбетоцин может стать препаратом первого ряда для профилактики кровотечения после родов через естественные родовые пути среди пациенток высокого риска. Необходимо провести дальнейшие исследования среди пациенток низкого риска, которые рожают через естественные родовые пути, чтобы оценить, превосходит ли карбетоцин традиционные утеротопические препараты, принимаемые большинством беременных женщин. Имеющиеся данные позволяют предположить, что карбетоцин может быть полезен в качестве профилактики ПРК даже у беременных женщин с преэклампсией. Тем не менее, при лечении карбетоцином обязательна подробная оценка истории болезни, а также тщательное мониторирование артериального давления, особенно у пациенток с подозрением на сердечно-сосудистое заболевание в прошлом.
Мы продемонстрировали, что в группе, принимающей карбетоцин, значительно у меньшего числа женщин отмечалось первичное ПРК, чем в группе, принимающей мизопростол (P=0,04). Также существовала значительная разница в объеме кровопотерь; данный показатель был ниже в группе, принимающей карбетоцин, чем в группе, принимающей мизопростол (p=0,02).
Мы отметили, что необходимость дополнительной утеротонической терапии среди женщин, участвующих в нашем исследовании, составила 22% (13/60), в то время как частота ПРК была 12% (7/60). Несоответствие этих двух показателей объясняется тем, что мы, как правило, не ждали, пока кровопотеря превысит 500 мл, чтобы назначить дополнительную утеротоническую терапию. В нашей больнице утеротоники назначаются после постановки диагноза атонии матки.
Полученные нами данные показывают, что частота многих побочных эффектов, таких как боль в животе, лихорадка, металлический привкус во рту и дрожь, была значительно ниже у женщин, принимавших карбетоцин, по сравнению с теми, кто получал мизопростол.
В ходе рандомизированного двойного слепого плацебо-контролируемого исследования, проведенного в Канаде в 2004 году [14], была изучена эффективность карбетоцина в качестве профилактики кровотечения после родов через естественные родовые пути. Исследование проводилось в двух медицинских центрах Канады с участием 160 женщин. В целом, частота утеротонической терапии была ниже среди женщин, принимавших карбетоцин (статистически значимое различие, p<0,025), что было сопоставимо с полученными нами результатами.
Для сравнения 100 мкг однократного внутривенного болюсного введения карбетоцина и однократного внтуривенного болюсного введения окситоцина 5 МЕ после родоразрешения путем кесарева сечения с низким фактором риска Attilakos и соавт. провели двойное слепое рандомизированное контролируемое исследование с участием 377 пациенток. В группе, принимавшей карбетоцин, 33,5% пациенткам потребовалась дополнительная утеротоническая терапия; в группе, принимавшей окситоцин, этот показатель составил 45,5% (p=0,023). Данные результаты похожи на полученные нами, но в нашем исследовании различие не было значимым [15].
В ходе своего рандомизированного контролируемого исследования Nirmala и соавт. изучили истории болезни 1200 женщин с высоким риском ПРК, рожавших через естественные родовые пути, с целью сравнить эффективность 100 мкг карбетоцина, введенного внутримышечно, и введенного внутримышечно синтометрина. Авторы обнаружили значительное снижение средней кровопотери, а также значительно меньшее снижение уровня гемоглобина в группе пациенток, принимавших карбетоцин. Данные результаты аналогичны полученным нами [16].
Эффективность и безопасность карбетоцина были продемонстрированы в нескольких исследованиях. Было установлено, что с целью профилактики интраоперационной кровопотери после родов однократная внутривенная доза 100 мкг карбетоцина так же эффективна, как 16-часовая инфузия окситоцина [17]. В ходе другого исследования пришли к аналогичному выводу, обнаружив, что для контроля интраоперационной кровопотери после рождения последа однократная доза карбетоцина также эффективна, как и 2-часовая инфузия окситоцина [18]. Применение карбетоцина при естественных родах имеет такую же степень безопасности, как и применение окситоцина. Данный препарат дороже, но частота побочных эффектов после его приема ниже. Во время третьего периода родов карбетоцин следует считать хорошей альтернативой традиционным утеротоническим препаратам.
Заключение
Результаты данного исследования свидетельствуют о том, что с целью профилактики ПРК у женщин с тяжелой преэклампсией карбетоцин эффективнее мизопростола, он не вызывает изменений гемодинамики и имеет немногочисленные побочные эффекты. Некоторые кажущиеся побочные эффекты на самом деле могли быть вызваны преэклампсией или приемом других препаратов.
Ограничения исследования
Было два крупных ограничения: первое – малая выборка, второе – невозможность исключить применение дополнительной утеротонической терапии и переливания крови, что, возможно, маскирует снижение уровня гемоглобина.
Благодарности
За помощь в проведении данного исследования авторы хотели бы выразить благодарность ординаторам и младшим преподавателям реанимационного блока отделения акушерства и гинекологии в университетской больнице Бенха, г. Бенха, Египет.



