Грибы рода Candida являются актуальными возбудителями инфекционной патологии человека [1]. Наиболее распространенной формой кандидоза является вульвовагинальный кандидоз: 75% женщин не менее 1 раза в жизни проходят курс лечения от этой патологии, у 5–8% из этих женщин кандидоз приобретает рецидивирующее течение [2]. Патогенез вульвовагинального кандидоза связан с образованием биопленок [3]. Биопленка – система, состоящая из микробных клеток, ассоциированных с внеклеточным матриксом и расположенная на какой-либо поверхности [4]. Внутри биопленок микроорганизмы (бактерии либо микроскопические грибы) при- обретают качественно новые свойства по сравнению с микробами, находящимися в планктонной (небиопленочной) форме. В составе биопленок микробы могут приобретать повышенную устойчивость к эффекторным воздействиям иммунной системы, действию антибиотиков и дезинфектантов [5, 6]. Например, у С. albicans, находящихся в составе биопленок, в 10–32 раза повышается устойчивость к амфотерицину B [7] и в 2–4 раза к флуконазолу [8]. В клинических условиях такая высокая выживаемость биопленочных микробов ведет к рецидивированию и хронизации инфекционного процесса. Конечно, чувствительность биопленок к антибиотикам зависит от многих параметров, к числу которых относятся видовые и штаммовые свойства формирующих биопленку микробов, локализация биопленки и даже особенности местной реакции организма на биопленку [9, 10]. Рутинные методы определения чувствительности к антибиотикам, которые проводятся на небиопленочных микробах, не могут дать адекватную оценку антибиотикорезистентности микробов, находящихся в глубоких слоях биопленок. В связи с вышеизложенным современная медицинская наука настаивает на проведении особого тестирования антимикробных препаратов, которое должно быть направлено на определение их эффективности в отношении биопленочных микробов [11–13].
Цель настоящей работы – оценить антибиоп- леночный и антикандидозный эффект некоторых актуальных антимикотических препаратов (АМП) (композиции «кетоконазол-полиэтиленоксиды», нистатина, флуконазола) в отношении биопленочных клеток грибов рода Candida.
Материал и методы исследования
Для получения биопленок использовали четыре штамма грибов рода Candida, выделенные из клинических источников: C. albicans (штамм 201 и штамм 186), C. glabrata (штамм 302), C. parapsilosis (штамм 187).
Клетки кандид культивировались в 0,5% пептоне (Becton, Dickinson and Company), содержащем 2% глюкозы (рН 7,0). Через 24 ч инкубации (37oC) взвесь клеток разводили тем же бульоном до показателя мутности 0,5 на приборе DensiLaMeter II (ERBA Lachema); 1 мл содержал примерно 108 колониеобразующих единиц (КОЕ) кандид. По 0,35 мл полученной взвеси вносили в лунки 96-луночного планшета (Cellstar, Greiner Bio-one), инкубировали как стационарную культуру в течение 48 ч при 37оС. Факт образования биопленок контролировали, используя лазерную сканирующую конфокальную микроскопию (ЛСК-микроскопию). Через 48 ч инкубации надосадочная жидкость была удалена, на биопленки наслаивали по 0,35 мл 0,5% пептона с 2% глюкозы, содержащего АМП. В качестве АМП использовали: композиция «кетоконазол-полиэтиленоксиды (далее – «кетоконазол-ПЭО»)» (кетоконазол – 6 мкг/мл, ПЭО 1500 – 33 мкг/мл, ПЭО 400 – 3,8 мкг/мл), нистатин (14 ЕД/мл), флуконазол (8 мкг/мл). Дозировки препаратов были выбра- ны исходя из их рекомендуемой терапевтической концентрации в тканях; согласно рекомендациям Национального Комитета Клинических Лабораторных Стандартов (США) потеря жизнеспособности при обработке подобными концентрациями считается критерием «чувствительности» биопленочных кандид к АМП. Тонкодисперсные взвеси АМП готовили при помощи обработки ультразвуком (22 КГц). В качестве контроля использовали
0,5% пептон с 2% глюкозой без АМП. Результаты учитывали через 12, 24 и 48 ч инкубации. При 24- и 48-часовой инкубации каждые 12 ч заменяли питательную среду и вносили новую дозу АМП. После необходимой инкубации (12, 24 или 48 ч) биопленки были дважды отмыты от небиопленочных микробов раствором Хенкса, биопленки были разрушены, биопленочные кандиды были ресуспендированы в 0,4 мл изотонического раствора хлорида натрия. Затем было проанализировано количество жизнеспособных клеток методом подсчета КОЕ на агаре Сабуро в абсолютных единицах (количество КОЕ на 1 биопленку) с последующим пересчетом в относительные показатели – проценты относительно контрольных значений. Каждую пробу в эксперименте выполняли в триплетах, серии экспериментов повторяли трижды. Статистическую обработку результатов проводили с использованием общепринятых статистических методов вычисления средних величин (средней арифметической М) с определением их ошибок (m). Оценка достоверности различий между средними показателями производилась по t-критерию (критерий Стьюдента).
В серии экспериментов была произведена оценка влияния композиции «кетоконазол-ПЭО» на жизнеспособность биопленочных клеток C. albi- cans (штамм 201) при помощи ЛСК-микроскопии на микроскопе TCS SP5 (Leica Microsystems). В этих экспериментах после 48-часовой инкубации с АМП биопленки (методику получения 48-часовых биопленок см. выше) были окрашены специальными красителями (The LIVE/DEAD FungaLight Yeast Viability Kit) по методике, рекомендуемой фирмой-изготовителем (Invitrogen). Флуоресценция красителей отражает жизнеспособность клеток: флуоресценция в зеленом спектре свидетельствует о том, что кандиды жизнеспособны, флуоресценция в красном спектре – о том, что кандиды погибли.
Гифообразование, которое является важнейшим критерием патогенности кандид в организме, моделировали в специальной жидкой питательной среде Spider-medium по методике H. Liu и соавт. [14]. Для этого в среду Spider (3,6 мл в чашке Петри (диаметр 40 мм)) инокулировали по 0,05 мл взвеси клеток C. albicans (показатель мутности 0,5 по DensiLaMeter II), инкубировали 12 ч при 37оС, затем добавляли по 0,05 мл раствора Хенкса с композицией «кетоконазол-ПЭО» (до конечных концентраций кетоконазола – 6 мкг/мл, ПЭО 1500 – 33 мкг/мл, ПЭО 400 – 3,8 мкг/мл). В качестве контроля использовали пробы, куда вместо АМП вносили эквивалентный объем раствора Хенкса. Еще через 12 ч инкубации (37оС) регистрировали гифообразование, используя дифференциально-интерференционный контраст (ДИК) на микроскопе LSM 510 Meta (Zeiss). Для исследования процесса гифообразования на ультраструктурном уровне использовали сканирующий электронный микроскоп JSM 6390А (JEOL, Япония). Фиксацию препарата осуществляли при 4оС в два этапа. Вначале проводили предфиксацию (30 мин) образца в 2,5% растворе (рН 7,2) глутарового альдегида (EM grade, Agar Scientific Inc.) с последующим трехкратным отмыванием дистиллированной водой. Затем препарат фиксировали (30 мин) 0,5% раствором OsO4 с последующим трехкратным отмыванием в дистиллированной воде. После этого препарат криофиксировали в жидком азоте (–196°С) и подвергали низкотемпературной дегидратации (–100°С) в высоком вакууме в течение 24 ч. После лиофилизации высушенный препарат монтировали на держатель электронного микроскопа и на его поверхность методом ионного распыления в аргоновой плазме наносили слой платины (10 нм), используя установку JFC-1600 (JEOL, Япония). Сканирующая электронная микроскопия (СЭМ) проводилась при увеличении от 500 до 3000 раз.
Результаты исследования и обсуждение
Полученные результаты (проценты относительно контроля) суммированы в таблице. При 12-часовом сроке экспозиции биопленок с композицией «кетоконазол-ПЭО» только один из всех изученных штаммов – С. albicans, штамм 186, – демонстрировал достоверное снижение показателей жизнеспособности биопленочных кандид. Биопленка этого штамма содержала почти на четверть меньше жизнеспособных кандид, чем контроль. Количество жизнеспособных кандид в других биопленках на том же сроке не имело достоверных отличий от контроля, хотя показатели проявляли тенденцию к снижению. 12-часовая обработка флуконазолом не влияла на жизнеспособность кандид ни в одной из исследованных биопленок. Нистатин на сроке 12 ч оказывал ингибирующее влияние только на кандиды в биопленках двух штаммов – С. albicans, штамм 186, и С. parapsilosis, штамм 187.
При 24-часовой инкубации ингибирующий эффект композиции «кетоконазол-ПЭО» продолжал развиваться, что приводило к тому, что жизнеспособность биопленочных кандид всех изученных штаммов снижалась до показателей, значительно отличающихся от контроля (таблица). На сроке 24 ч флуконазол обладал достоверным микоцидным эффектом только в отношении двух штаммов – C. albicans, штамм 201, и C. glabrata, штамм 302. Нистатин на тех же сроках проявлял парадоксальный эффект: два штамма (C. albi- cans, штамм 186, и С. parapsilosis, штамм 187) демонстрировали рост процента жизнеспособных клеток по сравнению с показателями 12-часовой инкубации с нистатином, выросшие показатели не отличались от контроля. Два других штамма (C. albicans, штамм 201, и С. glabrata, штамм 302) характеризовались снижением процента жизне- способных клеток до уровня, значительно отличающегося от контроля.
При 48-часовой экспозиции с композицией «кетоконазол-ПЭО» регистрировалось практически полное исчезновение жизнеспособных кандид в биопленках всех изученных штаммов – во всех случаях показатели не отличались от нуля (p>0,05). Показатели выживаемости биопленочных кандид при 48-часовой обработке флуконазолом были значительно ниже, чем значения в контроле. Но при этом в биопленках оставалось от 15,0% (С. parapsilosis, штамм 187) до 29,1% (C. albi- cans, штамм 186) живых кандид. При 48-часовой обработке нистатином регистрировалось достоверное снижение показателей жизнеспособности биопленочных клеток всех изученных штаммов.
Учитывая тот факт, что наибольшей антибиопленочной эффективностью на сроке 48 ч обладала композиция «кетоконазол-ПЭО», в план экспериментов были включены дополнительные методы исследования жизнеспособности кандид в биопленках, которые должны были подтвердить либо опровергнуть микоцидный эффект композиции «кетоконазол-ПЭО». ЛСК-микроскопия показала, что все клетки кандидозных биопленок после 48-часовой инкубации биопленок с композицией «кетоконазол-ПЭО» флуоресцировали в красном спектре. Это свидетельствовало об их нежизнеспособности (см. «Материал и методы»). Подавляющее большинство кандид в контрольных биопленках флуоресцировали в зеленом спектре, то есть были живыми. Рис. 1 (cм. на вклейке) иллюстрирует типовой случай описанного явления. В контрольных пробах без АМП (рис. 1А, см. на вклейке) наблюдается зеленый цвет флуоресценции биопленочных клеток C. albicans, штамм 201 (на рисунке видны лишь единичные погибшие клетки с красной флуоресценцией). В пробах с АМП (рис. 1Б, см. на вклейке) все клетки, входящие в состав биопленки, флуоресцируют в красном спектре, что говорит о полной потере их жизнеспособности.
Интересные результаты были получены при исследовании влияния композиции «кетоконазол-ПЭО» на процесс гифообразования клетками C. albicans. Результаты показали полное угнетение формирования гиф под влиянием композиции «кетоконазол-ПЭО» на стадии формирования ранней (24-часовой) биопленки. Результаты были проиллюстрированы двумя методами – ДИК- микроскопией и СЭМ (рис. 2 см. на вклейке).
При анализе полученных результатов следует учитывать штаммовые и видовые особенности, которыми можно объяснить неодинаковую чувствительность кандид к АМП. Существование подобных различий по спектру антибиотикорезистентности внутри рода Candida наблюдалось ранее [15]. Тем не менее, анализируя полученные результаты, можно сделать некоторые общие выводы об эффективности АМП в наших экспериментах.
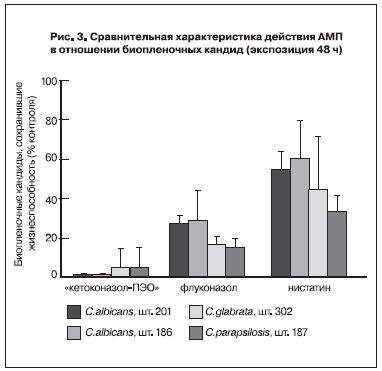
12- и 24-часовые сроки экспозиции кандидозных биопленок ни с одним из испытанных АМП не приводили к полной гибели биопленочных клеток. Наибольшей биопленочной микоцидностью, которая при 48-часовой экспозиции биопленок с АМП приводила к 100% гибели, обладала композиция «кетоконазол-ПЭО» (рис. 3). Вторым по эффективности оказался флуконазол (рис. 3). После инкубации с нистатином в биопленках оставалось не менее трети жизнеспособных бактерий (рис. 3). Одной из причин высокой эффективности композиции «кетоконазол-ПЭО» может быть б?льшая биодоступность этой композиции, которая связана с присутствием полиэтиленоксидов. Хорошо известно, что полиэтиленоксиды могут выполнять роль средств доставки («delivery system»), облегчая проникновение лекарственных веществ через разнообразные биологические барьеры [16]. Полиэтиленоксиды могут изменять физико-химические свойства внеклеточного матрикса в биопленках и облегчать его проницаемость для гидрофобных веществ, к которым принадлежит кетоконазол. Вероятно, в наших экспериментах биопленки, которые рассматриваются как избирательно фильтрующие системы [9], оказались более проницаемы для кетоконазола в комплексе с ПЭО, чем для препаратов, не обладающих свойством проникать в гидрофильный биопленочный матрикс.
Следующий важный вывод касается подавления гифообразования клетками кандид под воздействием «кетоконазола-ПЭО». Подавление гифообразования, которое считается у кандид критерием патогенности [17], позволяет рассматривать композицию «кетоконазол-ПЭО» не только в качестве АМП, но и в качестве препарата с антивирулентными свойствами.
Проведенные исследования иллюстрируют лишь in vitro-эффект изученных АМП. Для корректного подтверждения полученных результатов требуется проведение аналогичной серии экспериментов in vivo, основанных на моделировании кандидозного биопленочного процесса в организме животных.
Заключение
Из исследованных АМП наиболее эффективным антибиопленочным средством является композиция, включающая вещество с антимикотическим действием кетоконазол и комплекс полиэтиленоксидов (ПЭО 1500 и ПЭО 400), который облегчает проникновение лекарственных веществ через различные биологические барьеры.
Для уничтожения биопленочных кандид требуются достаточно длительные (не менее 48 ч) сроки экспозиции биопленок с композицией «кетоконазол-ПЭО».
Композиция «кетоконазол-ПЭО» обладает антивирулентными свойствами – подавляет гифообразование на ранних сроках образования кандидозной биопленки.



