В хирургической практике для пластики грыжевых дефектов стенок брюшной полости и укрепления дна малого таза широко применяют хирургические протезы на основе различных нерезорбируемых полимерных материалов [1–3]. Использование синтетических (прежде всего полипропиленовых) хирургических сеток позволило значительно уменьшить частоту рецидивов по сравнению с пластикой собственными тканями пациента при лечении грыж и пролапса тазовых органов [4, 5]. Однако вместе с этим увеличилась частота послеоперационных mesh-ассоциированных осложнений, которые связаны с воспалительной реакцией тканей на инородное тело и сопровождаются образованием длительно (иногда пожизненно) существующих сером, фиброзом, хроническими болями, деформацией протеза, образованием свищей и выраженным спаечным процессом [6–8]. Повторные операции зачастую сводятся к иссечению части или всего имплантированного синтетического протеза [9].
Появление биологических резорбируемых протезов, представляющих собой децеллюляризированные ткани (дерма кожи, подслизистая основа кишки и др.) животных и человека, позволило надеяться на уменьшение частоты послеоперационных осложнений, особенно в отдаленные сроки. Это предположение основывалось на том, что полная резорбция протеза и замещение его собственными тканями должны устранить возможные причины большинства осложнений (по принципу «нет протеза – нет осложнений»). К сожалению, как показал анализ проведенных клинических испытаний, частота рецидивов и осложнений при пластике биологическими протезами не отличается от операций с применением синтетических протезов [10], а в некоторых исследованиях даже превышает их [11]. Это может быть связано с несколькими причинами. Во-первых, воспалительная реакция на инородное тело в ответ на введение децеллюляризированного материала развивается так же, как и при введении синтетических протезов [12]. Во-вторых, для получения биологического протеза, сравнимого по своим биомеханическим свойствам с синтетическим аналогом, производители вынуждены обеспечивать дополнительные поперечные сшивки коллагена, что значительно уплотняет материал, делает его непористым, затрудняет прорастание собственных тканей и приводит к непрочной краевой интеграции протеза [10]. Кроме того, высокая стоимость биологических протезов ограничивает их применение.
Поиск «идеального материала» для хирургического протезирования идет уже не одно десятилетие: еще в 1959 году были выдвинуты основные требования к такому материалу: неметаллический, синтетический, неабсорбирующий, устойчивый к инфицированию [13]. Анализ результатов клинических испытаний различных протезов для герниопластики и коррекции пролапса органов малого таза позволил сформулировать дополнительные требования:
Полная резорбция материала при отсутствии токсичных для окружающей ткани продуктов деградации;
Пористая структура материала, обеспечивающая прорастание собственных тканей и кровеносных сосудов;
Сохранение заданных биомеханических свойств, прежде всего прочности на разрыв и эластичности, по мере резорбции материала протеза и замещения его собственными тканями;
Высокая биосовместимость.
Анализ медицинской литературы, патентов и технической документации позволил найти несколько вариантов полностью резорбируемых синтетических хирургических протезов. Сетка Vicryl (Ethicon) создана на основе полиглактиновых волокон и резорбируется в ткани в течение 2 месяцев. При этом механическая прочность сетки теряется за 2 недели, поэтому данный сетчатый имплантат применяют только для временной поддержки раны или органа. Сходными свойствами обладает сетка Dexon (American Cyanamid) из полигликолида. Еще два медицинских продукта – сетчатый имплантат Tigr Matrix (Novus Scientific) и нетканый мелкопористый материал Gore Bio-A Hernia Plug (Gore) представляют собой сополимер триметиленкарбоната (33%) и полигликолида (67%). Декларируемый производителями срок резорбции материалов составляет около 6–9 месяцев. В хирургической практике эти имплантаты используют в основном для пластики молочных желез, паховых грыж и фистул кишечника [14–16].
В настоящее время продолжается активный поиск новых полностью резорбируемых синтетических материалов для нужд гинекологии и общей хирургии. На наш взгляд, наиболее перспективными могут оказаться протезы на основе полидиоксанона и полигликолида. Известно, что данные материалы разлагаются in vivo в результате процесса гидролиза (полидиоксанон) или гидролиза и ферментативного воздействия (полигликолид) без образования токсичных продуктов распада и накопления их в тканях [17].
Целью представленного исследования стала оценка физико-химических и медико-биологических свойств сетчатых имплантатов на основе полидиоксанона и полигликолида.
Материал и методы исследования
Экспериментальные образцы сетчатых имплантатов
Образцы сетчатых имплантатов были изготовлены на основе монофиламентных полидиоксаноновых (PDO) или мультифиламентных полигликолидных (PGA) нитей 3-0 (USP). Предельную разрывную нагрузку при растяжении определяли с помощью универсальной испытательной установки H150KU (Tinius Olsen) при скорости перемещения траверсы 5 мм/мин. Пористость сеток определяли методом низкотемпературной адсорбции азота с использованием анализатора удельной поверхности SA 3100 (Beckman Coulter) по стандартной методике. Микротвердость нитей измеряли на атомно-силовом микроскопе ICON (Bruker) до и после гидролитической деструкции в растворе Na2HPO4×2H2O (рН=7,32) в течение 30 сут.
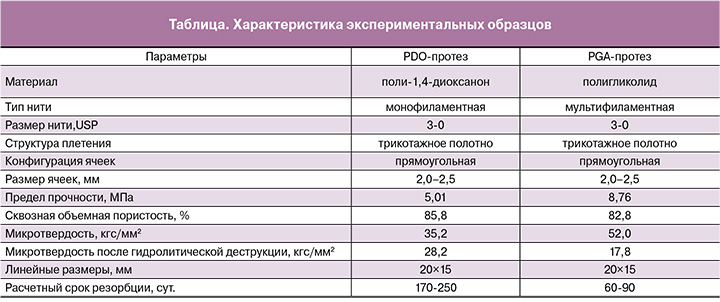
Сканирующая электронная микроскопия
Образцы фиксировали 2,5% глутаровым альдегидом (Sigma-Aldrich), инкубировали в 1% растворе осмия (Sigma-Aldrich) и обезвоживали в восходящих спиртах. После высушивания на воздухе в течение 24 часов образцы покрывали слоем золота с помощью вакуумной напылительной установки (Eiko), приклеивали к столику электропроводящим серебряным клеем Dotite (Fujikura Kasei) и исследовали с помощью СЭМ S-500 (Hitachi).
Оценка цитотоксичности in vitro
Исследование цитотоксических свойств сетчатых имплантатов проводили в соответствии с ГОСТ Р ИСО 10993-5-2009 «Национальный стандарт Российской Федерации. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro». Количественную оценку цитотоксичности проводили с помощью МТТ-теста. Фрагменты PDO или PGA нитей длиной 5 мм помещали в лунки 96-луночного планшета, содержащие по 5 тыс. клеток, и инкубировали 1, 2 и 5 суток. В качестве контрольных использовали лунки, содержащие только клетки. После окончания инкубации образцы удаляли из лунок, в ростовую среду добавляли МТТ (Sigma-Aldrich) до конечной концентрации 1 мг/мл и оставляли при стандартных культуральных условиях на 3 часа. Среду с МТТ удаляли, в лунки для растворения выпавших в осадок кристаллов формазана добавляли по 100 мкл сольвента (ДМСО, ПанЭко) и инкубировали в течение 15 мин в спектрофотометре Multiskan GO (Thermo Scientific) в режиме «встряхивание». Оптическую плотность измеряли при λ=570 нм.
Экспериментальная модель дефекта передней брюшной стенки
При постановке эксперимента руководствовались «Правилами проведения работ с использованием экспериментальных животных» в соответствии с приказами МЗ СССР № 755 и № 701 и «Правилами лабораторной практики в РФ». В исследовании использовали 72 половозрелых самца беспородных крыс массой 250–320 г. Крыс в случайном порядке разделяли на три группы: животным первой группы трансплантировали PDO-протез, второй группы – PGA-протез, третьей группе (группе сравнения) – Permacol (5001-100, Covidien).
Крыс наркотизировали золетилом (20 мг/кг) и рометаром (5 мг/кг). Разрез кожи длиной 4 см делали по срединной линии живота. Острым путем с помощью ножниц иссекали полнослойный (с проникновением в брюшную полость) дефект прямоугольной формы, длиной 2 см и шириной 1,5 см, ровно в середине передней брюшной стенки, ориентируясь на белую линию живота. Затем к краям дефекта подшивали протез, располагая ткани передней брюшной стенки над его краями. Рану ушивали и обрабатывали антисептиком. Послеоперационное обезболивание проводили однократно путем внутримышечного введения баралгина м (10 мг/кг).
Животных выводили из эксперимента на 3, 10, 30 и 60-е сутки после операции путем передозировки эфирного наркоза. Изъятые ткани помещали в 1) 10% забуференный раствор формалина для приготовления парафиновых срезов; 2) жидкий азот для приготовления криосрезов и проведения вестерн-блота; 3) 70° этиловый спирт для проведения биомеханических тестов.
Макроскопическое исследование области трансплантации
Проводили регулярный клинический осмотр операционных ран животных. При выявлении несостоятельности кожных швов, деформации брюшной стенки, эвентрации протеза или органов животное исключали из эксперимента. После эвтаназии и вскрытия брюшной полости тщательно изучали область трансплантации на предмет образования гематом, сером, абсцессов и спаек. Спаечный процесс оценивали по балльной системе [18].
Тензиометрическое исследование
Для тензиометрии использовали универсальную электромеханическую испытательную установку Scg-1kNa (Shimadzu). Образцы помещали в зажимы, устанавливая расстояние между браншами 10 мм. Испытание проводили при скорости 5 мм/мин. Оценивали предел прочности образца.
Гистологическое исследование
После стандартной гистологической проводки материал заливали в парафин, готовили срезы толщиной 5–7 мкм и окрашивали гематоксилином и эозином. Морфометрическое исследование проводили с помощью микроскопа Leica DM 2500 и программного обеспечения ImageScope M (Leica Biosystems) на микрофотографиях препаратов при увеличении ×400. Оценивали следующие параметры:
- площадь нити сетчатого протеза не менее 100 на точку наблюдения;
- толщина соединительнотканной капсулы вокруг нитей протеза не менее 5 измерений на каждую капсулу, не менее 30 капсул на точку наблюдения;
- количество гигантских клеток инородных тел и клеток Пирогова–Лангханса в области контакта протеза и окружающих тканей не менее 100 полей зрения на точку наблюдения.
Иммуногистохимическое исследование
Криосрезы окрашивали с антителами к маркеру макрофагов CD68 (ab125212, Abcam), маркеру М2 активированных макрофагов CD206 (sc-34577, Santa Cruz Biotechnology), коллагену I и III типов (Имтек), гладкомышечному актину альфа (αSMA) (ab5694, Abcam), маркеру скелетных мышц тропонину I (sc-15368, Santa Cruz Biotechnology) в соответствии с рекомендациями производителя. Морфометрическое исследование проводили с помощью микроскопа Leica DM 4000 B и программного обеспечения программного обеспечения LAS AF v.3.1.0 build 8587 (Leica Microsystems) на микрофотографиях препаратов при увеличении ×400. Оценивали доли CD68+ и CD206+ клеток в области трансплантации минимум на 100 полях зрения для каждой точки наблюдения.
Вестерн-блот анализ
Из замороженных на –80°С образцов (n=3 на точку наблюдения) вырезали фрагменты весом 30 мг и получали белковые экстракты с помощью набора MicroRotofor Cell Lysis Kit (Bio-Rad). Перенос белков с геля на PVDF мембрану осуществляли полусухим методом с помощью Trans-Blot Turbo Transfer System (Bio-Rad). Детекцию связавшихся антител к коллагену I и III типов и денситометрический анализ проводили с помощью набора Clarity™ Western ECL (Bio-Rad) на приборе ChemiDoc XRS+ (Bio-Rad).
Статистический анализ
Данные представляли в виде средних значений и стандартных ошибок среднего. Для множественных сравнений в случае нормального распределения данных использовали однофакторный дисперсионный анализ (one-way ANOVA), при отличном от нормального распределении данных использовали ранговый дисперсионный анализ (ANOVA on ranks). Различия считали достоверными при 5% уровне значимости. Данные были проанализированы с помощью программы Sigma Stat 3.5 (Systat Software).
Результаты и обсуждение
Экспериментальные образцы сетчатых имплантатов
Внешний вид экспериментальных образцов представлен на рис. 1А. Характеристики образцов приведены в таблице.
Оценка цитотоксичности in vitro
Результаты МТТ-теста показали отсутствие цитотоксических свойств у исследуемых материалов (рис. 1Б).
Макроскопическое исследование
Все животные удовлетворительно переносили оперативное вмешательство, 100% животных выжило в ранние и отдаленные сроки после операции. Ни у одного животного не было выявлено признаков формирования крупных гематом, сером и абсцессов.
В группах PDO и PGA наблюдали прорастание ячеек сеток собственной соединительной тканью: уже на 10-е сутки отделить материал протеза от окружающих тканей было сложно. Сходную интеграцию наблюдали в группе Permacol только на 30-е сутки, на более ранних сроках интеграция происходила только в области швов.
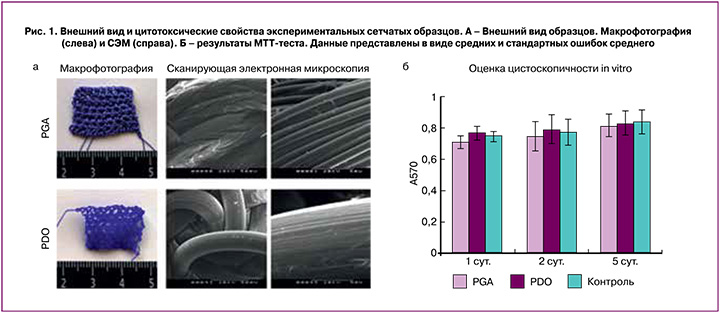
Образование спаек разной степени выраженности наблюдали во всех группах и на всех сроках наблюдения. У ряда животных в спаечный процесс вовлекались не только большой сальник, но и петли тонкого и толстого кишечника. Значимые различия выраженности спаечного процесса наблюдали только между группами PDO и Permacol на всех сроках за исключением 10 суток (рис. 2А).
Определение биомеханических свойств протезов после трансплантации
Ключевым медико-биологическим свойством протезов являются их прочностные характеристики. Тензиометрическое исследование показало, что предел прочности при растяжении полнослойно вырезанного участка передней брюшной стенки крысы равен 1,24±0,26 МПа.
При исследовании полностью резорбируемых протезов особенно важна динамика их биомеханических свойств по мере резорбции протеза и замещения его собственными тканями. Было обнаружено, что предел прочности при растяжении тканей области трансплантации уменьшался во всех группах по мере резорбции материала протезов. Максимальные значения отмечали в группе Permacol на 3-и сутки после трансплантации, что согласуется с результатами других исследователей, подтвердивших высокую механическую прочность натуральных протезов: 15,7 МПа для дермального аллографта [19] и 22,4 МПа для субмукозы [20]. В то же время известно, что после трансплантации механическая прочность децеллюляризированной ткани резко падает [19]. Схожую картину наблюдали и в нашем исследовании: к 30-м суткам показатели сравнивались во всех группах и не отличались от предела прочности нативной ткани (рис. 2А).
Исследование скорости резорбции протеза и замещения его собственными тканями
Скорость резорбции протеза оценивали по динамике изменения площади структурных элементов протеза на поперечных гистологических срезах через 10, 30 и 60 суток. В группе Permacol достоверно оценить скорость резорбции было сложно, так как на поздних сроках определение происхождения коллагеновых волокон при гистологическом исследовании было затруднено. Оба синтетических протеза подвергались резорбции: площадь PGA филаментов к 60-м суткам уменьшалась на 36,5±4,7%, PDO нитей – на 17,4±2,3% (р<0,05). Эти данные коррелируют с падением микротвердости нитей после гидролитической деструкции (таблица). Однако различия могут быть обусловлены не только химической структурой протеза, но и площадью контактирования с тканями реципиента, которая в случае мультифиламентых PGA нитей значительно выше, чем у монофиламентных PDO нитей.
На всех сроках область трансплантации была представлена рыхлой волокнистой соединительной тканью разной степени зрелости с последующим замещением на плотную неоформленную соединительную ткань. Начиная с 10-х суток наблюдения во всех группах можно было четко идентифицировать фиброзную капсулу вокруг элементов протеза. Толщина капсулы отличалась между группами (рис. 2А). Максимальной она была в группе PGA на 10-е и 30-е сутки после трансплантации и уменьшалась только к 60-м суткам, тогда как в группах PDO и Permacol капсула была достоверно тоньше и практически не изменялась в течение всего эксперимента.
Фиброзная капсула имела характерную пространственную организацию коллагеновых волокон, которые были строго ориентированы параллельно поверхности элементов протеза (рис. 2Б). Коллаген I типа начинал синтезироваться уже на 3-и сутки, а на 10-е четко определялся в составе фиброзной капсулы и окружающей соединительной ткани. Толщина коллагеновых волокон и их пучков по мере созревания соединительной ткани увеличивалась.
Степень зрелости и скорость созревания соединительной ткани, ее плотность можно косвенно оценить по соотношению коллагенов I и III типов. Денситометрический анализ результатов вестерн-блота показал, что в группе PDO на 30-е сутки соотношение коллагенов III и I типа было значимо выше, чем в других группах (0,088 против 0,007 и 0,015 соответственно, р<0,05), что свидетельствует о продолжающихся процессах ремоделирования экстрацеллюлярного матрикса.
К 60-м суткам эксперимента в группах PDO и PGA капсула и окружающие ткани были обильно васкуляризированы, в то время как в группе Permacol сосуды располагались только по периферии, в местах с максимальной резорбцией материала (рис. 2Б). Низкая эффективность прорастания сосудами материала Permacol подтверждена и другими исследователями [21]. При этом стенки части формируемых сосудов содержали гладкомышечный актин (рис. 2Б).
На 60-е сутки после трансплантации на некоторых участках наблюдали скопление тропонин I+ клеток (рис. 2Б). Скопления образовывались не в краевой зоне трансплантата, а в толще его, то есть образовывались de novo, возможно, за счет мигрирующих миосателлитных клеток или дифференцировки перицитов соединительной ткани.
Оценка воспалительной реакции на инородное тело
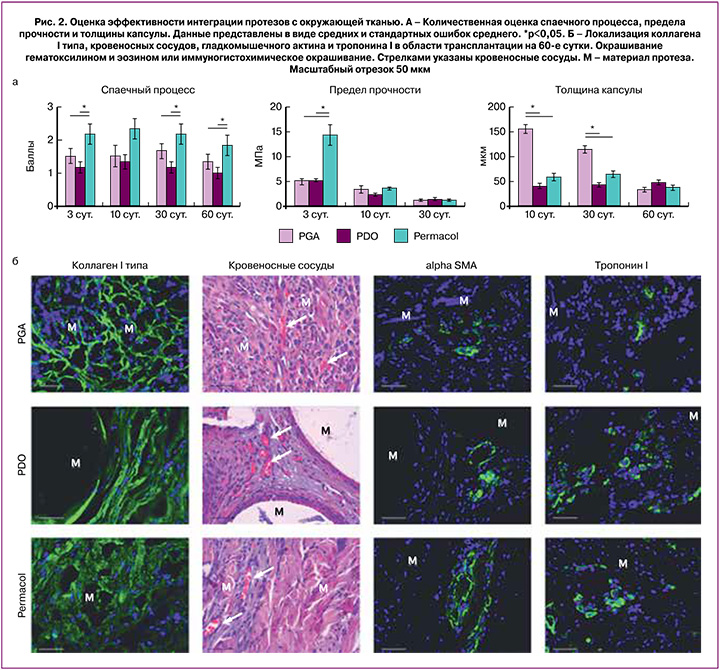
Характерным морфологическим признаком воспалительной реакции на инородное тело является гранулематозное воспаление или образование гранулем инородного тела. В случае трансплантации больших по размеру (относительно размера клеток) инородных тел и при их неопределенных антигенных свойствах происходит активация клеток врожденного иммунитета, прежде всего макрофагов. Последние активно мигрируют к инородному телу, пролиферируют и трансформируются в гигантские клетки инородных тел (многоядерный симпласт с центральным расположением ядер) или клетки Пирогова–Лангханса (с периферическим расположением ядер). Эти клетки наряду с мононуклеарными лейкоцитами могут аккумулироваться вокруг инородного тела с формированием неиммунных (неспецифических) гранулем. В последующем такие гранулемы инкапсулируются и замещаются фиброзной тканью, но в случае сохранения материала инородного тела (нерезорбируемые протезы) такие гранулемы могут сохраняться в течение всей жизни реципиента [22].
При трансплантации любого варианта протеза мы обнаруживали клетки гранулематозного воспаления: гигантские клетки инородных тел и клетки Пирогова–Лангханса (рис. 3). При этом клетки очень редко образовывали скопления (гранулемы), располагались диффузно, преимущественно в составе формирующейся фиброзной капсулы. Количество клеток существенно отличалось между группами (рис. 3). В группе PGA наблюдали множество таких клеток, особенно на 30-е сутки, тогда как в группах PDO и Permacol их количество было незначительным и не менялось в течение всего срока наблюдения. Таким образом, гранулематозное воспаление в области трансплантации было более выраженным в группе PGA.
Для характеристики выраженности воспалительной реакции было подсчитано количество макрофагов общей популяции (CD68+ клеток) и М2-активированных макрофагов (CD206+-клеток). М2-макрофаги обладают повышенной фагоцитарной активностью, а за счет синтеза большого количества факторов роста и противовоспалительных цитокинов активно стимулируют процессы регенерации и ремоделирования тканей и ангиогенез [23].
Макрофагальная инфильтрация CD68+-клетками была выраженной во всех группах, макрофаги локализовались преимущественно в капсуле или на небольшом отдалении от нее (рис. 3). На 10-е сутки количество CD68+-клеток было достоверно больше в группе Permacol, а на 60-е сутки – в группе PGA, при этом макрофаги покрывали практически каждый филамент PGA нити (рис. 3).
М2-макрофаги (CD206+-клетки) локализовались также преимущественно в капсуле вокруг материала протеза, количество их было заметно меньше, чем CD68+-клеток (данные не представлены). В группах PDO и Permacol доля их было достоверно выше уже на 10-е сутки (рис. 3), что свидетельствует о поляризации макрофагов в М2-направлении и переключении альтеративной стадии воспаления в продуктивную.
Таким образом, во всех исследуемых группах мы наблюдали реакцию отторжения трансплантата, которая проявлялась последовательно в развитии воспалительной реакции с участием клеток врожденного иммунитета с последующим развитием гранулематозного воспаления инородных тел, что в конечном итоге завершалось образованием фиброзной капсулы вокруг элементов протеза. Перечисленные этапы отторжения инородного тела взаимосвязаны друг с другом, и выраженность одного этапа обусловливает течение последующего [24].
Принято считать, что «идеальный протез» должен быть биоинертен и вызывать минимальное воспаление и фиброзную инкапсуляцию. К сожалению, на сегодняшний день нет ни одного натурального или синтетического протеза, который бы не вызывал подобных реакций, поэтому задачей современных биоматериаловедения и тканевой инженерии является минимизация этих реакций [1]. Нами было показано, что независимо от природы материала протеза (синтетический или биологический), его трансплантация вызывает выраженную макрофагальную инфильтрацию, которая сохраняется длительное время. Это свидетельствует о продолжающемся хроническом воспалении (реакции отторжения) в ответ на введение инородного тела. Однако степень выраженности и характер такого воспаления отличается между группами, что позволяет выбрать протез с минимальными провоспалительными свойствами.
Заключение
В экспериментах in vitro и in vivo были изучены биосовместимость и эффективность применения экспериментальных образцов сетчатых имплантатов на основе полигликолида или полидиоксанона. В качестве контроля был использован Permacol – широко применяемый в хирургии резорбируемый протез из децеллюляризированной дермы свиней. Все варианты протезов постепенно резорбировались и замещались собственной соединительной тканью, при этом были выявлены признаки образования новых скелетных мышц в области трансплантации. По мере резорбции уменьшалась прочность протеза, в том числе и в контрольной группе, оставаясь сопоставимой с аналогичным показателем нативной ткани.
По ряду показателям биосовместимости и эффективности (выраженность спаечного процесса, воспалительной реакции, активации прорегенераторных М2 макрофагов) протез из полидиоксанона оказался достоверно лучше, чем протез из полигликолида и даже Permacol.
Разработанный резорбируемый сетчатый протез на основе полидиоксанона можно рекомендовать для проведения доклинических и клинических исследований и последующей регистрации как изделия медицинского назначения для закрытия объемных дефектов стенок брюшной полости и укрепления дна малого таза.



