Врожденные пороки развития (ВПР) плода – проблема, имеющая как медицинское, так и социальное значение, поскольку в структуре младенческой смертности и инвалидности с детства пороки развития занимают одно из первых мест [1]. ВПР плода относятся к группе медико-социальной перинатальной патологии, что обусловлено высоким уровнем младенческой смертности и детской инвалидности [1]. Среди широкой группы ВПР врожденная диафрагмальная грыжа (ВДГ), при которой в течение антенатального развития органы брюшной полости перемещаются в грудную клетку плода, продолжает оставаться одной из наименее изученных проблем. ВДГ обнаруживают у каждого десятого новорожденного с ВПР с частотой 1:2000 до 1:5000 живорожденных детей [2–4]. При этом летальность в группе новорожденных с ВДГ продолжает оставаться на высоком уровне и в зависимости от возможностей лечебного учреждения колеблется в пределах от 35 до 80% [4, 5]. В ведущих медицинских учреждениях Евросоюза и США этот показатель составляет 50% [6].
Основная причина смерти новорожденного с ВДГ – устойчивость к терапии легочной гипертензии, первично обусловленная гипоплазией легких.
Развитие ВДГ может быть обусловлено хромосомными дефектами, генетическими синдромами и/или негенетическими факторами [7, 8].
Среди хромосомных дефектов выделяют: трисомию по 18 паре хромосом, тетрасомию по 12 паре (синдром Паллистера–Киллиана), синдром Фринса.
Генетические синдромы, сопряженные с ВДГ: Аперта, Чардж, Коффин–Сирис, Гольтц, Перлман, Свайера, Корнелии де Ланге, Гольденхара, Беквитта–Видеманна, Симпсона–Голаби–Бемель, Донна–Барроу, Мэтью–Вуда, Ярхо–Левина, Фрейзера, Стиклера, Пьера Робена. Также в литературе описаны: частичная трисомия 5 пары хромосом, частичная трисомия 20 пары и полиплоидия [7, 8].
В основе негенетической теории формирования ВДГ лежит неспособность нормального закрытия плевроперитонеального канала под воздействием факторов окружающей среды, которые нарушают дифференцировку мезенхимальных клеток во время формирования диафрагмы.
Различают следующие по локализации диафрагмальные грыжи:
- грыжа заднелатеральная (грыжа Бохдалека) – 75–95% случаев;
- грыжа правосторонняя – 10–15%;
- грыжа парастернальная (грыжа Морганьи) – 1–2% случаев;
- грыжа двусторонняя – 1–2% случаев.
Выявление ВДГ обычно происходит первично ультразвуковым методом в конце II триместра беременности, когда появляются патогномоничные признаки этого порока развития (аномальное изображение органов грудной клетки, смещение сердца и его компрессия, обнаружение в грудной клетке плода желудка, петель тонкого кишечника, печени и селезенки в виде патологических анэхогенных образований) [9].
В настоящее время самым широким валидированным методом для прогнозирования неонатального исхода является измерение отношения размеров легких к голове плода (LHR), впервые описанное Metkus et al. [10]. Отношение реальное/ожидаемое LHR считается наиболее оптимальным для оценки прогноза выживаемости новорожденного и поэтому наиболее часто используется в клинической практике [11]. Для легкой степени левосторонней ВДГ значение этого показателя соответствует 45%, средней степени – 25%, тяжелая и очень тяжелая степень имеют показатели до 25% и менее 15% соответственно. Каждая степень тяжести ВДГ коррелирует с уровнем выживаемости новорожденного. Для легкой и средней степени он равен 95% и 50%, а для тяжелой и очень тяжелой – 30% и 5% соответственно. Проникновение печени и/или желудка в грудную клетку значительно снижает уровень выживаемости [12, 13].
Активное лечение ВДГ началось сравнительно недавно, в середине XX века, и подходы к его проведению претерпели значительные изменения в связи с развитием анестезиологии, реанимации, фетальной хирургии и фармакологии [14].
В настоящее время для лечения тяжелой гипоплазии легких новорожденного применяется высокочастотная вентиляция легких и экстракорпоральная мембранная оксигенация (ЭКМО).
Результаты исследования по эффективности и безопасности проведения внутриутробной окклюзии трахеи плода противоречивы.
В проспективном рандомизированном контролируемом исследовании окклюзии трахеи плода по поводу ВДГ не выявлено различий выживаемости плодов после эндоскопической окклюзии трахеи плода или стандартной постнатальной хирургической коррекции диафрагмальной грыжи [15]. K.D. Wenstrom утверждал, что есть несколько причин, по которым окклюзия трахеи плода не может привести к лучшему результату, чем традиционная терапия [16]. Прежде всего, женщины с выявленной ВДГ у плода родоразрешаются в специализированных центрах, где новорожденные получают высокоспециализированное лечение респираторных заболеваний, включая высокочастотную вентиляцию легких, экзогенное поверхностно-активное вещество, ЭКМО и др. Как результат, текущая выживаемость для всех случаев изолированной ВДГ – от легкой до тяжелой – приближается к 70% без операции во внутриутробном периоде, а у новорожденных, которым не требуется ЭКМО (приблизительно у 50% детей с изолированной ВДГ), выживаемость составляет по меньшей мере 80%. Кроме того, отсутствие повышения уровня выживаемости и снижения заболеваемости после фетоскопической эндотрахеальной окклюзии трахеи (ФЭТО) связано с преждевременным излитием околоплодных вод и преждевременными родами после проведения внутриутробной фетальной окклюзии. Тем не менее и M.R. Harrison, и K.D. Wenstrom настаивали, что внедрение ФЭТО в широкую медицинскую практику следует продолжить, в том числе в рамках мультицентровых рандомизированных исследований.
Исследование R. Ruano доказало, что эндоскопическая окклюзия трахеи плода снижает смертность новорожденных и ускоряет стабилизацию новорожденного [17]. Оно было основано на концепции, что прогноз ВДГ может быть возможен путем оценки размера легких плода, степени проникновения печени в грудную клетку и степени развития сосудов легких плода в изолированных формах ВДГ. Эти параметры помогают классифицировать плоды с изолированной ВДГ легкой, средней, тяжелой или очень тяжелой формами. Тяжелые и чрезвычайно тяжелые ВДГ имеют неблагоприятные результаты и, следовательно, являются кандидатами на инновационные методы лечения, такие как ФЭТО [14, 18]. Эндоскопическая окклюзия трахеи плода обычно проводится между 26 и 30 неделями беременности. После процедуры ультразвуковое наблюдение каждые 2 недели обеспечивает структурную целостность баллона и измеряет легочную реакцию плода. Примерно в 34 недели беременности баллон опорожняется и удаляется.
Основными проблемами у плодов и новорожденных после проведения методики ФЭТО на современном этапе являются:
- дисфункция сурфактантной системы легких плода;
- сердечная недостаточность;
- легочная гипоплазия;
- стойкая легочная гипертензия.
Для внутриутробной фетоскопической коррекции используется традиционная методика внутриутробной эндотрахеальной баллонной окклюзии. Удаление баллона проводится под ультразвуковым контролем путем пункции баллона спинальной иглой 18G непосредственно перед родоразрешением.
Более 30 лет назад M.R. Harrison провел первую попытку оперативного вмешательства на плоде [19], а дальнейшее совершенствование хирургического инструментария и техники хирургов позволило фетальной хирургии стать единственным шансом для плода в предотвращении прогрессирования ВДГ. В настоящее время фетоскопическая коррекция ВДГ является хоть и инвазивной, но малотравматичной и быстро выполнимой операцией [20].
В качестве агента, обеспечивающего эндотрахеальную окклюзию при внутриутробном доступе, было отдано предпочтение баллону. Но самое важное – выбрать материал, наиболее безопасный для человека и технически удобный для его создания. Как правило, такими характеристиками обладают силикон, латекс и поливинилхлорид, наиболее часто используемые для производства медицинских изделий, включая импланты.
Для фетоскопической внутриутробной окклюзии трахеи плода в настоящее время применяют латексный баллон, называемый goldballon.
Техника использования goldballon такова: сначала катетер с баллоном вводится в трахею и опускается до уровня бифуркации трахеи. Баллон раздувается и перекрывает вход в бронхи. После этого катетер сдергивается с баллона, удаляется и в трахее остается только раздутый баллон. Скопление альвеолярной жидкости в легких увеличивает их объем и препятствует компрессии легких со стороны органов брюшной полости, что в дальнейшем способствует более быстрой стабилизации новорожденного.
 Через 2 месяца необходимо провести фетоскопическую процедуру и путем повторной бронхоскопии удалить опорожненный баллон или под ультразвуковым контролем делать пункцию баллона спинальной иглой 18G.
Через 2 месяца необходимо провести фетоскопическую процедуру и путем повторной бронхоскопии удалить опорожненный баллон или под ультразвуковым контролем делать пункцию баллона спинальной иглой 18G.
Таким образом, применяемая процедура связана с потребностью в повторном фетоскопическом вмешательстве.
Это крайне неудобно для беременной женщины, которой приходится второй раз возвращаться в клинику, где ей делали установку баллона, и нежелательно для плода, которому производится повторная фетоскопическая процедура с бронхоскопией. Повторная процедура повышает риск преждевременных родов и осложняет прогноз выхаживания недоношенного новорожденного с ВДГ.
Цель нашего исследования: разработка новой модели эндотрахеального катетера (российское название Feto ballon) для создания нового метода инновационной внутриутробной эндотрахеальной окклюзии трахеи плода, что позволит увеличить выживаемость детей с ВДГ и критической формой гипоплазии легких.
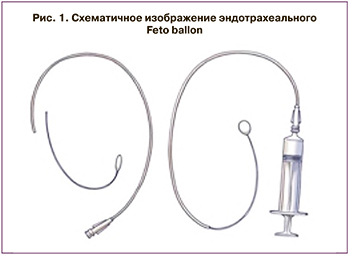
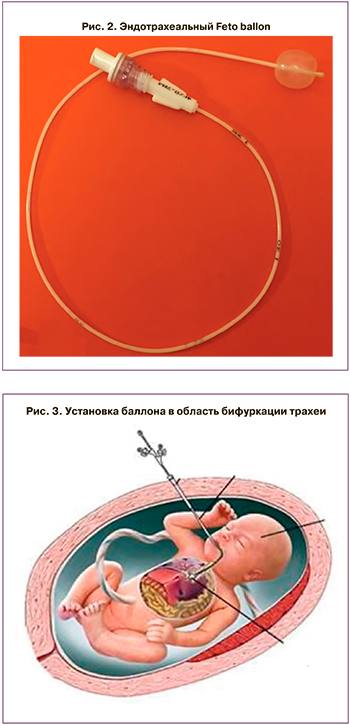 В соответствии с этой задачей в ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ России в 2019 г. разработана новая модель эндотрахеального катетера Feto ballon, которая обеспечивает физиологическое удаление из трахеи баллона вместе с катетером после родоразрешения, что позволяет снизить всевозможные риски для женщины и плода (рис. 1, 2).
В соответствии с этой задачей в ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ России в 2019 г. разработана новая модель эндотрахеального катетера Feto ballon, которая обеспечивает физиологическое удаление из трахеи баллона вместе с катетером после родоразрешения, что позволяет снизить всевозможные риски для женщины и плода (рис. 1, 2).
Новая модель эндотрахеального катетера (Feto ballon) выполнена из гибкого эластичного материала полиэфирблокамида Pebax и состоит из двух частей: короткого дистального отдела длиной 10 см с раздувающимся баллоном на конце и проксимального длиной 50 см с выделенным каналом для введения физиологического раствора в манжету надувного баллона. В настоящее время эндотрахеальный катетер представляет собой прототип баллона, который будет зарегистрирован как медицинское изделие для фетоскопической операции.
Установка баллона возможна на сроке 24–29 недель беременности, срок родоразрешения – 37–38 недель, с удалением баллона методом EXIT. При проведении операции для доступа в полость матки будет использована местная анестезия (лидокаин 1% 10–20 мл). Для обеспечения анестезии плода, его иммобилизации и профилактики фетальной брадикардии под ультразвуковым контролем через иглу 20G или 22G внутримышечно будет введен рокурония бромид (0,6 мг/кг) или пипекурония бромид (0,4 мг/кг) и фентанил (10–15 мкг/кг). Токолиз будет обеспечен нифедипином 20 мг 2 раза в день или атозибаном (по схеме последовательного введения: начальная доза – 6,75 мг, трехчасовая инфузия – 54 мг, длительная инфузия (до 45 ч) – 270 мг). Антибиотикопрофилактика будет проводиться цефазолином 2 г внутривенно каждые 8 ч в течение 24 ч.
Технология использования эндотрахеального Feto ballon представляет собой последовательность действий:
1) под контролем УЗИ дистальный конец баллона вводят через ротовую полость плода в трахею до зоны бифуркации трахеи (рис. 3);
 2) манжетку баллона раздувают физиологическим раствором в объеме 0,8 мл;
2) манжетку баллона раздувают физиологическим раствором в объеме 0,8 мл;
3) с помощью толкателя-проводника отделяют длинную (проксимальную) часть катетера от короткой части (дистальной) с последующим удалением длинной части катетера. Раздутый баллон с короткой частью катетера остается в трахее и перекрывает вход в бронхи. Скопление альвеолярной жидкости в легких увеличивает их объем и препятствует компрессии легких со стороны органов брюшной полости (рис. 4);
4) из полости рта плода выступает отрезок 1–2 см короткой части катетера, за который после родоразрешения баллон извлекают из трахеи (рис. 5).
Заключение
Таким образом, использование новой модели эндотрахеального катетера, разработанного в ФГБУ «НМИЦ АГиП им. В.И. Кулакова» для внутриутробной окклюзии трахеи плода, должно позволить избежать проведения повторной фетоскопии и бронхоскопии у плода, что обеспечит повышение выживаемости плода и снижение рисков постнатальных осложнений для матери и новорожденного с ВДГ.



