Проблема сохранения и укрепления репродуктивного здоровья в современных условиях в Украине является одной из важных государственных и медико-социальных проблем. Во всем мире наблюдается ухудшение демографической ситуации, которая приводит к уменьшению рождаемости и увеличению числа бесплодных браков. Всемирная организация здравоохранения обеспокоена тем, что в начале XXI в. бесплодие может стать третьим по распространенности заболеванием после онкологической патологии и болезней сердечно-сосудистой системы. По мнению экспертов ВОЗ, уровень бесплодия в стране, достигающий 15%, катастрофический и должен требовать вмешательства государства, поскольку ведет к демографически неисправляемой ситуации [1]. В последние годы в Украине вопрос бесплодия принимает угрожающий характер: из 15 млн супружеских пар около 1–2 млн бесплодны (20%) [2, 3]. Истоки этих нарушений лежат в детском и подростковом возрасте, то есть от состояния здоровья подрастающего поколения зависит будущее нации.
Период полового созревания – это критический период постнатального развития женского организма, когда формируются связи, обеспечивающие взаимодействие пяти основных уровней репродуктивной системы, происходит интенсивное развитие и систематизация подкорковых структур мозга, ответственных за гормональную регуляцию жизнедеятельности организма. На протяжении этого периода происходит дальнейший рост и развитие женского организма. До окончания периода полового созревания даже при установившемся регулярном менструальном цикле, в отличие от чадородного периода, репродуктивная система обладает значительной лабильностью и особенно чувствительна к воздействию неблагоприятных экзогенных и эндогенных факторов [4–6].
Анализ литературы последних лет свидетельствует о том, что основной причиной дисфункциональных маточных кровотечений в подростковом возрасте считается функциональная «незрелость» центральной нервной системы и расстройства регуляции овариально-менструального цикла на уровне гипоталамо-гипофизарного комплекса и, как следствие, изменение продукции стероидных гормонов [7–10]. Проблема гормональных взаимоотношений при эндокринозависимой гинекологической патологии не утратила своей актуальности, так как является ключевым звеном в расшифровке патогенеза этих заболеваний. Несмотря на достаточно широкое изучение гормонального фона при пубертатных маточных кровотечениях, до сих пор не существует единого мнения о механизмах его возникновения и формирования.
В подростковом возрасте наиболее тяжелыми по своему течению являются пубертатные маточные кровотечения (ПМК) [6, 11, 12]. Многолетний опыт наблюдения и лечения девушек с ПМК позволил нам выделить три основных клинических варианта течения этого заболевания.
Детальный анализ всех уровней гормональной регуляции дал возможность высказать предположение, что особенности клинического течения обусловлены спецификой взаимоотношений между звеньями гипоталамо-гипофизарно-гонадной системы (ГГГС).
Целью настоящего исследования стало сопоставление гормонального профиля, уровня биогенных аминов и их влияние на органы-мишени у девочек-подростков с ПМК в зависимости от клинического варианта течения.
Для реализации поставленной цели необходимо было решить следующие задачи:
- исследовать функциональное состояние гипофизарно-гонадной системы у пациенток с ПМК с учетом особенностей клинического течения;
- проанализировать характер обмена катехоламинов, серотонина у больных с ПМК и оценить их роль в патогенезе заболевания;
- дать характеристику взаимоотношений гипоталамо-гипофизарно-гонадной системы у девочек с ПМК с учетом клинического варианта течения.
Материалы и методы исследования
Работа выполнена по результатам клинического и параклинического обследования 346 девушек-подростков 11–18 лет с ПМК, которые находились на лечении в отделении детской гинекологии ГУ «ИОЗДП НАМН». Больные с кровотечениями были разделены на группы сугубо с клинических позиций, без предварительного гормонального обследования. Были выделены пациентки, у которых кровотечения возникли впервые и носили рецидивирующий характер.
Анализ группы с впервые возникшими кровотечениями выявил ее неоднородность. Обратило на себя внимание, что у части девочек кровотечения на момент обращения за медицинской помощью длились в основном более 4–6 недель и протекали своеобразно. Период кровотечения в 10–14–20 дней сменялся кратковременным 2–5 дневным «светлым» промежутком – отсутствием кровянистых выделений, затем через несколько дней кровотечение возобновлялось. И таких эпизодов могло насчитываться несколько. Мы выделили их в отдельную группу «ремитирующих» кровотечений (от латинского слова remetem – перемежающийся). Результаты наших предшествующих исследований показали, что эта группа больных характеризуется определенными клинико-анамнестическими лабораторными и ультразвуковыми данными, отличающими ее от других кровотечений, что было подтверждено построением математической модели с использованием дискриминантного анализа. Они составили 13,9% всех кровотечений и 33,1% впервые возникших.
Таким образом, нами выделено три клинических варианта течения ПМК. В Ι группу вошли 145 девочек (41,9%) с впервые возникшим эпизодом кровотечения, во ΙΙ группу – 48 подростков (13,9%), у которых наблюдался ремитирующий характер кровотечений, ΙΙΙ группу - 153 (44,2%) пациентки с рецидивирующим течением заболевания. Группу сравнения составили 25 девочек-подростков – сверстниц с нормальным менструальным циклом.
Всем больным проводили комплексное клинико-лабораторное обследование, которое включало сбор анамнеза, определение уровня физического и полового развития, гинекологический статус.
О функциональном состоянии различных уровней репродуктивной системы судили на основании определения: в суточной моче содержания диоксифенилаланина (ДОФА), дофамина (ДА), норадреналина (НА), адреналина [13], в сыворотке крови – уровня серотонина [14], концентраций ЛГ, ФСГ иммуноферментным методом на фотометре «Humareader» (Германия) с помощью стандартных коммерческих наборов фирмы «Human» (Германия). Уровень пролактина (ПРЛ) определяли в сыворотке крови радиоиммунологическим методом с использованием стандартных наборов фирмы «Immunotech» (Чехия). Стероидная активность тестировалась по содержанию в периферической крови эстрадиола (Е2), эстриола (Е3), общего тестостерона, кортизола радиоиммунологическим методом с использованием стандартных наборов фирмы «Immunotech» (Чехия). Подсчет радиоактивности проводили на счетчике Гамма-800 «Наркотест».
Трансабдоминальное ультразвуковое сканирование органов малого таза проводилось с помощью Lodgic-100 с использованием секторального датчика с частотой 3,5 МГц на фоне наполненного мочевого пузыря в реальном масштабе времени.
Для выявления особенностей эхосонографических показателей внутренних половых органов исследовалась их топография, размеры матки в трех проекциях, акустический рисунок эндометрия, форма, размеры и эхо- структура яичников.
Анализ ассоциации гормонов различного уровня регуляции менструальной функции и органов-мишеней проводился методом множественного регрессионного анализа. Для статистического анализа использовался пакет прикладных программ «Statgraphics Plus for Windows 3.0» (Manugistic Inc., USA). Результаты приведены в виде таблиц набора зависимых (Yj) и независимых (Xi) переменных (детерминант), а также коэффициента детерминации (R2). После применения процедуры пошагового отбора в качестве детерминант зависимой переменной указаны те независимые переменные, вклад которых в дисперсию зависимой переменной имеет уровень значимости P<0,05.
Результаты и их обсуждение
Предпосылкой проведения нашего исследования стало положение о том, что интеграция и равновесие эндокринной и нервной систем является ключевым моментом в обеспечении нормального менструального цикла. Дисбаланс обмена катехоламинов, гормонов может служить пусковым механизмом возникновения нарушений менструальной функции. Это может касаться как звеньев центральной и периферической регуляции, так и органов-мишеней. ПМК являются характерным примером расстройств вышеперечисленных органов и систем. Однако и до сегодняшнего дня не получили надлежащего освещения вопросы взаимодействия симпато-адреналовой системы с изменениями гормонального гомеостаза при ПМК. В связи с этим нами было высказано предположение, что особенности клинического течения ПМК определяются своеобразием функционирования системы регуляции менструального цикла, а именно гипоталамо-гипофизарно-гонадного комплекса. Иными словами, каждый клинический вариант ПМК имеет специфический гормональный профиль, состоящий из определенного паттерна гормонов, присущего каждому уровню ГГГС, и функциональных связей, сложившихся между различными уровнями регуляции менструального цикла.
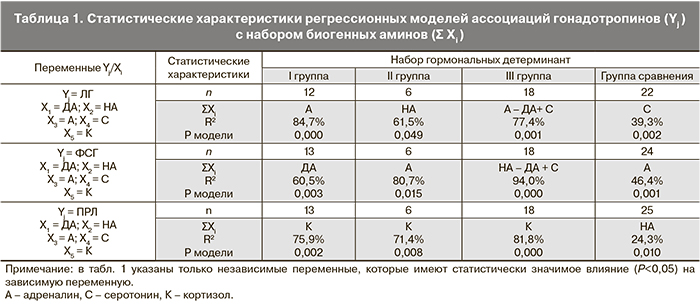
Был последовательно проанализирован характер прямых и обратных связей каждого уровня ГГГС, включая органы-мишени. Множественный регрессионный анализ позволил оценить значение и взаимосвязь гормонов и нейромедиаторов в формировании различных клинических вариантов ПМК. Результаты множественного регрессионного анализа ассоциации гипофизарных гонадотропинов с биогенными аминами представлены в табл. 1.
Выяснено, что у пациентов с различным клиническим течением ПМК взаимосвязи между уровнем гонадотропинов и катехоламинами имеют свои особенности. Так, при впервые возникших кровотечениях существует прямое стимулирующее влияние между ДА и ФСГ, адреналина и ЛГ, которое и обеспечивает определенный паттерн гонадотропинов при данной клинической форме ПМК. Положительная связь между концентрацией кортизола и ПРЛ оказалась характерной для всех больных с ПМК, независимо от клинического варианта течения. По нашему мнению, это происходит за счет действия глюкокортикоидов через надпочечники на биосинтез катехоламинов, особенно ДА, который принимает непосредственное участие в регуляции ПРЛ.
В группе с ремитирующими кровотечениями отмечаются аналогичные взаимоотношения, но со своими особенностями. У этих девочек продолжают сохраняться положительные связи между катехоламинами и гонадотропинами. Содержание адреналина детерминирует уровень ФСГ, а НА – ЛГ. Повышение концентрации ПРЛ и понижение ЛГ являются характерным паттерном гонадотропинов для этой группы пациенток. Как и в первой группе, на концентрацию ПРЛ у этих девочек оказывал влияние кортизол.
Таким образом, у подростков с первым эпизодом кровотечения, в том числе и с ремитирующими кровотечениями, сохраняются связи между катехоламинами и гонадотропинами, характерные для физиологического менструального цикла.
У девочек с рецидивами кровотечений меняются взаимоотношения между катехоламинами и гонадотропинами. На содержание лю- и фоллитропинов продолжают оказывать стимулирующее влияние НА и адреналин: адреналин на ЛГ, НА на ФСГ, но между ДА и гонадотропинами формируется отрицательная связь (тормозящее влияние ДА на ЛГ и ФСГ). У этого контингента больных появляется стимулирующее влияние серотонина на уровень ЛГ и ФСГ. По всей видимости, это связано с его стресс-лимитирующим действием. Однако достаточно низкий уровень серотонина, по нашему мнению, не дает возможности для спонтанной нормализации менструальной функции и способствует формированию рецидивов заболевания.
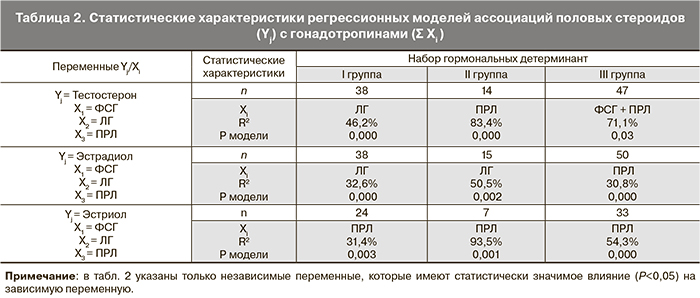
Анализ гипофизарно-гонадного звена регуляции менструальной функции выявил избирательность влияния тропных гормонов на продукцию половых стероидов в зависимости от клинического варианта течения ПМК (табл. 2).
У пациенток Ι группы, исходя из коэффициента детерминации R2, ЛГ оказывает слабое влияние на содержание тестостерона и Е2, а ПРЛ – на Е3. Во ΙΙ группе сохраняется положительная связь в системе гипофиз – гонады, в основном за счет прямого влияния ЛГ на уровень Е2. В свою очередь, ПРЛ является детерминантом уровня андрогенов (тестостерона) и малоактивных эстрогенов (Е3). Что касается пациенток ΙΙΙ группы, то все без исключения половые стероиды находятся у них под контролем ПРЛ.
Нами изучалась также роль половых стероидов в цепи обратной связи гонады – гипоталамус. Известно, что рецепторы к стероидным гормонам представлены в большом количестве в медиобазальных ядрах гипоталамуса, где они принимают участие в опосредовании обратной связи: гонады – гонадотропин-синтезирующие структуры гипоталамуса, а также осуществляют широкий спектр воздействия на механизмы адаптации, памяти и др. [15].
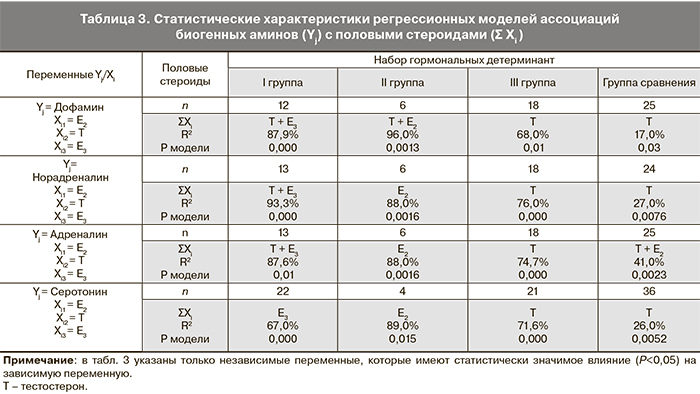
Проведение регрессионного анализа позволило оценить влияние определенных половых стероидов на уровень биогенных аминов в организме девочек на фоне ПМК (табл. 3).
У пациенток с впервые возникшими кровотечениями детерминантами уровня катехоламинов в организме были тестостерон и Е3, а содержания серотонина в крови – только Е3. Можно предположить, что нарушения в цепи обратной связи ГГГС у этих больных связаны именно с эстрогенной недостаточностью из-за низкой эстрогенной активности Е3: андрогены и малоактивный эстроген – Е3 могут блокировать рецепторное связывание Е2 с гипоталамическими центрами.
В организме девочек с ремитирующими кровотечениями уровень Е2 в крови детерминировал содержание НА, адреналина, серотонина, а в комбинации с тестостероном – и содержание ДА. Несмотря на то что в этой группе больных наблюдалась самая низкая концентрация Е2, установленная взаимосвязь уровня Е2 с содержанием биогенных аминов позволяет говорить о функциональной полноценности обратной связи в системе «половые стероиды – гипоталамус».
У подростков с рецидивами кровотечений тестостерон является основным детерминантом влияния половых стероидов на уровень нейромедиаторов. Это может свидетельствовать о более серьезных нарушениях в центральном звене репродуктивной системы у этой когорты пациенток. У пациенток этой группы гиперактивация симпато-адреналовой системы, пониженный уровень серотонина и блокирование со стороны андрогенов триггерных механизмов менструального цикла обусловливают, по всей видимости, рецидивирующий характер ПМК.
Следует отметить, что высокие значения коэффициента детерминации (R2>60,0%) взаимосвязи половых стероидов и биогенных аминов, который имел место во всех без исключения группах больных с ПМК в сравнении с контролем, указывает на то, что функциональная система «половые стероиды – гонадотропин-синтезирующие структуры мозга» во время ПМК доминирует над другими функциональными системами с участием биогенных аминов.
По нашему мнению, именно гормонально-медиаторными взаимоотношениями в системе обратной связи можно объяснить особенности клинического течения ПМК.
У девочек Ι группы тестостерон и Е3, как антагонисты эстрогенных рецепторов [16], блокируют эстроген-опосредованное влияние на гипоталамическое звено саморегуляции менструального цикла, определяя тем самым характер маточного кровотечения. Для подростков ΙΙ группы характерно сохранение эстроген-зависимого звена саморегуляции, что, на наш взгляд, и обеспечивает периоды ремиссии. У пациенток ΙΙΙ группы в связи с относительно высоким уровнем Е2 по сравнению с другими группами реализуется блокирующая функция в цепи обратной связи относительно центрального звена саморегуляции, что, по всей видимости, и приводит к повторам маточных кровотечений.
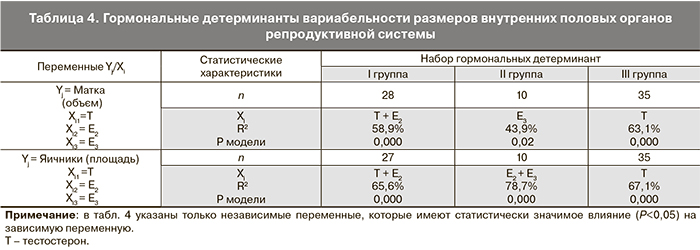
Следующим звеном в сложной системе регуляции менструальной функции являются органы-мишени. Данные множественного регрессионного анализа влияния половых стероидов на органы-мишени представлены в табл. 4.
Результаты анализа свидетельствуют о наличии влияния стероидных гормонов на размеры матки и яичников у девочек-подростков с ПМК, имеющие свои особенности в зависимости от клинического варианта течения заболевания. У пациенток Ι группы размеры матки и яичников, по данным ультразвукового исследования, детерминируют Е2 и тестостерон. Для подростков ΙΙ группы характерно влияние эстрогенов (содержание Е2 и Е3, а также их соотношение Е2/Е3). При рецидивах заболевания на размеры внутренних половых органов оказывает основное действие уровень тестостерона в сыворотке крови.
Таким образом, ПМК неоднородны по своей структуре. В основе характера клинического течения ПМК лежат особенности взаимоотношений, сложившихся в отдельных звеньях гормональной регуляции менструальной функции под влиянием эндогенных и экзогенных факторов. Каждому клиническому варианту ПМК соответствует специфический гормональный профиль, который складывается из определенного паттерна гормонов, присущих каждому уровню ГГГС, и функциональных связей между разными уровнями регуляции менструальной функции.
Выводы
- Нейрогормональные нарушения при ПМК характеризуются многообразием изменений взаимодействия между катехоламинами, гонадотропинами, стероидными гормонами.
- Каждому клиническому варианту ПМК присущи свои особенности взаимоотношений центральных и периферических звеньев регуляции менструального цикла.
- Выявлено, что гормональными детерминантами, которые влияют на вариабельность размеров внутренних половых органов при впервые возникших кровотечениях, являются эстрадиол и тестостерон, при ремитирующих – эстрадиол и эстриол, при рецидивирующих – тестостерон.



