Традиционно овариальная стимуляция в программе экстракорпорального оплодотворения (ЭКО) всегда начиналась с первых дней менструального цикла женщины. В соответствии с преобладающей на протяжении нескольких десятилетий концепцией фолликулогенеза рекрут единственной волны антральных фолликулов имеет место лишь в конце лютеиновой фазы предшествующего менструального цикла. Вслед за регрессией желтого тела, снижением продукции эстрадиола и ингибина происходит рост уровня циркулирующего фолликулостимулирующего гормона (ФСГ), который, в свою очередь, ответственен за стимуляцию (или предотвращение атрезии) когорты 2–5 мм антральных фолликулов в яичниках [1, 2].
Несмотря на существующие работы, указывающие на отсутствие видимых изменений в количестве антральных фолликулов на протяжении менструального цикла, доминировала точка зрения, что фолликулы, рекрутированные в другие фазы менструального цикла, подвергаясь влиянию желтого тела, находились преимущественно в состоянии атрезии, содержали меньшее количество гранулезных клеток и секретировали меньше эстрадиола, в сравнении с фолликулами в начале фолликулярной фазы.
Некоторые работы подтверждают, что антральные фолликулы 2–5 мм в течение менструального цикла появляются постоянно, в то время как другие свидетельствуют о циклических волнах или когортах развития фолликулов в течение цикла. В большом исследовании на протяжении менструального цикла у здоровых женщин зафиксировано появление двух или трех волн от 4 до 14 фолликулов ≥4–5 мм [2, 3]. В настоящее время считается, что 68% женщин имеют 2 волны рекрута фолликулов в течение интраовуляторного интервала, а 32% – 3 волны [2].
Таким образом, имеются данные о возможности успешной овариальной стимуляции в программе ЭКО с инициацией в конце фолликулярной/начале или середине лютеиновой фазы менструального цикла [4].
Тем не менее не всеми исследователями получены сопоставимые результаты при проведении стимуляции в разные фазы менструального цикла; были случаи отмены протокола ввиду отсутствия ответа яичников [5, 6]. До настоящего времени не в полной мере определены протоколы стимуляции, выбор гонадотропинов, методов предотвращения спонтанного пика лютеинизирующего гормона (ЛГ) и лютеинизации фолликулов при инициации стимуляции яичников в поздней фолликулярной, ранней/средней лютеиновой фазах. При этом не совсем понятна роль преовуляторного фолликула, процессов атрезии фолликулов и желтого тела в формировании фолликулярного пула и качества ооцитов. Также неизвестна роль гормональных маркеров овариального резерва в выборе тактики стимуляции, гонадотропинов и т.д. при овариальной стимуляции с началом протокола в разные фазы менструального цикла.
Цель исследования: сравнить гормональный профиль доноров ооцитов при овариальной стимуляции в фолликулярную и лютеиновую фазы менструального цикла.
Материалы и методы
Было проведено проспективное рандомизированное исследование на базе 1-го гинекологического отделения ФГБУ «НМИЦ АГП им. академика
В.И. Кулакова» Минздрава России. В исследование были включены 30 доноров ооцитов, каждому из них овариальная стимуляция была произведена дважды (на первом этапе в фолликулярную фазу, затем повторно через 3 месяца в лютеиновую фазу), что предполагало стратификацию их на 2 группы в зависимости от фазы проведения овариальной стимуляции:
- I группа (n=30) представлена донорами ооцитов, которым овариальная стимуляция осуществлялась в фолликулярную фазу менструального цикла;
- II группа (n=30) – те же доноры ооцитов, но проведение овариальной стимуляции осуществлялось в лютеиновую фазу менструального цикла.
Таким образом, было проанализировано 60 циклов овариальной стимуляции доноров.
Критерии включения: возраст от 18 до 35 лет; базальная концентрация ФСГ<10 мМЕ/мл; наличие более 10 антральных фолликулов на 2-й день менструального цикла; индекс массы тела 18–25 кг/м2; информированное согласие на участие в исследовании.
Пациенткам I группы программу проводили в протоколе с антагонистами гонадотропин-рилизинг-гормона (антГнРГ). Со 2–3-го дня менструального цикла проводилась овариальная стимуляция препаратами рекомбинантного ФСГ и/или человеческого менопаузального гонадотропина, дозы которых определялись индивидуально. После достижения фолликулами диаметра ≥14 мм по данным ультразвукового исследования (УЗИ) органов малого таза с целью предупреждения преждевременного пика ЛГ осуществлялось ежедневное введение антГнРГ до завершения овариальной стимуляции. Для определения дня введения триггера овуляции донорам было произведено УЗИ органов малого таза с целью визуализации диаметра антральных фолликулов; при достижении не менее тремя из них ≥18 мм в качестве триггера были использованы агонисты гонадотропин-рилизинг-гормона (аГнРГ). Трансвагинальная пункция яичников (ТВП) производилась через 36 ч после введения триггера овуляции. Был произведен забор периферической крови в день начала овариальной стимуляции, в день введения антГнРГ и в день введения триггера овуляции с целью определения концентраций прогестерона, эстрадиола и ЛГ.
Спустя 3 месяца после проведения овариальной стимуляции в фолликулярную фазу менструального цикла доноры ооцитов вступали в программу повторно. Критериями для начала овариальной стимуляции в лютеиновую фазу было наличие в каждом яичнике ≥5 антральных фолликулов диаметром 3–8 мм. При достижении лидирующими фолликулами диаметра ≥14 мм и до дня ТВП был назначен норэтистерон (норколут) 10 мг с целью предотвращения менструальноподобной реакции. При визуализации по данным УЗИ органов малого таза в яичниках ≥3 фолликулов диаметром ≥18 мм также вводились аГнРГ в качестве триггера овуляции. ТВП производилась через 36 ч после введения триггера овуляции.
Аналогично проводилось исследование гормонального профиля в крови в 1-й день введения препаратов для овариальной стимуляции, день назначения норэтистерона, в день введения триггера овуляции, а также ТВП яичников. Методом твердофазного иммунохемилюминесцентного анализа в сыворотке крови были измерены концентрации ЛГ, эстрадиола и прогестерона на анализаторе IMMULITE 2000 с использованием тест-систем Progesterone, LH, Estradiol (Siemens, США).
Исследование одобрено этической комиссией биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Статистический анализ
Полученные данные обрабатывались с использованием пакета статистического анализа для Microsoft Office Excel 2007 и SPSS V22.0. Статистическая обработка производилась с использованием общепринятых методов вариационной статистики. Для количественных параметров определяли среднее арифметическое значение (М), стандартное среднеквадратичное отклонение (SD), данные представлены в формате М (SD). Для качественных данных были определены показатели частоты (%).
С целью проведения сравнительного анализа количественных данных в исследуемых группах определялся вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных). Для оценки различий в группах при нормальном виде распределения данных применялись методы параметрической статистики (t-критерий Стьюдента), при распределении, отличном от нормального, применялись методы непараметрической статистики (тест Манна–Уитни). Различия считали значимыми при p<0,05.
Объем выборки
Объем выборки не рассчитывался ввиду отсутствия аналоговых исследований на донорах ооцитов на момент начала набора материала.
Первичные точки исследования: число зрелых ооцитов, полученных у донора ооцитов. Вторичные точки исследования: концентрации ЛГ, эстрадиола и прогестерона.
Результаты
Клинико-анамнестические данные доноров
Возраст доноров ооцитов составил 27,7 (4,2) года, средний индекс массы тела – 21,1 (3,1) кг/м2.
Большая часть доноров ооцитов перенесли детские инфекции. Все доноры соматически не отягощены по заключению профильного специалиста. У 3 доноров в анамнезе была произведена лапароскопия по поводу аппендэктомии.
Характеристики менструального цикла доноров представлены в таблице 1. Все доноры имели регулярный менструальный цикл. Средний возраст мeнархе составил 12,5 (0,5) года.
При сравнении параметров проведения овариальной стимуляции в разные фазы мeнструального цикла не было обнаружено статистически значимой разницы: в стартовой дозе гонадотропинов, которая составила в I группе 271,2 (37,2) МЕ, во II группе – 283,7 (32,2) МЕ (р>0,05); суммарной дозе гонадотропинов: в I группе – 2556,0 (399,8) МЕ, во II группе – 2898,8 (511,5) МЕ (p>0,05). При анализе длительности стимуляции в I группе – 10,1 (0,8) дня, во II группе – 10,8 (1,4) дня также не было выявлено статистически значимой разницы (p>0,05); базальная концентрация ФСГ в I группе составила 4,6 (3,2) МЕ/мл, во II группе – 3,8 (2,9) МЕ/мл (p>0,05).
В таблице 2 представлены концентрации ЛГ, эстрадиола и прогестерона в сыворотке крови у женщин, проходивших овариальную стимуляцию в различные фазы менструального цикла.
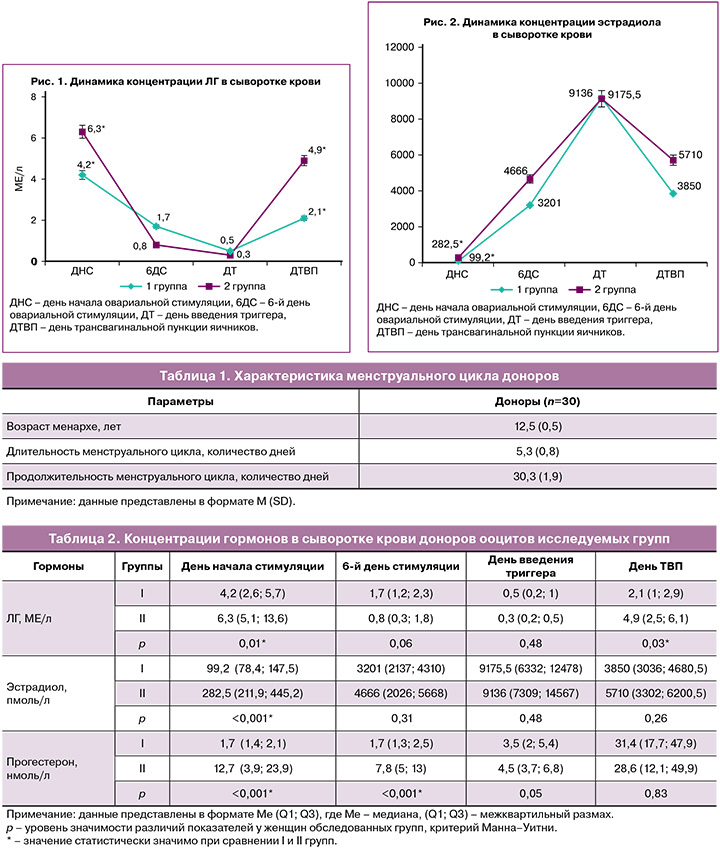
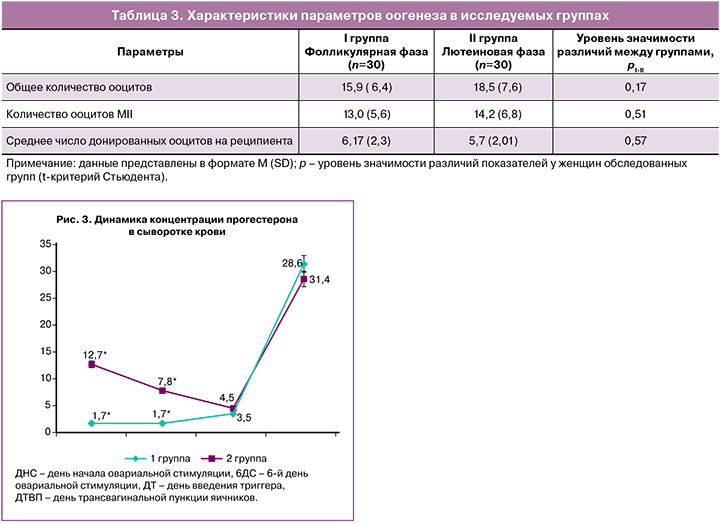
В 1-й день овариальной стимуляции были выявлены статистически значимые отличия для концентраций ЛГ (рис. 1), эстрадиола (рис. 2) и прогестерона (рис. 3), что обусловлено началом стимуляции в лютеиновую фазу цикла при ультразвуковой диагностике произошедшей овуляции (p<0,05). При анализе тех же значений в последующих точках (на 6-й день стимуляции, день введения триггера, день ТВП яичников) выявлено постепенное, однако статистически незначимое (p>0,05), увеличение сывороточного эстрадиола между группами, сопровождающее рост фолликулов (рис. 2). Концентрации прогестерона (рис. 3) были статистически значимо выше в день начала стимуляции (p<0,001) и на 6-й день (p<0,001) во II группе (лютеиновая фаза), что можно объяснить продолжающейся гормональной активностью желтых тел. Однако концентрации прогестерона в исследуемых группах выравниваются в день введения триггера овуляции, вероятно, в связи с угасанием активности желтых тел. В день ТВП уровни прогестерона также сопоставимы, нeзависимо от фазы менструального цикла, в которую была проведена овариальная стимуляция.
При сравнении параметров оогенеза в обеих группах не было выявлено статистически значимых различий в числе полученных, зрелых и донированных ооцитов (табл. 3).
Обсуждение
Для изучения влияния овариальной стимуляции в разные фазы менструального цикла на параметры ooгенеза нами была выбрана программа донор-реципиент, так как именно доноры являются идеальной моделью для изучения влияния периода начала стимуляции суперовуляции на качество ооцитов и эмбрионов, поскольку они представлены группой здоровых, потенциально или доказано фертильных женщин, которые добровольно проходят программу стимуляции яичников.
В нашем исследовании при изучении динамики изменений концентраций половых гормонов в период проведения программы у доноров ооцитов в разные фазы менструального цикла была выявлена статистически значимая разница в концентрации ЛГ в первый день введения препаратов для овариальной стимуляции в лютеиновую фазу менструального цикла, что является отражением произошедшего овуляторного пика ЛГ и старта программы сразу после визуализации наличия желтого тела по данным УЗИ органов малого таза. В I группе уровень ЛГ в день начала стимуляции составил 4,2 (2,6; 5,7) МЕ/л, во II группе – 6,3 (5,1; 13,6) МЕ/л (p<0,05). При дальнейшем анализе динамики концентрации уровня ЛГ статистически значимых различий выявлено не было. Важной особенностью протокола овариальной стимуляции, проводимого в лютеиновую фазу менструального цикла, стало отсутствие паразитарного пика ЛГ при сопоставимом уровне эстрадиола на 6-й день введения гонадотропных препаратов (в I группе уровень эстрадиола на 6-й день стимуляции составил 3201 (2137; 4310 пмоль/л, во II группе – 4666 (2026; 5668) пмоль/л (p>0,05). Лютеиновая фаза цикла отличается высокой концентрацией прогестерона на день начала овариальной стимуляции: в I группе его уровень составил 1,7 (1,4; 2,1) нмоль/л, во II группе – 12,7 (3,9; 23,9) нмоль/л (p<0,001). На 6-й день овариальной стимуляции в I группе уровень прогестерона составил 1,7 (1,3; 2,5) нмоль/л, во II группе – 7,8 (5; 13) нмоль/л (p<0,001). Однако ко дню введения триггера овуляции концентрация прогестерона снижается, достигая значений, сопоставимых с таковыми в I группе (I группа – 3,5 (2; 5,4) нмоль/л, II группа – 4,5 (3,7; 6,8) нмоль/л (p>0,05)). С целью предупреждения менструальноподобной реакции в лютеиновую фазу цикла женщины получали по 10 мг/сут норэтистерона, концентрация которого в сыворотке не определялась применяемыми нами тест-системами. Похожие данные были также представлены у Wei L.-H. et al. [7], где исследуемой группой были пациенты со сниженным овариальным резервом, прошедшие двойную овариальную стимуляцию в рамках одного менструального цикла.
В нашем исследовании не было выявлено негативного влияния высоких концентраций прогестерона на качество полученных ооцитов, что подтверждается числом полученных и зрелых ооцитов при стимуляции как в фолликулярную, так и в лютеиновую фазы (число зрелых ооцитов (MII) в I группе составило 13,0 (5,6), во II группе – 14,2 (6,8)). Эти данные, вероятно, можно объяснить отсутствием прогестероновых рецепторов в ооцит-кумулюсных комплексах [8].
Исходя из вышеизложенных данных, нами сделан вывод о том, что овариальная стимуляция в лютеиновую фазу менструального цикла позволяет обеспечить гормональный профиль и параметры фолликулогенеза, сопоставимые с таковыми при стимуляции в фолликулярную фазу цикла.
Высокие концентрации прогестерона и ЛГ в сыворотке крови, наблюдающиеся при овариальной стимуляции в лютеиновую фазу менструального цикла, не оказывают у доноров негативного влияния на параметры оогенеза, что подтверждается в нашем исследовании отсутствием статистически значимой разницы между числом полученных и зрелых ооцитов в двух группах.
Возможность начала овариальной стимуляции в любую из фаз менструального цикла согласуется с мультиволновой теорией фолликулогенеза [9]. Предыдущие исследования не выявили различий в количестве и компетенции ооцитов, полученных при проведении программы ЭКО в лютеиновую фазу, по сравнению с обычной стимуляцией [10–14]; более того, часть авторов продемонстрировали увеличение числа полученных ооцитов при стимуляции в лютеиновую фазу [13, 14].
Заключение
Таким образом, несмотря на то, что овариальная стимуляция в лютеиновую фазу цикла у доноров ооцитов имеет значимые отличия по гормональному профилю от овариальной стимуляции в фолликулярную фазу менструального цикла, выявленные особенности не оказывают негативного влияния на овариальный ответ, параметры фолликуло- и оогенеза и в результате – на получение «качественных» донорских ооцитов.



