Кумулятивное число зарегистрированных случаев ВИЧ-инфекции в Российской Федерации (РФ) составляет 1 408 264 человек, при этом 510 495 ВИЧ-позитивных получали антиретровирусную терапию (АРВТ) (данные по состоянию на 31 октября 2019 г.) [1]. Наиболее высокий уровень пораженности ВИЧ-инфекцией наблюдается в возрастной группе 30–44 года. В гендерной структуре преобладают мужчины (62%), однако в последние годы наблюдается увеличение доли женщин, живущих с ВИЧ. По некоторым данным, к концу 2019 г. диагноз ВИЧ-инфекции имели около 500 000 женщин в России, многие из которых планируют рождение ребенка [2, 3]. Использование АРВТ, наряду с улучшением качества и существенным увеличением продолжительности жизни, позволяет пациентам данной группы реализовать репродуктивную функцию, а при сохраненной фертильности у обоих супругов – самостоятельно, без использования вспомогательных репродуктивных технологий (ВРТ) [4]. Однако имеются данные ряда исследований о снижении фертильности у женщин с ВИЧ-инфекцией [2, 5, 6]. Так, Parsonset et al. (2000) показали, что частота встречаемости бесплодия среди пациенток с ВИЧ-инфекцией на 37% больше, чем у женщин без ВИЧ-инфекции [7].
ВРТ являются не только мерой профилактики инфицирования здорового партнера в дискордантных по ВИЧ парах, но и возможностью реализации репродуктивной функции. Однако, по разным данным, частота наступления беременности в программе экстракорпорального оплодотворения (ЭКО) у пациенток с ВИЧ-инфекцией колеблется от 6,7% до 24,1%, что существенно ниже в сравнении с женщинами без ВИЧ-инфекции [2, 6, 8]. Большинство ученых объясняют это негативным влиянием препаратов АРВТ на качество ооцитов и их способность к оплодотворению. Известно, что нуклеотидные ингибиторы обратной транскриптазы (НИОТ), которые всегда используются в схемах АРВТ, ингибируя активность обратной транскриптазы ВИЧ, нарушают процесс репликации вируса. Однако данная группа препаратов также способна подавлять гамма-полимеразу человека, которая необходима для репликации митохондриальной ДНК (мтДНК); как результат, наблюдается снижение содержания мтДНК, увеличивается уровень ее мутации [9, 10, 11].
В литературе имеются лишь единичные исследования копийности мтДНК ооцитов у ВИЧ-положительных женщин, получающих АРВТ. Так, Lopez et al. (2008) впервые показали, что в ооцитах ВИЧ-позитивных пациенток с бесплодием, принимающих АРВТ, в 32% случаев наблюдалось истощение мтДНК, по сравнению с контролем [12]. В исследовании Bostan et al. (2010) НИОТ ставудин индуцирует деплецию мтДНК в ооцитах мышей, что может нарушать их способность к оплодотворению и влияет на жизнеспособность эмбрионов [13].
Небольшое количество исследований, возможно, связано с этическими проблемами использования зрелой, способной к оплодотворению яйцеклетки, так как оценка копийности мтДНК в ооцитах представляет собой инвазивную процедуру. Неинвазивным маркером, отражающим качество ооцитов, являются митохондрии кумулюсных клеток. В работе Pawlak et al. (2015) было обнаружено, что количество копий мтДНК в ооцитах свиней коррелирует с количеством копий мтДНК в клетках кумулюса. Более того, мтДНК кумулюcных клеток способствует нормальному развитию яйцеклетки [14]. Исследований по изучению копийности мтДНК в кумулюсных клетках у женщин с ВИЧ-инфекцией не опубликовано.
Таким образом, на сегодняшний день отсутствуют однозначные данные о влиянии ВИЧ-инфекции и/или АРВТ на качество гамет как показатель эффективности программ ВРТ у женщин с ВИЧ-инфекцией, что явилось основанием для проведения настоящего исследования.
Цель – изучить копийность мтДНК в кумулюсных клетках у ВИЧ-инфицированных женщин, принимающих АРВТ.
Материалы и методы
Проспективное клиническое исследование проведено у 191 пациентки, которые обратились для проведения программ ВРТ. Основную группу исследования составили 95 женщин с ВИЧ-инфекцией, контрольную – 96 серонегативных по ВИЧ пациенток. Выполнено 89 и 113 лечебных циклов соответственно. На этапе анализа исходов программы ЭКО были исключены 25 пациенток с коинфекцией гепатитом С и 19 конкордантных пар. Количественная оценка копийности мтДНК проведена в 78 и 111 образцах кумулюсных клеток соответственно. Критерии включения в основную группу: наличие ВИЧ-инфекции, 3 субклиническая, 4а, 4б, 4в стадии, фаза ремиссии; прием АРВТ, неопределяемая вирусная нагрузка в 2 последовательных исследованиях, сделанных с интервалом не менее 3 месяцев; информированное согласие на участие в настоящем исследовании. Критерии исключения: коинфекция вирусными гепатитами В, С, ВИЧ-положительный статус партнера. Критерии невключения: наличие противопоказаний к проведению ВРТ. Критерии включения в группу контроля: ВИЧ-серонегативный статус обоих супругов, селективный перенос одного эмбриона.
Статус пациенток по ВИЧ-инфекции оценивали на основании данных о стадии и фазе заболевания, уровнях вирусной нагрузки, CD4+, CD8+ лимфоцитов и длительности, а также составе АРВТ.
Стимуляцию суперовуляции проводили в протоколах с антагонистами гонадотропин-рилизинг-гормона (антГнРГ) с использованием препаратов рекомбинантного фолликулостимулирующего гормона и человеческого менопаузального гонадотропина. Для предотвращения паразитарного пика эндогенного ЛГ при достижении фолликулами диаметра 14–15 мм начиналось введение препарата антГнРГ в дозе 0,25 мг/сутки подкожно. Для финального созревания ооцитов назначали овуляторную дозу хорионического гонадотропина человека (ХГ) 10 000 МЕ при визуализации трех и более фолликулов ≥17 мм в диаметре. Аспирацию ооцитов осуществляли через 35–36 ч после введения триггера овуляции. Оплодотворение ооцитов проводилось методом ICSI. Перенос 1-го эмбриона производили на 3–5-е сутки культивирования, оставшиеся эмбрионы 1–2 степени качества были криоконсервированы. Поддержку посттрансферного периода осуществляли с помощью вагинального введения микронизированного прогестерона в суточной дозе 600 мг со следующего дня после пункции. Эффективность лечения оценивали по показателям частоты наступления беременности на перенос эмбрионов. Биохимическая беременность была диагностирована на 12–14-й день после переноса эмбрионов при концентрации β-субъединицы ХГ в сыворотке крови >20 МЕ/л. Клиническую беременность подтверждали при визуализации в полости матки плодного яйца, содержащего живой эмбрион, через 5–6 недель после переноса.
Исследование копийности мтДНК в клетках кумулюса проводилось по следующей методике: в асептических условиях с использованием инвертированного микроскопа клетки кумулюса отмывали в стерильном фосфатно-солевом буфере, а затем помещали в индивидуальные пробирки, содержащие данный буфер. Определение абсолютного числа копий мтДНК осуществляли с помощью метода полимеразной цепной реакции (ПЦР) в реальном времени. Для этого из клеток кумулюса выделяли ДНК. Клетки лизировали буфером с гуанидин тиоцианатом в течение 10 минут при температуре 65°С. После этого осуществляли осаждение ДНК изопропанолом в присутствии соосадителя путем центрифугирования образцов при 13 тыс. об./мин в течение 10 мин (набор «Проба-НК-плюс», ООО «ДНК-Технология», Россия). Далее осадок промывали двумя промывочными растворами, высушивали и ресуспендировали в 50 мкл элюирующего раствора. Для подсчета копий мтДНК проводили ПЦР в реальном времени с использованием олигонуклеотидов и TaqMan-проб для амплификации и количественного определения специфических фрагментов мтДНК (ген MT-ND2 – mitochondrially encoded NADH dehydrogenase 2 и ген MT-ND4 – mitochondrially encoded NADH dehydrogenase 4). Использование праймеров к гену MT-ND2 позволило оценить содержание тотального пула мтДНК (mtDNAtotal), а праймеров к гену MT-ND4 – содержание пула полноразмерной мтДНК, лишенной делеций (mtDNAdel-), в частности del mtDNA4977. TaqMan-пробы для фрагментов митохондриальной и геномной ДНК были помечены разными флуорофорами (FAM и HEX), что позволило проводить реакцию в одной пробирке (мультиплексная ПЦР) в двух повторах для каждого образца. Для обеспечения «горячего старта» использован парафин. В работе использованы реактивы, олигонуклеотиды и TaqMan-пробы и детектирующие амплификаторы «ДТпрайм» (ООО «ДНК-Технология», Россия). Режим амплификации: 80°С в течение 1 мин, инкубирование при 95°С в течение 1 минуты, а затем 50 циклов: 94°С в течение 15 с и 64°С в течение 20 с с измерением уровня флуоресценции на каждом цикле. Нормировка осуществлялась на геномную ДНК (ген LTC4S – leukotriene C4 synthase). Количество мтДНК относительно геномной определяли методом сравнения пороговых циклов (2∆Сt) и представляли в относительных единицах (о.е.) по формуле 1: mtDNA/gDNA = 2Ct gDNA – Ct mtDNA, где Ct gDNA – значение порогового цикла амплификации геномной ДНК, Ct mtDNA – значение порогового цикла амплификации мтДНК.
Статистическая обработка данных выполнена с использованием программы IPM SРSS Statistics, версия 22. При нормальном виде распределения данных определяли среднее значение со стандартным отклонением, для оценки различий в группах применяли методы параметрической статистики (t-тест). При распределении данных, отличном от нормального, определяли медиану и квартили (Ме (Q1;Q3)), для оценки различий в группах применяли методы непараметрической статистики (тест Манна–Уитни). Для сравнения категориальных данных, а также для оценки значимых различий между ними использовали тест χ2. Зависимые данные оценивались с помощью коэффициента корреляции Пирсона. Различия считали статистически значимыми при уровне достоверности p<0,05.
Результаты
Медиана возраста женщин с ВИЧ-инфекцией составила 34 года (31;37). «Стаж» заболевания – 8 лет (6;11), преобладала 3 субклиническая стадия (61,05%). Пациентки со стадиями заболевания 4а (32,63%), 4б (4,21%) и 4в (2,11%) находились в фазе ремиссии не менее 6 месяцев. У 25 из 95 (26,3%) ВИЧ-серопозитивных женщин наблюдалась коинфекция гепатитом С, у 19 (20%) – половой партнер также имел ВИЧ-положительный статус. Все пациентки получали комбинированную АРВТ, из них 84 (88,4%) – препараты группы НИОТ в сочетании с ингибиторами протеазы, 9 (9,5%) – НИОТ+ненуклеозидный ингибитор обратной транскриптазы и 2 (2,1%) – три препарата группы НИОТ. У 48 (50,5%) пациенток использовались НИОТ с высокой митохондриальной токсичностью (диданозин, ставудин, зидовудин), другие 52 (49,5%) – получали препараты с незначительным токсическим эффектом на митохондрии (фосфазид, ламивудин, абакавир, тенофовир, эмтрицитабин). Медиана продолжительности приема препаратов составила 4 года (2–6,5 года). Вирусная нагрузка в крови была неопределяемой в 100% случаев. Уровни CD4+ лимфоцитов (622,5 (446,7;808,7)), CD8+ лимфоцитов (741 (613;990)) свидетельствовали о «благополучном» состоянии иммунной системы.
Пациентки обеих групп были сопоставимы по возрасту (34 и 34 года; р=0,16), индексу массы тела (ИМТ) (22 и 22 кг/м2; р=0,62) длительности (6,9 и 5,2 лет; р=0,12) и факторам бесплодия (таблица). В структуре бесплодия в обеих группах преобладал трубно-перитонеальный фактор (49,5% и 44,8%; р=0,51). У 6 из 95 (6,3%) ВИЧ-серопозитивных пациенток не было диагностировано бесплодие, проведение программы ЭКО осуществлялось по эпидемиологическим показаниям.

Пациентки обеих групп были сопоставимы по количеству оперативных вмешательств на органах малого таза (60,9% и 76,5%; р=0,21), в том числе по частоте проведения операций на яичниках (21,1% и 24%; р=0,63). При этом обращает на себя внимание более низкая концентрация АМГ (1,5 и 3,5 нг/мл; р<0,001) в основной группе, по сравнению с серонегативными по ВИЧ пациентками.
Как результат, у пациенток с ВИЧ-инфекцией было получено меньшее количество ооцитов (Ме 6 (3;11) и 10 (7;15,5); р<0,001), эмбрионов на стадии дробления (Ме 4 (2;7) и 6 (4;10); р<0,0001) и бластоцист (Ме 1 (0;3) и 3 (1;6); p<0,0001) по сравнению с контрольной группой.
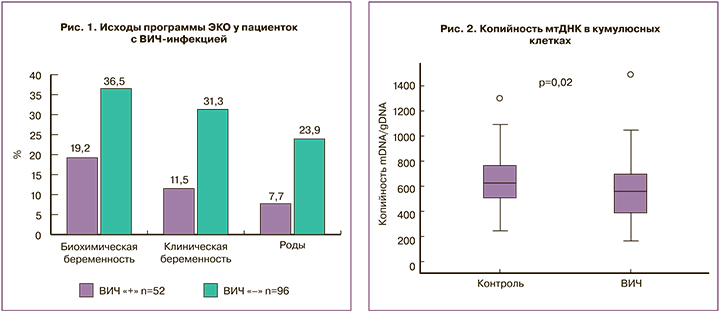
Оценка исходов программы ЭКО показала более низкую частоту биохимической (19,2% и 36,5%; р=0,03), клинической беременности (11,5% и 31,3%; р=0,008) и родов живым плодом (7,7% и 23,9%; р=0,007) у ВИЧ-инфицированных пациенток по сравнению с ВИЧ-серонегативными женщинами (рис. 1).
На следующем этапе работы мы провели анализ копийности мтДНК в 110 образцах кумулюсных клеток, полученных от женщин с ВИЧ-инфекцией, и в 111 – без ВИЧ-инфекции. При использовании обоих пар праймеров к генам MT-ND2 и MT-ND4 мтДНК получены идентичные результаты. Таким образом, делеции в регионе MT-ND2–MT-ND4 мтДНК не выявлены.
Было показано, что число копий мтДНК в клетках кумулюса у ВИЧ-инфицированных пациенток статистически значимо ниже, чем у женщин без ВИЧ-инфекции (566,7 (229,1) и 639,7 (197) о.е.; р=0,02) (рис. 2).
Оценка силы взаимосвязи не выявила корреляционной зависимости копийности мтДНК в кумулюсных клетках с возрастом пациенток в обеих группах (r=0,153; р=0,18 и r=0,164; р=0,08 соответственно), а также с длительностью бесплодия (r=0,300; р=0,07 и r=-0,041; р=0,67) и ИМТ (r=0,168; р=0,35 и r=0,260; р=0,09). В основной группе исследования число копий мтДНК в клетках кумулюса не зависело от «стажа» ВИЧ-инфекции (r=-0,132; р=0,26), уровня CD4+ (r=0,037; р=0,74) и CD8+лимфоцитов (r=0,020; р=0,91). При этом выявлена обратная зависимость уровня мтДНК в клетках кумулюса от длительности АРВТ (r=-0,228; р=0,04) (рис. 3).

Более того, при продолжительности АРВТ до 1 года копийность мтДНК в кумулусных клетках была сопоставима с контрольной группой (677,1 (292,7) и 639,7 (197,9) о.е.; р=0,46). При приеме АРВТ в течение от 1 года до 5 лет содержание мтДНК в кумулюсных клетках составило 505,3 (175) о.е., что было статистически значимо ниже, чем в контрольной группе (639,7 (197,9) о.е.; р=0,001). В случае длительности терапии более 5 лет этот показатель также был существенно ниже, чем в группе пациенток без ВИЧ-инфекции (522,7 (203,1) о.е.; р=0,04).
 Далее мы провели сравнительный анализ уровня мтДНК в кумулюсных клетках в зависимости от токсического эффекта НИОТ на митохондрии (рис. 4).
Далее мы провели сравнительный анализ уровня мтДНК в кумулюсных клетках в зависимости от токсического эффекта НИОТ на митохондрии (рис. 4).
Копийность мтДНК в кумулюсных клетках у пациенток, принимающих НИОТ с высокой митохондриальной токсичностью, была существенно ниже (554,6 (239,5) и 639 (197,9); р=0,04), а при использовании препаратов с незначительным токсическим эффектом на митохондрии – сопоставима со здоровым контролем (574,3 (224,6) и 639(197,9); р=0,06).
Обсуждение
Использование ВРТ решило много актуальных проблем пациентов с ВИЧ-инфекцией, включая способ реализации репродуктивной функции и профилактику инфицирования здорового партнера. Однако в данной группе больных наблюдается низкая эффективность программы ЭКО, что многие исследователи связывают с гонадотоксичным эффектом АРВТ за счет истощения мтДНК в ооцитах [5, 6, 8, 12]. Косвенным подтверждением негативного воздействия АРВТ на качество ооцитов является сопоставимая со здоровым контролем частота наступления беременности при использовании ооцитов донора [6, 15].
В данном исследовании пациентки с ВИЧ-инфекцией были в репродуктивном возрасте (34 года (31;37)), имели небольшой «стаж» заболевания – 8 лет (6;11) и в 100% случаев получали комбинированную АРВТ (4 года (2;6,5). Уровни CD4+ лимфоцитов (622,5 (446,7;808,7) в крови и неопределяемая вирусная нагрузка перед проведением программы ЭКО свидетельствовали о «благополучном» состоянии иммунной системы, несмотря на наличие ВИЧ-инфекции.
В структуре бесплодия в обеих группах преобладал трубно-перитонеальный фактор (49,5% и 44,8%; р=0,51), что у ВИЧ-инфицированных женщин можно объяснить большей частотой встречаемости инфекцией, передаваемых половым путем, и гнойно-воспалительных заболеваний органов малого таза у ВИЧ-инфицированных женщин по сравнению с пациентками без ВИЧ-инфекции. В исследованиях других авторов представлены аналогичные результаты [2, 5, 8].
Одним из факторов, которые, как известно, негативно влияют на исход циклов ВРТ, является высокий ИМТ пациентки. В нашей работе женщины с ВИЧ-инфекцией имели сопоставимый со здоровыми пациентками ИМТ (22 и 22 кг/м2; р=0,62). В литературе представлены противоречивые данные. Так, в исследовании Santulli et al. (2011) показано, что ВИЧ-инфицированные женщины имели более высокий ИМТ, чем ВИЧ-серонегативные пациентки (24,2 и 22,9, р=0,03) [16]. Nurudeen et al. (2013) напротив, показали, что ВИЧ-инфицированные пациентки и женщины без ВИЧ-инфекции имели аналогичный ИМТ [17].
Концентрация АМГ у женщин с ВИЧ-инфекцией, несмотря на то, что находилась в пределах нормативных значений, была существенно ниже (1,5 и 3,5 нг/мл; р<0,0001) по сравнению с серонегативными по ВИЧ пациентками. При этом обе группы были сопоставимы по возрасту (34 и 34 года; р=0,16) и числу оперативных вмешательств на яичниках (21,1% и 24%; р=0,63). Полученные данные могут свидетельствовать о гонадотоксичном эффекте ВИЧ и/или АРВТ в изучаемой группе женщин. Однако мы не можем разделить влияние ВИЧ и АРВТ на концентрацию АМГ, так как в данной работе препараты получали все пациентки. В настоящее время нет единой точки зрения, что ВИЧ-инфекция и/или АРВТ влияет на овариальный резерв. Так, исследования Ohl et al. (2010) показали, что у женщин с ВИЧ-инфекцией уровни АМГ были на 23% ниже, чем в контрольной группе [18]. В работе Scherzer (2015) концентрация АМГ была на 16% ниже при неопределяемой вирусной нагрузке и на 26% ниже – с определяемой вирусной нагрузкой по сравнению с неинфицированными женщинами. Полученные данные авторы связывают с влиянием самого вируса, поскольку была показана прямая зависимость уровня АМГ от уровня CD4+ лимфоцитов в крови [19].
У пациенток с ВИЧ-инфекцией было получено меньшее количество ооцитов (Ме 6 (3;11) и 10 (7;15,5); р<0,001), эмбрионов на стадии дробления (Ме 4(2;7) и 6 (4;10); р<0,001) и бластоцист (Ме 1(0;3) и 3(1;6); p<0,001) по сравнению с контрольной группой. Меньшее количество полученных ооцитов у женщин с ВИЧ-инфекцией можно объяснить исходно более низким уровнем АМГ.
Выявлена низкая частота биохимической (19,2% и 36,5%; р=0,03), клинической беременности (11,5% и 31,3%; р=0,008) и родов живым плодом (7,7% и 23,9%; р=0,007) у ВИЧ-инфицированных пациенток, по сравнению с ВИЧ-серонегативными женщинами. Полученные нами данные согласуются с результатами ряда других авторов [6, 15, 18]. Напротив, в исследованиях Martinet et al. (2006), Santulli et al. (2011), Nurudeen et al. (2013), Prisant et al. (2010) показано, что частота клинической беременности у женщин с ВИЧ-инфекцией была сопоставима с контрольной группой серонегативных по ВИЧ пациенток [16, 17, 20, 21]. Причина низкой эффективности остается до конца неясной. Обсуждается возможное негативное влияние АРВТ на митохондриальный потенциал ооцитов.
В нашем исследовании выявлен существенно более низкий уровень мтДНК в клетках кумулюса у женщин с ВИЧ-инфекцией по сравнению со здоровым контролем (566,7 (229,1) и 639,7 (197) о.е.; р=0,02). Полученными данными можно объяснить низкую частоту наступления беременности в программе ЭКО у ВИЧ-инфицированных женщин. Известно, что существует взаимосвязь между числом копий мтДНК, продукцией АТФ митохондриями и качеством ооцитов, а также потенциалом развития эмбрионов. При этом показано, что ооциты с меньшим количеством копий мтДНК имеют более низкую частоту оплодотворения [22].
Нами показана обратная зависимость числа копий мтДНК в кумулюсных клетках с длительностью АРВТ (r=-0,228; р=0,04). Полученные данные подтверждают сведения о том, что токсическое повреждение митохондрий зависит от продолжительности воздействия препаратов [23]. Более того, число копий мтДНК в клетках кумулюса начинало снижаться после 1 года АРВТ. Аналогичные результаты были представлены в исследованиях Masyeni S. et al. (2018) [24], Dai Z. et al. (2015) [25] при изучении содержания мтДНК в плазме и мононуклеарных клетках периферической крови. Авторами было показано снижение мтДНК после 12 месяцев АРВТ препаратами НИОТ [25].
Важно отметить, что препараты группы НИОТ существенно отличаются друг от друга по выраженности токсического действия на митохондрии. Так, абакавир и ламивудин значимо менее токсичны, чем зидовудин, ставудин или диданозин, а зальцитабин, ввиду высокой токсичности, вовсе перестали применять [26]. У более современных НИОТ, рекомендованных в первой линии терапии (тенофовир, абакавир, эмтрицитабин, ламивудин) проявления митохондриальной токсичности минимальны. Важно подчеркнуть, что антиретровирусные препараты с высокой митохондриальной токсичностью специалисты в области лечения ВИЧ-инфекции в настоящее время не рекомендуют к использованию в схемах АРВТ. Исключение – зидовудин, который пока остается рекомендованным в некоторых случаях [27, 28].
В нашей работе каждая вторая (50,5%) пациентка принимала препараты НИОТ с известной высокой токсичностью на митохондрии. Как результат, в этой группе женщин копийность мтДНК в клетках кумулюса была значительно ниже, чем в контроле (554,6 (239,5) и 639 (197,9); р=0,04), а при использовании препаратов с незначительным токсическим эффектом на митохондрии – сопоставима со здоровым контролем (574,3 (224,6) и 639 (197,9); р=0,06).
Заключение
Таким образом, бесплодие у ВИЧ-инфицированных женщин чаще обусловлено трубно-перитонеальным фактором. В данной группе пациенток отмечено снижение концентрации АМГ как результат при проведении программы ЭКО – меньшее число ооцитов и эмбрионов. Наблюдается низкая частота наступления беременности и живорождении, обусловленная, вероятно, гонадотоксичными эффектами АВРТ на функцию митохондрий ооцитов и зависящая от продолжительности терапии. Пациенткам с ВИЧ-инфекцией не следует откладывать реализацию репродуктивной функции, и при достижении неопределяемого уровня вирусной нагрузки показано проведение программы ЭКО по эпидемиологическим показаниям или с целью лечения бесплодия. При назначении АРВТ следует отдавать предпочтение препаратам с известной меньшей токсичностью на митохондрии. ВИЧ-инфицированным женщинам, откладывающим реализацию репродуктивной функции, при достижении неопределяемого уровня вирусной нагрузки в крови необходимо рассмотреть возможность проведения программы ЭКО с криоконсервацией ооцитов/эмбрионов.



