В зависимости от вида внутриматочной патологии (ВП) различают реконструктивные и деструктивные гистероскопические операции. Реконструктивные способы коррекции ВП (резекция субмукозной миомы, резекция полипов, рассечение внутриматочных перегородок, синехиолизис) восстанавливают анатомию и нормальную физиологию матки [1, 2].
Деструктивный электрохирургический метод – абляция эндометрия предполагает разрушение патологически измененных тканей матки с радикальным удалением патологического очага [2, 3]. Как коагуляционный, так и режущий токи, проходящие по петле резектоскопа или шариковому электроду, могут вызывать термический некроз глубиной до 4 мм.
Применение высокочастотной монополярной деструкции эндометрия в диэлектрической среде расширения полости матки в настоящее время соответствует большинству требований, предъявляемых к малоинвазивным методам лечения. Однако сохраняется риск возникновения осложнений, обусловленных попаданием в сосудистое русло жидкости, расширяющей полость матки, которая может привести к гипонатриемии с последующим отеком мозга, легких, аллергическому шоку [3].
Избыточная интравазация жидкости диэлектрика – гипонатриемия – гипергидратация (ГГ) – одно из интраоперационных осложнений гистероскопии [3, 4].
Даже при интактном эндометрии в результате механического напряжения, возникающего на границе миометрия и базального слоя эндометрия как следствие сжатия стенки матки, нарушается целостность стенки сосуда, прилежащего к просвету эндометриальной железы, что приводит к образованию сообщения между полостью матки и просветом сосуда. В качестве примера могут служить многочисленные факты маточно-венозного рефлюкса водорастворимого рентгеноконтрастного вещества, наблюдаемые при повышенном внутриматочном давлении во время проведения гистеросальпингографии [4, 5]. Не вызывает сомнения тот факт, что в случае нарушения целостности венозной сети миометрия при оперативном вмешательстве интравазация жидкости из полости матки будет значительно больше, чем при интактном эндомиометрии [5–7].
 Попадание в системный кровоток значительного количества орошающей жидкости быстро приводит к интерстициальному и альвеолярному отеку легких, особенно при сниженном сердечном резерве. В силу гипотоничности растворов развивается также острая ГГ, которая проявляется выраженными неврологическими нарушениями. Обычно симптомы гипонатриемии не появляются до тех пор, пока концентрация натрия в плазме не снизится <120 мэкв/л. Всасывание веществ, применяемых для растяжения полости матки, растворенных в жидкостях, сопровождается риском интоксикации [7, 8].
Попадание в системный кровоток значительного количества орошающей жидкости быстро приводит к интерстициальному и альвеолярному отеку легких, особенно при сниженном сердечном резерве. В силу гипотоничности растворов развивается также острая ГГ, которая проявляется выраженными неврологическими нарушениями. Обычно симптомы гипонатриемии не появляются до тех пор, пока концентрация натрия в плазме не снизится <120 мэкв/л. Всасывание веществ, применяемых для растяжения полости матки, растворенных в жидкостях, сопровождается риском интоксикации [7, 8].
В связи с этим возникает необходимость в строгом учете дефицита жидкости. Безопасным считают количество «потерянной» жидкости, не превышающее 1500 мл [8, 9]. Тем не менее, по данным разных авторов, перегрузка сосудистого русла жидкостью (интравазация свыше 2000 мл) встречается в 1–5% случаев [9, 10]. При превышении допустимого количества абсорбируемой жидкости с целью предотвращения критического состояния оперируемых пациенток авторы рекомендуют начать введение солевых гипертонических растворов и диуретиков, не ожидая появления ранних симптомов ГГ [7, 10, 11].
По данным литературы, при применении монополярной электрохирургической технологии наиболее часто используют 1,5% глицина и 5% раствор глюкозы. При биполярной электрохирургии возможно применение 0,9% раствора натрия хлорида, наиболее полно отвечающего требованиям электроэндохирургии [7].
Биполярная электроэндохирургия практически исключает возможность возникновения осложнений, связанных с избыточным попаданием жидкости в сосудистое русло оперируемой. Значительная интравазация физиологического раствора (более 4000 мл) может стать причиной развития гиперхлоремического ацидоза, возникающего в результате быстрого увеличения объема внеклеточной жидкости, что не требует специфической терапии [7, 12].
При отсутствии противопоказаний возможно интраоперационное введение вазопрессина, утеротонический эффект которого длится около 20 минут. Рекомендуемая схема: 10 ед. вазопрессина разводят в 80 мл физиологического раствора и вводят по 10 мл полученного раствора в проекции 3 и 9 ч воображаемого циферблата, всего 2,5 ед. [13, 14]. В литературе опубликованы данные, согласно которым риск развития ГГ у пациентов, получавших вазопрессин, был в 1,5 раза меньше, чем у пациентов, получавших плацебо [13] .
Несвоевременное начало терапии может привести к серьезным последствиям. Так, в мировой литературе описаны случаи летальных исходов абляции эндометрия, осложнившихся ГГ энцефалопатией [13, 14].
Проведенный анализ литературных данных, посвященных использованию сред расширения в электрохирургии ВП, показывает, что в настоящее время нет безопасного во всех отношениях метода гистерорезектоскопической деструкции эндометрия.
Целью исследования стало определение частоты и совершенствование методов профилактики избыточной интравазации жидкости диэлектрика ГГ у больных с ВП.
Материал и методы исследования
Частота ГГ при гистерорезектоскопических вмешательствах изучалась нами у 550 пациенток с ВП (субмукозная миома матки, полипы эндометрия, внутриматочные синехии, патологические маточные кровотечения). Основными жалобами, предъявляемыми пациентками, были кровяные выделения из половых путей. Так, жалобы на 2–3-кратные кровяные выделения из половых путей предъявляли 442 (80,3%) пациентки, 108 (19,7%) из которых жаловались на многократные кровяные выделения со снижением показателей гемоглобина крови, что заставило их обратиться в лечебное учреждение.
Все пациентки для проведения операции поступали в стационар. В предоперационном периоде проводилось общеклиническое обследование, включающее определение групповой принадлежности и резус-фактора крови, клинический анализ крови, биохимические показатели с обязательным определением Na+ и К+ сыворотки крови, анализ крови на ВИЧ, HBS и HCV-антиген, реакцию Вассермана, общий анализ мочи и анализ выделений из влагалища на степень чистоты, рентгенологическое исследование грудной клетки, электрокардиографию. Все женщины были осмотрены терапевтом, консультированы врачами смежных специальностей (при необходимости).
Сопутствующими заболеваниями страдали 545 (99%) пациенток. Нередко выявлялось сочетание нескольких заболеваний. В табл. 1 представлены данные об экстрагенитальных заболеваниях.
 Трансвагинальное ультразвуковое исследование, как наиболее информативное в плане выявления патологических процессов в матке и придатках, применялось нами на этапах дооперационного исследования, интраоперационно и в послеоперационном периоде. Возможности трансвагинальной эхографии патологических процессов расширялись за счет проведения жидкостного контрастирования полости матки (гидросонография, эхогистерография).
Трансвагинальное ультразвуковое исследование, как наиболее информативное в плане выявления патологических процессов в матке и придатках, применялось нами на этапах дооперационного исследования, интраоперационно и в послеоперационном периоде. Возможности трансвагинальной эхографии патологических процессов расширялись за счет проведения жидкостного контрастирования полости матки (гидросонография, эхогистерография).
Для внутриматочной хирургии мы использовали 9 мм резектоскоп с телескопом диметром 4 мм и углами обзора в 00 и 120. Подобный набор телескопов обеспечивает гарантированную визуализацию всех отделов полости матки по ходу вмешательства. Конструкция 9 мм гистерорезектоскопа, наряду с использованием телескопа диаметром 4 мм, рассчитана на применение электродов наибольшего размера, что позволяет быстрее проводить деструкцию больших по площади и объему патологических образований.
Для проведения внутриматочных вмешательств мы применяли универсальный электрогенератор номинальной мощностью в 300 Вт, с возможностью включения режимов резания и коагуляции раздельно – сдвоенной педалью. При этом величина интенсивности воздействия, а именно выходная мощность в различных «чистых» и «смешанных» режимах, устанавливаются на панели управления. Генератор должен обеспечивать мощность 100–130 Вт для «чистой» и «смешанной» резки миоматозных узлов и эндометрия, 50 Вт для петлевой коагуляции, 70–100 Вт для шариковой коагуляции эндометрия и 250–300 Вт для вапоризации миоматозных узлов и эндометрия.
При применении монополярной электрохирургической технологии для расширения полости матки использовали жидкость-диэлектрик – 5% раствор глюкозы. В газовой среде осуществляли только точечные и локальные электрохирургические воздействия при выходной мощности генератора не более 40 Вт в режиме «коагуляция».
Величина интравазации жидкости, расширяющей полость матки, зависела от:
- Интраоперационного внутриматочного давления;
- Продолжительности вмешательства;
- Площади «всасывающей поверхности».
Потеря жидкости, поступающей по трубам в брюшную полость, минимальна и даже при длительных (40–60 мин) вмешательствах не превышает 100–150 мл.
Из брюшной полости жидкость легко может всасываться брюшиной, а для того чтобы предупредить дополнительную гипергидратацию организма, она может быть эвакуирована из брюшной полости под лапароскопическим или ультразвуковым контролем.
Морфологические исследования биоптатов и операционного материала проводились в патологоанатомическом отделении ГКБ им. С.П. Боткина.
Обработку полученных данных выполняли с помощью пакета программ Statistica for Windows 6.0 Stat-Soft.
Результаты исследования и обсуждение
Проведя гистерорезектоскопические вмешательства у 550 пациенток в возрасте от 18 до 80, лет мы ни в одном случае не наблюдали возникновения ГГ.
Объем жидкости, затраченной в нашем исследовании на проведение гистерорезектоскопии, в среднем колебался от 4,0 до 8,0 л. Чем длительнее оперативное вмешательство (что чаще было связано с его сложностью или недостаточным опытом хирурга), тем более актуальной становилась необходимость подсчета потери жидкости. При этом потерянное количество жидкости в брюшную полость составило не более 200 мл.
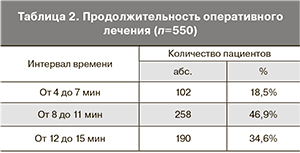
Продолжительность основного этапа оперативного вмешательства (от момента введения гистероскопа до окончания резекции) составила от 4 до 15 мин. Продолжительность оперативного лечения составила при применении резекционной технологии 30–35 мин. Риск ГГ увеличивается с длительностью операции. Продолжительность «чистого» времени расширения полости матки не должна превышать 30 мин.
В табл. 2 представлены данные о продолжительности оперативного лечения.
Кровопотеря ни в одном случае не превышала 50 мл.
Следует отметить, что ГГ может развиться и в первые часы после окончания вмешательства [15].
В связи с чем в проведенном нами исследовании после манипуляции все пациентки в течении 30 мин наблюдались анестезиологом, затем переводились в палату под наблюдение персонала отделения. К этому времени пациентки находились в сознании и адекватно ориентировались. Общее состояние больных не претерпело каких-либо изменений. Через 4–6 ч после операции все больные самостоятельно себя обслуживали и принимали стандартную поддерживающую терапию в соответствии с имеющейся у них экстрагенитальной патологией.
Оптимальное давление в полости матки для проведения гистерорезектоскопии, по нашему мнению, составляет 40–100 мм рт. ст. При давлении выше 100 мм рт. ст. увеличивается риск интравазации раствора и заброс его в брюшную полость через маточные трубы. Рабочее давление, достаточное для визуализации и работы в полости матки, устанавливалось нами индивидуально с помощью кранов притока и оттока на гистероскопе.
Важным аспектом проведения гистерорезектоскопии является тщательный контроль расхода используемой жидкости. Контроль над расходом жидкости нами осуществлялся благодаря электронным весам, на которые поступает жидкость, оттекающая из полости матки (аспирированная через гистерорезектоскоп и стекающая через пространство между стенкой цервикального канала и наружным тубусом резектоскопа). Разница между этим количеством и общим количеством расходуемой жидкости расценивается аппаратом как «потерянная», то есть та, которая попала в сосудистое русло и через проходимые маточные трубы в брюшную полость. Для удобства хирурга показатели дефицита жидкости выносятся на экран монитора.
Необходимо обращать внимание на абсолютное ограничение количества жидкости, попавшей в сосудистое русло, при достижении которого операция должна быть остановлена. Обычно этот объем составляет 10–15 л с учетом потери в брюшную полость не более 200 мл за 30 мин.
В проведенном нами исследовании мы обращали пристальное внимание на расширение цервикального канала. Накануне любой гистероскопической процедуры целесообразно установить в цервикальный канал ламинарию длиной 2 или 4 мм для эффективного расширения шейки матки и обеспечения свободного оттока жидкости по цервикальному каналу (в таком случае сложно превысить необходимое давление в полости матки).
В процессе гистерорезекции интравазация может увеличиваться или уменьшаться. Так, при коагуляции эндометрия в результате облитерации сосудов скорость интравазации (количество жидкости в единицу времени) уменьшается. В то же время, при резекции миоматозных узлов или резекции эндо- и миометрия в результате нарушения целостности сосудов миометрия скорость интравазации по ходу операции может значительно увеличиваться.
При интравазации более 1500 мл вмешательство прекращалось, затем определялся уровень натрия в крови и проводились следующие мероприятия:
- Катетеризация мочевого пузыря;
- Внутривенное введение диуретиков;
- Мониторинг ЭКГ;
- Почасовой мониторинг калия/натрия в крови до нормализации показателей;
- Внутривенная инфузия 0,9% раствора хлорида натрия;
- При манифестных формах ГГ – мониторинг центрального венозного давления, повышение натрия в крови 1–2 ммоль/час < 12 ммоль/24 ч, медленное введение 20–40 мл 20% хлорида натрия.
В своей практической деятельности мы придерживаемся следующих принципов профилактики ГГ при использовании 5% раствора глюкозы:
- Предоперационная подготовка больных, направленная на уменьшение кровоснабжения матки (атрофизация эндо- и миометрия);
- Проведение вмешательства на минимально допустимых, обеспечивающих оптимальный доступ цифрах внутриматочного давления (практическая деятельность показала, что эти цифры находятся в пределах 90–120 мм рт. ст.);
- На первом этапе операции в течение 5–10 мин определяется начальная скорость интравазации жидкости, как правило, 10–50 мл/мин;
- С учетом начальной скорости интравазации и мониторинга допустимого критического объема интравазации в 1500 мл, требующего немедленного прекращения операции, определяется предполагаемый объем вмешательства и техника его выполнения;
- По ходу вмешательства, при отсутствии противопоказаний, могут применяться препараты, обладающие утеротоническим-вазопрессивным эффектом («Реместип»);
- Адекватный объем радикального хирургического лечения при достижении критических цифр интравазации обеспечивается этапными отсроченными внутриматочными вмешательствами.



