Инсульт является ведущей причиной инвалидности во всем мире. По результатам статистического анализа, в Российской Федерации частота инсульта является одной из самых высоких в мире и составляет 3-3,4 на 1000 человек в год, т.е. более 490 тыс. новых инсультов в год [1]. Особую тревогу вызывает высокая распространенность цереброваскулярных заболеваний в трудоспособном возрасте – 20% [2, 3].
Данные о частоте церебральных кровоизлияний во время беременности неоднозначны. По данным разных авторов инсульт во время гестации представляет собой достаточно редкое явление, причем в разных источниках показатели колеблются от 4,2 до 210 на 100 тыс. родов [4]. Приблизительно от 12 до 35% случаев инсультов у лиц в возрасте от 15 до 45 лет связано с беременностью [5].
Факторами риска развития острого нарушения мозгового кровообращения (ОНМК) являются: артериальная гипертензия (АГ), заболевания клапанов сердца, протезированные клапаны сердца, васкулиты, наследственные заболевания соединительной ткани (синдромы Марфана, Элерса-Данло и др.) [6–8]. АГ (как существовавшая до беременности, так и гестационная) рассматривается многими исследователями в качестве значимого фактора риска геморрагического инсульта (ГИ) у беременных. Показано что у женщин с беременностью, осложненной АГ, риск развития инсульта в 6–9 раз выше по сравнению с пациентками, у которых артериальное давление (АД) находится в пределах нормы [9].
 Основными причинами ГИ является разрыв артериальных аневризм (АА) и артериовенозных мальформаций (АВМ), кавернозных мальформаций (КМ) – 4% и 5–7% [4, 10, 11]. В числе редко встречающихся, но, тем не менее, важных причин ГИ у беременных также называют синус тромбоз (СТ). Частота инсультов, связанных с данной патологией, не превышает 2% [12, 13].
Основными причинами ГИ является разрыв артериальных аневризм (АА) и артериовенозных мальформаций (АВМ), кавернозных мальформаций (КМ) – 4% и 5–7% [4, 10, 11]. В числе редко встречающихся, но, тем не менее, важных причин ГИ у беременных также называют синус тромбоз (СТ). Частота инсультов, связанных с данной патологией, не превышает 2% [12, 13].
Следует отметить, что в настоящее время отсутствует единый взгляд на ведущие причины ГИ во время беременности. В разных исследованиях авторы выделяют различные этиологические факторы. Так, по мнению S. Treadwell с соавт., ГИ во время гестации примерно с равной частотой обусловлен сосудистыми аномалиями (21%), наличием преэклампсии/эклампсии (14%), сосудистой патологией центральной нервной системы (14%) [14]. По мнению других авторов, преэклампсия/эклампсия является ведущей причиной ГИ в 31% случаев, а наличие сосудистых аномалий – у 7% пациенток [10]. Противоречивы и данные других исследователей [15].
Несмотря на многочисленные исследования, вопросы, касающиеся ведения беременности, методов обследования и родоразрешения, далеки от разрешения. Все вышеизложенное и послужило основанием для проведения данной работы.
Цель исследования: изучить факторы риска, течение беременности и разработать тактику оптимизации родоразрешения у женщин с ГИ.
Материал и методы исследования
Нами был проведен ретроспективный и проспективный анализ течения беременности, родов и перинатальных исходов у 41 беременной женщины с ГИ. В соответствии с целью работы, были сформированы группы исследования: 1-я группа – 7 женщин, которые перенесли ГИ во время данной беременности, 2-я группа – 34 беременных с ГИ в анамнезе. Поскольку развитие инсульта и формирование геморрагий связано со многими причинами, в группах мы дополнительно выделили: 1а и 2а подгруппы – пациентки с разрывом АА головного мозга; 1б и 2б подгруппы – пациентки с разрывом АВМ , 1в и 2в подгруппы – беременные с разрывом КМ; 1г и 2г подгруппы – пациентки с СТ; 1д и 2д подгруппы – беременные с ГИ неустановленной этиологии.
Всем пациенткам проводилось лабораторное обследование, которое, наряду с общеклиническими методами, включало исследование системы гемостаза (стандартная коагулограмма, тромбоэластометрия и тромбодинамика), обследование на наследственные тромбофилии (генетический полиморфизм генов FV Leiden, MTHFR, PAI I 4G/5G, ACE, F II G20210A). Проводилось инструментальное обследование – магниторезонансная (МРТ) и компьютерная томография (КТ).

Все женщины были консультированы акушером-гинекологом, нейрохирургом, неврологом, офтальмологом и анестезиологом. В результате совместно вырабатывался план ведения беременности, выбирался метод родоразрешения и анестезии. Пациенткам с высоким риском развития тромботических осложнений проводилась коррекция системы гемостаза с применением гепарина, фраксипарина, клексана, назначались антиагреганты. Перинатальный исход оценивался по характеру течения раннего неонатального периода.
Статистическая обработка результатов проводилась в офисной программе Microsoft Office Excel-2010. Достоверность выявленных различий изучаемых показателей оценивали с помощью критерия Манна–Уитни. Отличие считали статистически достоверным при р<0,05.
 Результаты исследования и их обсуждение
Результаты исследования и их обсуждение
Все женщины, включенные в исследование, находились в возрасте от 20 до 40 лет. Средний возраст составил 28,20±4,68 года. Достоверных различий по возрасту между группами исследования выявлено не было. В 1-й группе первородящих было 57,1% (n=4), повторнородящих – 42,9% (n=3), во 2-й группе – 50% (n=17) и 50% (n=17) соответственно.
По данным ретроспективного анализа у повторнородящих женщин 1-й группы (n=3) предыдущие беременности протекали без осложнений, и закончились срочными самопроизвольными родами. Ни в одном наблюдении не заригестрирован ГИ, несмотря на наличие нескольких сочетанных факторов риска развития церебральных осложнений: АГ, открытое овальное окно и врожденная тромбофилия, которые были диагностированы только во время настоящей беременности.
По поводу перенесенного кровоизлияния оперативное лечение потребовалось в 22 наблюдениях в обеих группах: в 20 – до наступления настоящей беременности, у 2 беременных – во время беременности в сроке гестации 19 и 21–22 недели. Объем оперативного вмешательства был следующим: трепанация черепа с удалением внутримозговой гематомы (ВМГ) (n=10), клипирование АА/АВМ (n=9), эмболизация АА/АВМ (n=5), иссечение/удаление аномалии развития сосудов головного мозга (n=6). У четырех женщин (одна повторнородящая и три первородящие) до беременности были диагностированы субарахноидальные кровоизлияния (САК) (<30мл), не требующие оперативного вмешательства, проводилось консервативное лечение. В одном наблюдении после иссечения и эмболизации АВМ проводилась лучевая терапия, учитывая расположение АВМ в подкорковых ядрах, в 2 наблюдениях применялась радиохирургия.
Течение предыдущей беременности у 9 пациенток 2 группы из 17 имело осложнения: ранний токсикоз (n=3), угроза прерывания беременности (n=2), фето-плацентарная недостаточность (n=1), гестоз легкой и средней степени тяжести (n=3). Предыдущие роды у 10 (58,8%) беременных 2 группы закончились операцией кесарева сечения (КС), у 7 – произошли срочные самопроизвольные роды. Показаниями к КС у 9 из 10 пациенток явилось наличие ОНМК в анамнезе: спонтанный ГИ (n=3), оперированная АА, АВМ, КМ (n=6). Еще в одном наблюдении у пациентки в 21–22 недели гестации произведено малое КС по поводу разрыва АВМ лобно-теменной области.
 Остаточные явления перенесенного ГИ наблюдались у 22 (64,7%) женщин 2-й группы, преимущественно в виде двигательных нарушений: монопарезы – в 2 наблюдениях (5,9%), гемипарезы – в 6 (17,6%), гипестезии у 2(5,9 %) и аносмии у 1 (2,9%).
Остаточные явления перенесенного ГИ наблюдались у 22 (64,7%) женщин 2-й группы, преимущественно в виде двигательных нарушений: монопарезы – в 2 наблюдениях (5,9%), гемипарезы – в 6 (17,6%), гипестезии у 2(5,9 %) и аносмии у 1 (2,9%).
6 женщин с сосудистыми аномалиями головного мозга страдали симптоматической эпилепсией (14,6%), пять из них с АВМ головного мозга, одна с КМ, по поводу которой в течение беременности проводилась антиконвульсантная терапия с коррекцией дозы препарата с увеличением срока беременности.
При осмотре офтальмологом была выявлена патология органа зрения как следствие перенесенного ГИ – ангиопатия сетчатки у 14,7% пациенток (n=5), периферическая хориоретинальная дистрофия – у 5,9% (n=2), атрофия зрительного нерва – у 2,9 % (n=1), горизонтальный нистагм – у 2.9% (n=1), гомонимная гемианопсия – у 8,9% (n=3) пациенток. В результате ни в одном наблюдении не было зарегистрировано рецидива ГИ во время настоящей беременности или в послеродовом периоде.
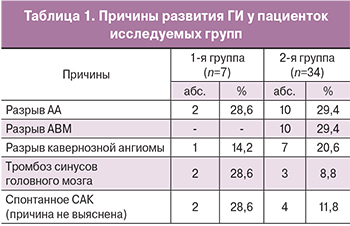
Изучение соматического статуса у пациенток обеих групп позволило установить, что все они страдали различными экстрагенитальными заболеваниями. Наиболее часто встречалась АГ – у 41,5% (n=17) пациенток, на втором месте была сочетанная тромбофилия – в 39% (n=16) наблюдений. Непосредственные причины развития ГИ у пациенток представлены в табл. 1.
Из данных таблицы следует, что ведущей причиной ГИ был разрыв АА – в целом он обусловил развитие инсульта у 29,3% (n=12) больных, АВМ – у 24,4 % (n=10). Следующей по частоте причиной была КМ – 19,51% (n=8) пациенток, СТ явился причиной ГИ у 12,2% (n=5). В 14,6 % (n=6) наблюдений причина инсульта не установлена. По данным современной литературы именно АГ и сосудистую патологию головного мозга относят к основным этиологическим факторам, которые вызывают инсульт у беременных [4, 16].
При оценке течения настоящей беременности было выявлено, что у всех пациенток 1-й группы и большинства пациенток 2-й группы отмечались осложнения (рис. 1).
Практически все осложнения беременности чаще отмечались в 1-й группе (при р<0,05). Основными жалобами у пациенток 1-й группы были: интенсивная головная боль, гипертензия, рвота, расстройство зрения, потеря сознания вплоть до комы. Так как данные жалобы являются характерными и для осложнений гестации (ранние токсикозы, преэклампсия/эклампсия), для дифференциальной диагностики имеют решающее значение методы нейровизуализации (МРТ, КТ, церебральная ангиография). Применение этих методов исследования во время беременности дискутабельно, из-за возможного тератогенного действия облучения на плод [16, 17]. Однако лучевая доза во время этих процедур с экранизацией живота эквивалентна фоновой среднегодовой, а диагностическая польза методов нейровизуализации превышает потенциальный тератогенный риск [18].
До наступления настоящей беременности, а также во время гестации у большинства женщин 1-й и 2-й группы – 100% (n=7) и 85% (n=29) соответственно, было проведено инструментальное обследование с целью уточнения локализации кровоизлияний, а также оценки динамики процесса. В результате было выявлено, что наиболее часто имело место САК – 34% (n=14) и ВМГ – 29% (n=11). По сравнению с исходными данными во время данной беременности ни в одном наблюдении не отмечена отрицательная динамика, патологический очаг при нейровизуализации не выявлялся, не выявлена и аномалия развития у новорожденных. Эти сведения можно расценивать в качестве неоспоримого свидетельства о необходимости применения методов нейровизуализации с целью диагностики цереброваскулярной патологии во время гестации.
 Что касается сроков развития ГИ у пациенток 1-й группы, то каких-либо закономерностей выявлено не было. В двух наблюдениях событие произошло в I триместре, в трех – во II, и у двух женщин – в III триместре беременности. Наши данные противоречат литературным данным, согласно которым, большинство инсультов у беременных встречается в III триместре и послеродовом периоде, по разным данным – от 76 до 89% всех инсультов у беременных [6, 12, 17, 19]. Всем пациенткам по показаниям проводилась стандартная терапия, направленная на лечение преэклампсии, пролонгирование беременности, улучшение функции фетоплацентарного комплекса, профилактика тромботических осложнений, применяли гепарин и низкомолекулярные гепарины. Длительность применения препарата зависела от нарушений в системе гемостаза и продолжалась до нормализации показателей. С целью предотвращения нежелательного эффекта антикоагулянтов за 24 часа до родоразрешения препарат отменяли, возобновляя прием через 4–6 часов после родоразрешения. Необходимо отметить, что в остром периоде ГИ применение антикоагулянтов противопоказано.
Что касается сроков развития ГИ у пациенток 1-й группы, то каких-либо закономерностей выявлено не было. В двух наблюдениях событие произошло в I триместре, в трех – во II, и у двух женщин – в III триместре беременности. Наши данные противоречат литературным данным, согласно которым, большинство инсультов у беременных встречается в III триместре и послеродовом периоде, по разным данным – от 76 до 89% всех инсультов у беременных [6, 12, 17, 19]. Всем пациенткам по показаниям проводилась стандартная терапия, направленная на лечение преэклампсии, пролонгирование беременности, улучшение функции фетоплацентарного комплекса, профилактика тромботических осложнений, применяли гепарин и низкомолекулярные гепарины. Длительность применения препарата зависела от нарушений в системе гемостаза и продолжалась до нормализации показателей. С целью предотвращения нежелательного эффекта антикоагулянтов за 24 часа до родоразрешения препарат отменяли, возобновляя прием через 4–6 часов после родоразрешения. Необходимо отметить, что в остром периоде ГИ применение антикоагулянтов противопоказано.
Серьезную проблему представлял выбор тактики лечения ГИ у пациенток 1 группы. В пяти наблюдениях из семи предпочтение было отдано консервативному лечению, и лишь в двух наблюдениях по поводу разрыва АА было проведено хирургическое лечение во время беременности – клипирование АА. По данным литературы примерно 30% больных с АА погибают от первого кровоизлияния; еще около 25–30% – от последствий вазоспазма или выздоравливают, но со стойким неврологическим дефицитом [20]. В ряде современных публикаций при разрывах АА у беременных считается возможным проведение нейрохирургического клипирования или эндоваскулярной ее облитерации в условиях нейрохирургического центра [21]. Другие авторы считают, что и консервативное лечение может быть вполне эффективным [6]. В качестве иллюстрации справедливости этого утверждения приведем несколько клинических примеров.
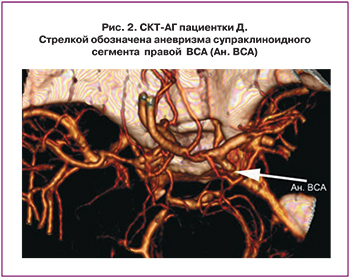
Пациентка Д., 32 года. С детства беспокоили головные боли при учебной нагрузке. С 2001 года после первой беременности периодически отмечала повышение АД до 175/100 мм рт. ст. Обследована по месту жительства: гипотензивную терапию получала эпизодически. Акушерский анамнез: Беременность 3-я. 1-я беременность в 2001г закончилась срочными самопроизвольными родами. Родилась девочка 3600 гр., здорова. 2-я беременность в 2006 г. – самопроизвольный выкидыш в 8 недель гестации. I триместр беременности протекал без осложнений. В 24 недели гестации, ночью появилась интенсивная головная боль, повышение АД до 160/100 мм. рт. ст. с кратковременной утратой сознания с последующей амнезией на событие в течение суток. На машине скорой помощи доставлена в родильное отделение центральной районной больницы по месту жительства с диагнозом: Беременность 24 недели. Тяжелая преэклампсия на фоне гипертонической болезни I–II ст. В условиях стационара начата интенсивная терапия (сернокислая магнезия, спазмолитические, седативные, гипотензивные препараты). На 3-и сутки в связи с ухудшением состояния переведена в реанимационное отделение. Произведена люмбальная пункция: получен геморрагический ликвор. Проводилось консервативное интенсивное лечение инсульта соответственно стандартам и на 10-е сутки после САК переведена в НИИ нейрохирургии им. Н.Н. Бурденко. Произведена КТ: гематома 80 мл в передних отделах боковых цистерн, арахноидальная киста в левой лобной области. При СКТ-АГ (спиральная компьютерная томография – ангиография) – разрыв АА супраклиноидного сегмента правой внутренней сонной артерии (ВСА) (рис. 2). Произведена операция: клипирование АА супраклиноидного сегмента ВСА справа. Получала стандартную терапию (сернокислая магнезия, актовегин, пентоксифиллин, витамины, магне В6, нифедипин). На фоне проводимого лечения неврологическая симптоматика регрессировала, АД стабилизировалось на цифрах 120–125/75–80 мм. рт. ст. На 12-е сутки после операции переведена в МОНИИАГ для динамического наблюдения. Выписана через 2 недели. Повторная госпитализация в МОНИИАГ при сроке 38 недель. Произведено КС в условиях перидуральной анестезии. Родилась доношенная девочка весом 3000 г/48 см, с оценкой состояния по шкале Апгар 8 и 9 баллов. Выписана домой в удовлетворительном состоянии с рекомендациями.
 Пациентка Р., 37 лет, в течение 14 лет страдает гипертонической болезнью (максимальные цифры АД 140/90 мм рт. ст.), наблюдалась у терапевта. Постоянную гипотензивную терапию не получала. Данная беременность четвертая. В анамнезе 1 медицинский аборт в 6–7 недель и неразвивающаяся беременность в 11–12 недель, одни срочные самопроизвольные роды. Родилась девочка весом 3980 г, здорова. Данная беременность наступила спонтанно, встала на учет в женской консультации в 14 недель. В 19 недель на фоне АГ (АД 160/100 мм рт.ст.) возникла резкая сильная головная боль, многократная рвота, сознание при этом не теряла. Госпитализирована бригадой скорой помощи в центральную районную больницу по месту жительства с диагнозом: Беременность 19 недель. Преэклампсия. АГ. Произведена люмбальная пункция, получен геморрагический ликвор. При МР-АГ (магниторезонансная ангиография) выявлена небольшая аневризма бифуркации средней мозговой артерии (СМА) справа (рис. 3). В первые сутки отмечалась спутанность сознания, на 7-е сутки вновь ухудшение состояния в виде нарушение речи с ретроградной амнезией. Консультирована в НИИ нейрохирургии им. Н.Н. Бурденко, где, учитывая САК, разрыв АА произведено хирургическое лечение – клипирование шейки аневризмы бифуркации правой СМА. Послеоперационный период протекал гладко. Выписана на 10-е сутки после операции под наблюдением поликлиники МОНИИАГ и женской консультации. В 36-37 недель плановая госпитализация в МОНИИАГ для подготовки к родоразрешению. Повторно осмотрена нейрохирургом, рекомендовано родоразрешение через естественные родовые пути с ограничением потуг. В 37–38 недель гестации произошли срочные вагинальные оперативные роды: с целью ограничения потуг произведена вакуум – экстракция плода. Родился живой доношенный мальчик весом 2660 г, ростом 48 см с оценкой состояния по шкале Апгар 8 и 9 баллов. Роды протекали на фоне перидуральной анестезии и наркотических анальгетиков. Выписана на 4-е сутки после родов вместе с ребенком. В настоящее время неврологической симптоматики не наблюдается, планируется плановый осмотр нейрохирурга через 6 месяцев после родов.
Пациентка Р., 37 лет, в течение 14 лет страдает гипертонической болезнью (максимальные цифры АД 140/90 мм рт. ст.), наблюдалась у терапевта. Постоянную гипотензивную терапию не получала. Данная беременность четвертая. В анамнезе 1 медицинский аборт в 6–7 недель и неразвивающаяся беременность в 11–12 недель, одни срочные самопроизвольные роды. Родилась девочка весом 3980 г, здорова. Данная беременность наступила спонтанно, встала на учет в женской консультации в 14 недель. В 19 недель на фоне АГ (АД 160/100 мм рт.ст.) возникла резкая сильная головная боль, многократная рвота, сознание при этом не теряла. Госпитализирована бригадой скорой помощи в центральную районную больницу по месту жительства с диагнозом: Беременность 19 недель. Преэклампсия. АГ. Произведена люмбальная пункция, получен геморрагический ликвор. При МР-АГ (магниторезонансная ангиография) выявлена небольшая аневризма бифуркации средней мозговой артерии (СМА) справа (рис. 3). В первые сутки отмечалась спутанность сознания, на 7-е сутки вновь ухудшение состояния в виде нарушение речи с ретроградной амнезией. Консультирована в НИИ нейрохирургии им. Н.Н. Бурденко, где, учитывая САК, разрыв АА произведено хирургическое лечение – клипирование шейки аневризмы бифуркации правой СМА. Послеоперационный период протекал гладко. Выписана на 10-е сутки после операции под наблюдением поликлиники МОНИИАГ и женской консультации. В 36-37 недель плановая госпитализация в МОНИИАГ для подготовки к родоразрешению. Повторно осмотрена нейрохирургом, рекомендовано родоразрешение через естественные родовые пути с ограничением потуг. В 37–38 недель гестации произошли срочные вагинальные оперативные роды: с целью ограничения потуг произведена вакуум – экстракция плода. Родился живой доношенный мальчик весом 2660 г, ростом 48 см с оценкой состояния по шкале Апгар 8 и 9 баллов. Роды протекали на фоне перидуральной анестезии и наркотических анальгетиков. Выписана на 4-е сутки после родов вместе с ребенком. В настоящее время неврологической симптоматики не наблюдается, планируется плановый осмотр нейрохирурга через 6 месяцев после родов.
Еще в 3 наблюдениях «мозговая катастрофа» произошла дома (23, 29 и 30–31 недели гестации соответственно). ГИ во всех наблюдениях случился на фоне резкого повышения артериального давления 180–190/110 мм рт. ст. и АГ предшествовала сильная головная боль. Все женщины поступили в родильный дом с диагнозом «тяжелая преэклампсия». Только после консультации невролога и применения методов нейровизуализации был поставлен диагноз ГИ, и беременные были переведены в неврологическое отделение многопрофильного стационара. При обследовании было выявлено спонтанное САК, гематома малых размеров (20–30 мл). После консилиума совместно с неврологом, нейрохирургом и акушером было решено применить консервативную тактику лечения инсульта и пролонгировать беременность до доношенного срока. В результате двое беременные были родоразрешены через естественные родовые пути в 38 недель беременности. Во II периоде родов у одной роженицы применялась вакуум – экстракция плода, у другой – акушерские щипцы. В одном наблюдении, учитывая наличие многоплодной беременности, произведено КС.
Представленные примеры наглядно иллюстрируют запоздалую диагностику мозговой катастрофы, что явилось причиной отсроченного как консервативного, так и хирургического лечения. Однако в дальнейшем выбранная тактика ведения таких пациентов (нейрохирургическая и акушерская) позволили завершить беременность благополучно как для матери, так и для ребенка.
Выбор метода родоразрешения беременных с ГИ как в анамнезе, так и во время беременности зависит от причин развития ГИ, объема нейрохирургического вмешательства и выраженности неврологической симптоматики.
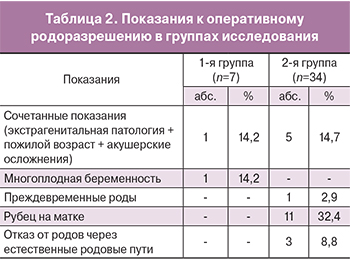
При выборе метода родоразрешения женщин исследуемых групп КС было произведено у 22 (53,7%) беременных, роды через естественные родовые пути произошли у 19 (46,3%) пациенток. Показания к проведению КС представлены в табл. 2, из данных которой следует, что наиболее частым показанием к проведению КС был рубец на матке 49,5% (n=11) наблюдений, а также сочетанные показания – у 49,5% (n=11) пациенток.
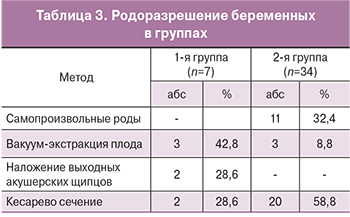
При этом доля пациенток, которым было проведено оперативное родоразрешение во 2-й группе, составила 58,8%, относительно 28,6% в 1-й группе обследованных больных (табл. 3).
Это обусловлено тем фактом, что мы не рассматривали наличие ГИ во время беременности в качестве безусловного показания к проведению КС. Такого же мнения придерживаются и авторы ряда исследований, которые полагают, что при ГИ в остром периоде более целесообразно консервативное ведение беременности и самопроизвольные роды. Родоразрешение путем КС рекомендуется при возникновении повторной опасности кровоизлияния в мозг [21, 22, 23].
В табл. 4 представлены результаты родоразрешения беременных в подгруппах в зависимости от причины развития ГИ. Из полученных данных установлено, что наиболее часто абдоминальное родоразрешение производилось у беременных с АА и АВМ, учитывая заключение нейрохирургов, когда как в подгруппах 2в, 2г и 2д основным показанием к КС послужило наличие рубца на матке после предыдущих родов.
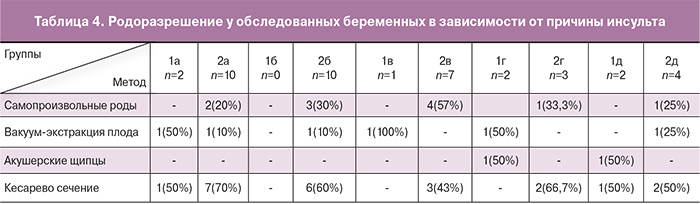
При родоразрешении через естественные родовые пути самопроизвольные роды были у 57,9% (11) женщин, в остальных наблюдениях оказывались различные пособия. Наиболее часто во II периоде родов использовалась вакуум-экстракция плода – у 31,6% (n=6) рожениц, в том числе у 2 пациенток 1-й группы с разрывами АА и КМ во время беременности, реже – акушерские щипцы 10,5% (n=2) пациенток 1-й группы с СТ. После обследования и консультации специалистов у 7 (36,8%) беременных проведены программированные роды. Длительность родов в среднем составила 9 ч 35 мин ± 43,6 мин. Длительность безводного промежутка была в пределах от 8 ч 20 мин до 10 ч 30 мин и в среднем была равна 8 ч 30 мин ± 58,4 мин. Патологической кровопотери не было отмечено ни в одном наблюдении. При этом показатели, как длительности родов, так и безводного промежутка в группах исследования не имели достоверных различий (р=0,01). Следовательно, наличие ГИ во время беременности, так же как и в анамнезе, не оказывает существенного влияния на течение и продолжительность родов. В процессе самопроизвольных родов у 90% пациенток применялась перидуральная анестезия, в остальных – медикаментозное обезболивание.
69% (n=29) детей родились в удовлетворительном состоянии с оценкой по шкале Апгар 8/9 баллов, тогда как в состоянии средней тяжести с оценкой 6/8 баллов – лишь один ребенок. Следует отметить, что состояние 10 детей, которые родились с оценкой по шкале Апгар 7/8 баллов, на третьи сутки расценивалось как удовлетворительное. 3 детей после КС (2 детей из двойни и 1 ребенок после преждевременных родов) переведены на 2-й этап выхаживания. Выписаны домой вместе с матерью 92,8% (n=39) детей.
Катамнестическое наблюдение проводилось в течение 3 лет за 23 женщинами обследованных групп. Ни в одном случае рецидива кровоизлияния или тромбоза сосудов головного мозга, либо других осложнений со стороны центральной нервной системы зарегистрировано не было.
Таким образом, при анализе результатов наших наблюдений за пациентками с ГИ во время беременности хотелось акцентировать внимание на следующих моментах: метод родоразрешения при ГИ зависит от причины церебрального кровоизлияния. Время и метод лечения ГИ определяются нейрохирургами в зависимости от клинической ситуации. При обширной гематоме, САК >30 мл, разрывах АА, АВМ, КМ показано хирургическое лечение (удаление гематомы, лигирование сосуда). При доношенном сроке гестации (если ГИ произошел в I или во II триместре) и полном выключении АА, АВМ и КМ из мозгового кровотока роды через естественные родовые пути возможны с ограничением или выключением потуг. Если ГИ произошел в III триместре или в родах, показано абдоминальное родоразрешение под общей анестезией.
Наличие ОНМК во время беременности не является принципиальным показанием для ее прерывания. В случае, когда речь идет о тяжелом состоянии пациентки при обширных полушарных гематомах, эпилептическом статусе, ранних сроках гестации (I триместр), а также желании женщины или ее ближайших родственников, беременность прерывают с дальнейшим лечением основного заболевания. Во всех остальных ситуациях беременность пролонгируют.
Наблюдение пациенток с ГИ как в анамнезе, так и во время беременности, должно соответствовать протоколу ведения беременных с тяжелыми экстрагенитальными заболеваниями. Посещение женской консультации должно быть не реже, чем один раз в две недели, необходимы консультации невролога, эпилептолога, офтальмолога и нейрохирурга для решения вопроса о тактике ведения беременности и методе родоразрешения. Необходимо своевременное выявление и коррекция гестационных осложнений, при наличии эписиндрома обязательным является постоянный прием антиконвульсантов в течение всей беременности. В типичных случаях синдром энцефалопатии при эклампсии представлен судорожными припадками и нарушением сознания различной степени выраженности. Поэтому ОНМК в первую очередь следует дифференцировать с тяжелой преэклампсией/эклампсией. Диагностический комплекс при выявлении сосудистой аномалии головного мозга должен обязательно включать МРТ с МР-АГ, КТ (точность диагностики достигает 98%).
Плановая госпитализация в акушерский стационар осуществляется в 37–38 недель беременности для выбора метода родоразрешения.
Оптимизация ведения беременных, перенесших ГИ с участием группы специалистов позволяет безопасно увеличить частоту родоразрешения этих пациенток через естественные родовые пути, при этом ведение родов должно быть бережным, целесообразны программированные роды c применением перидуральной анестезии, с ограничением/выключением потуг (вакуум-экстракция плода, акушерские щипцы).
Резюмируя вышесказанное, хочется еще раз подчеркнуть, что своевременная диагностика, адекватное лечение церебральной патологии позволяют избежать ошибок в лечебной и акушерской тактике, что способствует сохранению беременности и рождению жизнеспособного ребенка.



