Преэклампсия (ПЭ) остается одним из наиболее частых осложнений беременности с неясной этиологией, которое приводит к неблагоприятным исходам для матери и плода [1–3]. Предполагается, что ПЭ развивается в результате нарушения плацентации, приводящей к гипоксии плаценты и, как следствие, секреции в периферический кровоток факторов, вызывающих аберрантный ответ иммунной системы. Дезадаптация иммунной системы может привести к развитию различных патологических состояний матери и плода; поэтому иммунологическая теория развития ПЭ является одной из основных в возникновении данного осложнения [2, 4–6].
Последствия воспаления при ПЭ проявляются в изменении поляризации мононуклеарных клеток по про- или противовоспалительному пути [7–9]. Известно, что экспрессия моноцитами CD16 Fc-рецептора, опосредующего клеточную антителозависимую цитотоксичность в периферической крови, коррелирует с тяжестью ПЭ [10–12]. Согласно литературным данным, кроме экспрессии CD16, провоспалительная активность моноцитов может быть связана с экспрессией на мембране провоспалительных кофакторов, таких как CD86 и CD40 [13, 14].
Кроме того, защита фетальных и материнских клеток может осуществляться за счет экспрессии так называемых антифагоцитарных белков, входящих в сигнальный путь «не ешь меня», таких как CD47 и CD24, передающих сигнал посредством взаимодействия с сигнально-регуляторным белком альфа (SIRPα) и ингибирующим рецептором Ig-подобным лектином 10 (Siglec-10) соответственно [15–17]. Данный механизм может иметь противовоспалительное влияние на моноциты; однако в литературе не представлены исследования, посвященные изучению данного механизма при ПЭ.
Предполагается, что активацию Т-лимфоцитов могут усиливать костимулирующие молекулы CD28 и CD152, гомологичные между собой, конкурентно связываясь с лигандами СD80 и CD86; при этом CD28 опосредует провоспалительный, а CD152 – противовоспалительный фенотип при ПЭ [18, 19].
Учитывая вышеизложенное, большой интерес вызывает изучение фенотипического профиля мононуклеарных клеток при ПЭ, а именно: содержание моноцитов и лимфоцитов, экспрессирующих воспалительные факторы CD40, CD80, CD86, поверхностные сигнальные молекулы пути «не ешь меня» CD24 и CD47, поверхностные костимулирующие рецепторы CD28 и CD152, Fc-рецептор CD16 и уровень их экспрессии.
Изучение вышеперечисленных иммунных факторов при ПЭ может установить новые патогенетические механизмы и стать основанием для определения новых маркеров ранней диагностики данного осложнения.
Цель исследования: изучить фенотипический профиль мононуклеарных клеток в периферической крови беременных при ПЭ.
Материалы и методы
Исследование было проведено на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, одобрено локальным этическим комитетом; все беременные подписали добровольное информированное согласие. Исследование включало 38 беременных женщин. В основную группу входили 20 беременных с ПЭ умеренной и тяжелой степени, группа сравнения состояла из 18 женщин с физиологически протекающей беременностью. Диагноз «преэклампсия» был установлен согласно Клиническим рекомендациям, утвержденным научно-практическим советом Министерства здравоохранения Российской Федерации и разработанным Российским обществом акушеров-гинекологов «Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде» (2021). Забор материала в обеих группах производился на равнозначных сроках, в основной группе медиана составляла 36 (33,6; 38,6), в группе сравнения – 36,6 (36; 37,4) недель (p>0,05).
Критерии включения в исследование.
Для основной группы: одноплодная беременность, осложненная ПЭ.
Для группы сравнения: одноплодная беременность, протекающая физиологически.
Критерии исключения для обеих групп:
- многоплодная беременность;
- аутоиммунные и онкологические заболевания;
- острые воспалительные заболевания;
- тяжелая экстрагенитальная патология.
При помощи проточной цитофлуориметрии определялись уровни CD28, CD80, CD86, CD40, CD152, CD24, CD47, CD16, экспрессируемых моноцитами и лимфоцитами периферической крови беременных.
Для фенотипической оценки мононуклеарных клеток забор венозной крови женщины производился в пробирку с натрия гепарином, пробирка с кровью доставлялась в лабораторию в течение 30 минут. Для анализа отбиралось по 5 мкл крови в 3 пробирки, в каждую пробирку с кровью добавлялось 45 мкл раствора PBS. На следующем этапе производилась обработка конъюгированными с флуоресцентными метками антителами согласно протоколу производителя.
Анализ проводился при помощи метода проточной цитофлуориметрии с использованием BD FACSCalibur (USA). Относительное содержание (%) моноцитов и лимфоцитов вычислялось как отношение количества каждой популяции клеток к общему количеству моноцитов и лимфоцитов. Экспрессия иммунными клетками исследуемых факторов была оценена по уровню флуоресценции конъюгированных с флуоресцентными метками антител к изучаемым антигенам и была представлена в виде интенсивности флуоресценции, отн. ед. (FI).
Статистический анализ
Результаты исследования обрабатывали с использованием стандартного пакета программ SPSS Statistics 17.0 и Microsoft Excel. Оценка статистической значимости непрерывных значений проводилась с использованием критерия Манна–Уитни, данные представлены в виде медианы (Me) и нижнего и верхнего квартилей (Q1; Q3); на рисунке в виде диаграммы размаха (5%; Q1; Me; Q3; 95%); сравнение качественных параметров проводилось с помощью точного критерия Фишера, данные представлены в виде процентов (%). Для корреляционного анализа использовался коэффициент Спирмена. Статистически значимыми различия между выборками считалась при значении p<0,05.
Результаты и обсуждение
Пациентки обеих групп были сопоставимы по клинико-анамнестическим характеристикам (табл. 1).
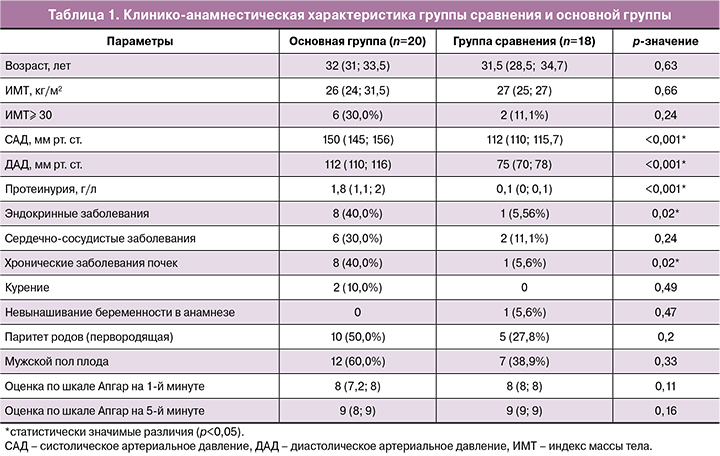
Возраст беременных и индекс массы тела (ИМТ) в исследуемых группах статистически не различались. Возраст в основной группе составил 32 (31;33,5), а в группе сравнения – 31,5 (28,5; 34,7) года (p=0,63); ИМТ – 26 (24; 31,5) и 27 (25; 27) кг/м2 по группам соответственно (p=0,66).
Анализ соматической патологии установил статистически значимые различия (p=0,02) в частоте эндокринных и хронических заболеваний почек; данные патологии встречались у 8 женщин в основной группе, что составило 40,0%, и по одному случаю в группе сравнения. По данным ряда исследователей [20–22], заболевания сердечно-сосудистой системы относят к факторам риска развития ПЭ; в нашем исследовании не выявлено статистически значимых различий (p=0,24). Такие потенциальные факторы риска, как курение (p=0,49), паритет родов (первородящая) (p=0,2), невынашивание беременности в анамнезе (p=0,47), мужской пол плода (p=0,33), также не имели статистически значимых различий. Структура и частота гинекологических заболеваний не различались.
Уровни систолического и диастолического артериального давления (САД и ДАД), протеинурии были выше в основной группе, что обусловлено критериями включения, и составили: САД – 150 (145; 156) мм рт. ст., ДАД – 112 (110; 116) мм рт. ст. в основной группе и САД 112 (110; 115,7) мм рт. ст., ДАД 75 (70; 78) мм рт. ст. – в группе сравнения (p<0,001); уровень протеинурии – 1,8 и 0,1 г/л по группам соответственно (p<0,001).
Следует отметить, что статистически значимых различий в оценке состояния детей по шкале Апгар при рождении между исследуемыми группами не выявлено.
Для изучения фенотипических особенностей лимфоцитов и моноцитов в кровотоке периферической крови были проанализированы уровни CD28, CD80, CD86, CD40, CD152, CD24, CD47, CD16, экспрессируемых моноцитами и лимфоцитами периферической крови беременных, при помощи метода проточной цитофлуориметрии. Полученные данные представлены в таблице 2.
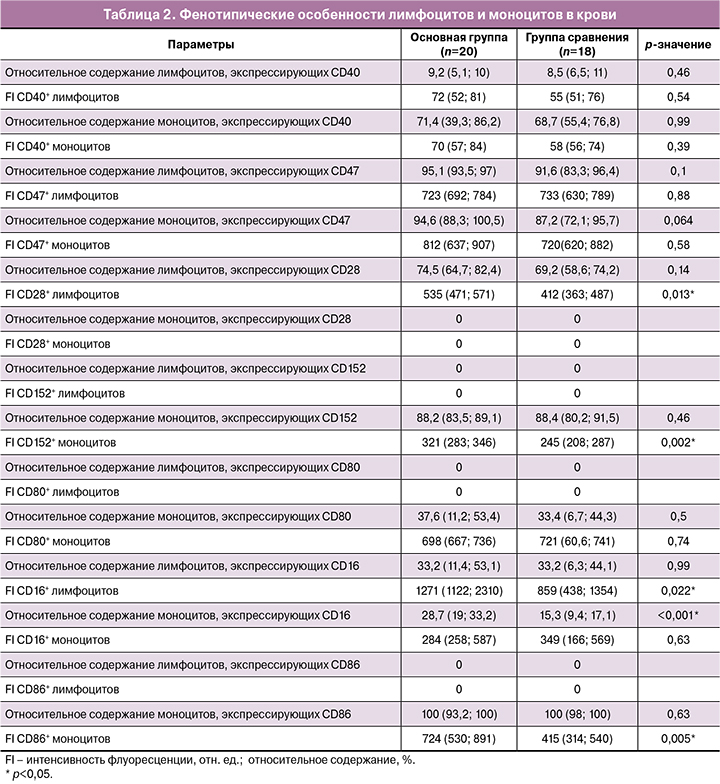
Был отмечен более высокий уровень CD16+ моноцитов при ПЭ, по сравнению с группой сравнения – 28,7 и 15,3% соответственно, что подтверждает данные, полученные в предыдущих работах [10, 23]. Относительное содержание лимфоцитов, экспрессирующих CD16, в группах не различалось и составляло 33,2%. Уровни экспрессии моноцитами CD16 в группах не различались и составляли 284 и 349 отн. ед. соответственно (p=0,63); однако при оценке экспрессии лимфоцитами выявлены статистически значимые различия – 1271 и 859 отн. ед. по группам соответственно (p=0,022).
Предположение о том, что механизм «не ешь меня» может активировать моноциты по противовоспалительному пути при ПЭ, в данном исследовании не было подтверждено, так как мы не обнаружили статистически значимых различий между группами исследования. Относительное содержание лимфоцитов CD47+ и моноцитов CD47+, а также уровни экспрессии CD47 лимфоцитами и моноцитами не различались. Содержание в иммунных клетках антифагоцитарного белка CD24 и его экспрессия в обеих группах были незначительными (данные не представлены).
Относительное содержание моноцитов и лимфоцитов, экспрессирующих провоспалительный фактор CD40, и уровень его экспрессии при ПЭ также не имели статистически значимого увеличения по отношению к группе сравнения. Относительное содержание лимфоцитов CD40+ в основной группе составило 9,2%, в группе сравнения – 8,5% (p=0,46); относительное содержание моноцитов CD40+ составило 71,4 и 68,7% соответственно по группам (p=0,99). Уровень экспрессии CD40 лимфоцитами в основной группе составил 72 отн. ед., в группе сравнения – 55 отн. ед. (p=0,54), в моноцитах – 70 и 58 отн. ед. по группам соответственно (p=0,39).
По данным литературы известно, что костимулирующие молекулы CD28 и CD152, гомологичные между собой, конкурентно связываются с лигандами СD80 и CD86. CD28 и CD152 оказывают противоположное влияние на стимуляцию Т-клеток: CD28 обеспечивает провоспалительный ответ и усиливает цитотоксическую активацию Т-лимфоцитов, а CD152 реализует противовоспалительный ответ [18, 19]. Несмотря на данные об экспрессии CD152 на поверхности лимфоцитов, исследования Oyewole-Said D. et al. (2020) [24], Tiemann M. et al. (2021) [25] показывают, что данный маркер экспрессируется и другими иммунными клетками, в том числе моноцитами. В данном исследовании было установлено, что экспрессия CD28 лимфоцитами, а также CD152 и CD86 моноцитами при ПЭ была повышена; при этом моноцитами практически не экспрессировался CD28, а лимфоцитами – CD152 и CD86. Относительное содержание лимфоцитов, экспрессирующих CD28, в группах не различалось и составило 74,5 и 69,2% соответственно (p=0,14). Уровень экспрессии CD28 лимфоцитами при ПЭ статистически значимо отличался от группы сравнения и составил 535 отн. ед. (p=0,013). Относительное содержание моноцитов, экспрессирующих CD152, также не различалось; при этом уровень экспрессии в основной группе составил 321 отн. ед., в группе сравнения – 245 отн. ед. (p=0,002).
Относительное содержание моноцитов CD80+ и уровни экспрессии CD80 моноцитами не имели статистически значимых различий. В обеих группах относительное содержание моноцитов CD86+ составило 100%, однако в основной группе уровень экспрессии CD86 моноцитами был статистически значимо выше и составил 724 отн. ед., в группе сравнения – 415 отн. ед. (p=0,005). Наиболее значимые результаты представлены на рисунке 1.
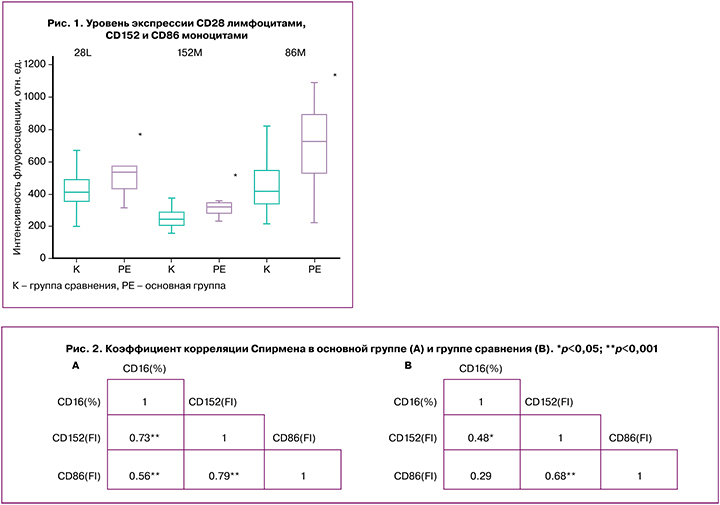
Корреляционный анализ установил высокий уровень взаимосвязей между уровнем экспрессии в моноцитах CD152, CD86 и относительным содержанием CD16+ моноцитов (рис. 2). Данный результат может указывать на возможную активацию сигнального пути, по которому фактор CD152 связывается с рецептором CD86, что приводит к экспрессии моноцитами CD16. Также полученные данные показывают, что CD28 усиливает цитотоксическую активность Т-лимфоцитов при ПЭ.
Заключение
Анализ фенотипических особенностей иммунных клеток, потенциально участвующих в развитии ПЭ, имеет не только научное значение, способствующее пониманию патогенеза ПЭ, но и практическое значение. Так, установленная повышенная экспрессия CD28 лимфоцитами, CD86 и CD152 моноцитами имеет диагностический потенциал, и данные факторы можно рассматривать в качестве новых маркеров ПЭ. Выявленная взаимосвязь между CD16, CD152 и CD86 указывает на возможность их участия в одном сигнальном пути. Изучение данного сигнального пути может позволить выделить новые механизмы развития данного осложнения беременности и установить диагностические и прогностические критерии ПЭ.



