В 2021 г. Европейским обществом репродукции человека и эмбриологии (ESHRE) на обсуждение научной аудитории были представлены новые рекомендации по эндометриозу и глоссарий. Первоначально определение эндометриоза звучало следующим образом: «An inflammatory disease process characterized at surgery by the presence of endometrium-like epithelium and/or stroma outside the endometrium and myometrium» – «Заболевание, ассоциированное с воспалительным процессом и характеризующееся при операции наличием эндометрий-подобного эпителия и/или стромы за пределами эндометрия и миометрия» [1]. Данное определение предполагало невозможность установления до операции диагноза эндометриоза и, соответственно, назначения терапии. Нами была направлена данная ремарка ESHRE. Наиболее вероятно, что подобные комментарии были получены от многих рецензентов, и, как следствие, в итоговой версии рекомендаций определение эндометриоза выглядит иначе: «A disease characterized by the presence of endometrium-like epithelium and/or stroma outside the endometrium and myometrium, usually with an associated inflammatory process». То есть «Заболевание, характеризующееся присутствием эндометрий-подобного эпителия и/или стромы за пределами эндометрия и миометрия, обычно с ассоциированным воспалительным процессом» [1].
На примере «показательных» клинических случаев попробуем разобраться в нескольких из множества спорных моментов, связанных с таким распространенным и одновременно сложным для понимания эндометриозом.
Клинический случай № 1
Пациентка Е., 32 года, в январе 2021 г. поступила в гинекологическое отделение клиники Научно-исследовательского института акушерства и педиатрии ФГБОУ ВО «Ростовский государственный медицинский университет» (НИИАП ФБГОУ ВО РостГМУ) с жалобами на боли внизу живота, при ультразвуковом исследовании (УЗИ) правый яичник представлен эхонегативным образованием, размерами 72,7×61,5 мм. Из анамнеза: в 2007 и 2009 гг. роды путем кесарева сечения в нижнем маточном сегменте, в 2012 г. срединная лапаротомия, удаление кисты печени (осложненной перитонитом). В 2019 г. в Ростовском онкологическом институте выполнена лапаротомия, удаление эндометриоидной кисты левого яичника. От приема диеногеста в непрерывном режиме отказалась в связи с появлением побочных эффектов.
В отделении клиники НИИАП ФБГОУ ВО РостГМУ была выполнена лапароскопия с дренированием кисты. В ходе операции установлено: к передней брюшной стенке тотально в области послеоперационного рубца подпаяны плотными спайками петли кишечника и большой сальник. В свободных от спаек местах с большими техническими трудностями введены 2 манипулятора. С помощью монополярного электрода вскрыта брюшина над образованием в области правого придатка (рис. 1, 2), излилось 90 мл размытого геморрагического содержимого, эвакуировано из брюшной полости. Капсулу выделить невозможно. Доступ к яичнику ограничен плотными спайками. При влагалищном УЗИ, выполненном во время операции, визуализируется эхонегативное образование в проекции правого яичника меньших размеров – 5,5×4,0 см. В связи с отсутствием доступа со стороны операционного поля к данному образованию выполнена пункция образования через задний свод влагалища под контролем УЗИ. После эвакуации содержимого визуализируется правый яичник размерами 1,5×1,0 см. В послеоперационном периоде пациентке назначен комбинированный оральный контрацептив (КОК), содержащий диеногест+этинилэстрадиол, в контрацептивном режиме.
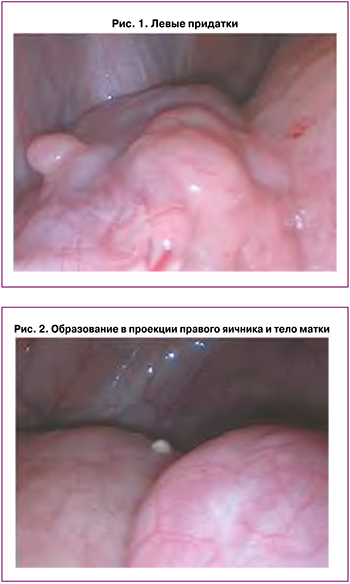
Пациентка отказалась от приема КОК в связи с появившейся на фоне терапии головной болью. Рецидив образования, сопровождающийся болевым синдромом, привел к пункции через боковой свод влагалища в апреле 2021 г. Вновь назначен КОК, содержащий диеногест+этинилэстрадиол, в непрерывном режиме, который пациентка принимала в течение 2 месяцев. В октябре 2021 г. при УЗИ выявлена эндометриоидная (?) киста правого яичника. При бимануальном исследовании определяется очаг глубокого инфильтративного эндометриоза до 1,5 см в диаметре. Произведена пункция эндометриомы под контролем УЗИ. Назначен дидрогестерон 10 мг 2 раза в день в непрерывном режиме с учетом наличия глубокого очага ретроцервикального эндометриоза. Лечение не принимала. В марте 2022 г. рецидив эндометриомы правого яичника с последующей пункцией. Пациентке категорически рекомендован прием дидрогестерона во избежание рецидива кисты и прогрессирования течения глубокого инфильтративного эндометриоза.
Данный случай подтверждает тот факт, что при отсутствии терапии рано или поздно у пациенток с большой вероятностью развивается рецидив заболевания. Это подчеркивает важность комплексного лечения эндометриоза, необходимость назначения медикаментозной гормональной терапии гестагенами после оперативного вмешательства. Клиническая ситуация демонстрирует, что побочные негативные явления при приеме комбинированных гормональных контрацептивов и диеногеста снижают приверженность к терапии, приводят к отказу от лечения и, как следствие, рецидиву. Крайне важно до начала лечения информировать пациентку о возможных побочных реакциях, связанных с приемом препаратов, чтобы она была готова к дальнейшему контакту и не принимала решение об отмене лечения самостоятельно.
Данный клинический случай подтверждает мнение о том, что предшествующий прием КОК ассоциирован с повышенным риском эндометриоза, в частности, формирования глубокого инфильтративного эндометриоза [2].
Клинический случай № 2
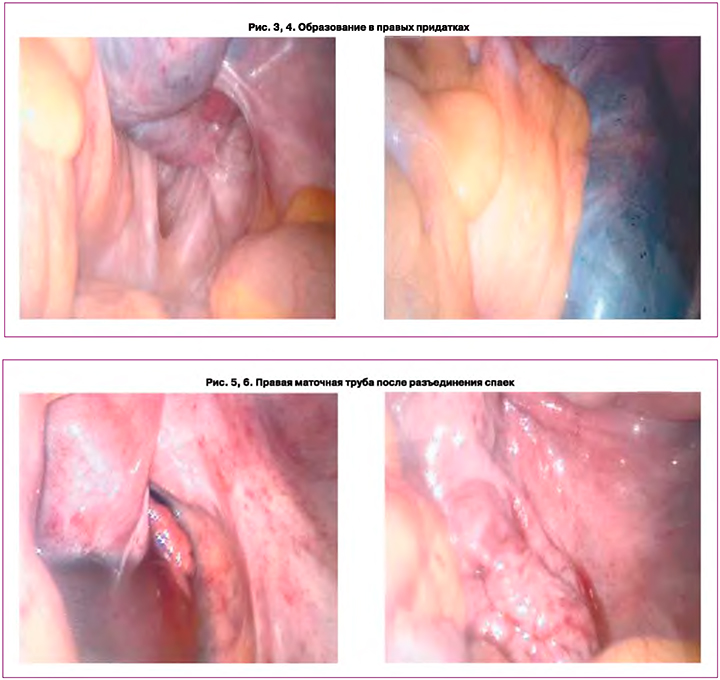
Пациентка Ш., 31 год. Беременностей – 0. Из анамнеза известно о трех перенесенных операциях в течение 3 лет по поводу эндометриоза лапароскопическим доступом. Первая операция в объеме лапароскопии, пельвиолизиса, резекции обоих яичников и дренирования малого таза по поводу генитального эндометриоза 2-й степени, двусторонних эндометриом выполнена на базе одной из клинических больниц города Ростова-на-Дону в 2018 г. Повторная операция также в Ростове-на-Дону, но в другом стационаре – выполнены лапароскопия, висцеролизис, цистэктомия эндометриоидных кист обоих яичников, дренирование брюшной полости. Третья операция проведена в октябре 2020 г. в клинике Первого Санкт-Петербургского медицинского университета по поводу спаечного процесса органов малого таза III–IV степени, синдрома хронических тазовых болей, наружного генитального эндометриоза 4-й степени, билатеральных эндометриом, эндометриоидного инфильтрата правой крестцово-маточной связки, левостороннего гидросальпинкса слева в объеме лапароскопии, адгезиолизиса, сальпингоовариолизиса слева, билатеральной овариоцистэктомии, двустороннего уретролизиса, двустороннего нейролизиса, энтеролизиса, иссечения эндометриоидного инфильтрата правой крестцово-маточной связки, шейвинга прямой кишки, хромогидротубации, тубэктомии слева, введения противоспаечного геля Oxiplex, гистероскопии, биопсии эндометрия. От медикаментозного лечения пациентка в послеоперационных периодах отказалась. С июля 2021 г. пациентка отмечает усиление тянущих болей внизу живота. При УЗИ диагностировано эхонегативное образование в области правого яичника до 65 мм в диаметре. В динамике – рост образования до 10 см, в связи с чем 26 октября 2021 г. женщина поступила в клинику НИИАП ФБГОУ ВО РостГМУ. Во время лапароскопии выявлено, что петли кишечника тотально подпаяны к задней стенке матки, левой подвздошной области, задний свод облитерирован петлями кишечника. Придатки не визуализируются. После разъединения спаек в области правых придатков выявлено образование до 10 см в диаметре с тонкой капсулой и прозрачным содержимым, включая незначительную примесь геморрагического содержимого, расцененное как сероцеле (рис. 3, 4). Правая маточная труба распластана на образовании. Фимбриальный отдел свободен от спаек, прилежит к нижнему полюсу правого яичника, подпаянному плотными спайками к Дугласову пространству. После вскрытия капсулы образования эвакуировано 250,0 мл серозно-геморрагического содержимого (правая маточная труба в конце операции представлена на рисунках 5, 6). Левый яичник полностью не визуализирован за счет спаечного процесса. Учитывая анамнез пациентки, для предупреждения рецидива эндометриоза назначен дидрогестерон по 10 мг 2 раза в день с 5-го по 25-й день менструального цикла до планирования беременности.
Хирургическое вмешательство может оказаться благоприятным для бесплодных женщин с эндометриомами, но неблагоприятным для женщин с глубоко инфильтрирующими эндометриоидными поражениями. Результаты, полученные после удаления эндометриом, могут быть воспроизводимы многими хирургами, тогда как результаты, относящиеся к удалению ректовагинального эндометриоза, строго зависят от квалификации хирурга. Необходимо стремиться минимизировать хирургические вмешательства у пациенток. Повторные хирургические вмешательства следует рассматривать с осторожностью у женщин, перенесших несколько предыдущих операций [3]. Частота рецидивов эндометриоза после лапароскопии колеблется от 21,5% через 2 года до 40–50% через 5 лет и может достигать 72% через 7 лет. Патогенез рецидивирующего заболевания остается спорным: рецидивирующие поражения возникают de novo или большинство из них представляет собой неадекватно леченные поражения [4–7]. Оперативное лечение эндометриоза имеет свои ограничения и риски. Оно сопровождается развитием спаечного процесса, который и без операции характерен для эндометриоза. При эндометриоидных поражениях происходит хроническая потеря целостности брюшины с обнажением подлежащей соединительной ткани и внеклеточного матрикса. Фибринозные спайки организуются в фиброзную адгезию из-за врастания фибробластов и эндотелиальных клеток, что сопровождается образованием капилляров и включением коллагена. Операция на брюшной полости, нацеленная на удаление эндометриоидных поражений и узелков, вряд ли восстановит равновесие между фибриногенезом и фибринолизом, а учитывая уже имеющийся воспалительный процесс, может усугубить дисбаланс [8]. На примере данной пациентки мы видим, что с каждой последующей операцией тяжесть спаечного процесса усугубляется. В том числе и по этой причине время, объем, показания к выполнению оперативного вмешательства по поводу эндометриоза – вопросы дискутабельные. Кроме того, операция сама по себе может быть фактором риска прогрессирования эндометриоза, о чем свидетельствует повышенный риск эндометриоза у пациентов с хирургическим анамнезом. Этот эффект может быть результатом активации адренергических путей, хронического стресса и повышенного ангиогенеза [9–12]. Можно привести несколько аргументов в пользу использования пролонгированного медикаментозного лечения эндометриоза. Многочисленные неадекватные и ненужные хирургические вмешательства, выполняемые при эндометриозе, при сохранении матки не влияют на ретроградную менструацию. Кроме того, после хирургического лечения наблюдается высокая частота рецидивов симптомов и поражений, а операция может быть неэффективной для лечения боли из-за центральной сенсибилизации [13].
В настоящее время препаратами 1-й линии терапии эндометриоза являются гестагены, среди которых в России зарегистрированы и наиболее часто применяются дидрогестерон, диеногест и норэтистерон. Гестагены обладают сравнимой эффективностью, но разным профилем безопасности. Дидрогестерон в силу его высокой селективности обладает благоприятным профилем безопасности, при этом снижена вероятность побочных эффектов, связанных с другими рецепторами. Данные одного из последних постмаркетинговых обсервационных исследований [11] показали значительное снижение интенсивности дисменореи и хронической тазовой боли. Объем эндометриоидных кист снизился у 50% пациенток (26/52), не изменился – у 25% (13/52), что демонстрирует положительный результат в 75% случаев на фоне терапии дидрогестероном [14].
Клинический случай № 3
Пациентка C., 21 год. В 2010 г. в связи с жалобами на боли внизу живота выполнена энуклеация капсулы эндометриоидной кисты правого яичника лапароскопическим доступом. В послеоперационном периоде назначены комбинированные оральные контрацептивы на 6 месяцев. В 2013 г. госпитализирована в гинекологическое отделение клиники НИИАП ФБГОУ ВО РостГМУ с жалобами на боли внизу живота. Выполнены лапароскопия, хромогидротубация, разъединение спаек органов малого таза, электрокоагуляция очагов эндометриоза, цистэктомия левого яичника, гистероскопия. Гистологические анализы подтвердили наличие эндометриоидных кист в обоих случаях. Назначен комбинированный оральный контрацептив, содержащий диеногест+этинилэстрадиол, на 3 месяца. В мае 2015 г. произошли самостоятельные роды в срок. Беременность протекала без осложнений. Третья операция выполнена в апреле 2017 г. в клинике НИИАП ФБГОУ ВО РостГМУ в связи с образованием левого яичника, осложненным выраженным болевым синдромом. Произведены лапароскопия, хромогидротубация, удаление кисты левого яичника. Гистологический анализ выявил фрагменты некротизированной ткани (видоизмененные эритроциты, гемосидероз). Назначен дидрогестерон по 10 мг 2 раза в день на 10 дней, затем КОК, содержащий диеногест+этинилэстрадиол, в контрацептивном режиме на 3 месяца. При плановом осмотре в июне 2019 г. в проекции левого яичника выявлена кистозная неоднородная структура с наличием периферического кровотока при цветном допплеровском картировании (ЦДК), размерами 41×39 мм (эндометриоидная киста), рядом однокамерная анэхогенная структура 37×32 мм, на остальном протяжении прослеживается ткань яичника с фолликулами до 5 мм (рис. 7, 8).

При последующем осмотре в ноябре 2019 г. образование имело прежние размеры при отсутствии терапии. В марте 2020 г. спонтанно наступила беременность. При динамическом ультразвуковом наблюдении в левом яичнике сохраняется эндометриодная киста размерами 27×114 мм (рис. 9).

Беременность протекала с угрозой прерывания и госпитализацией в стационар. Назначена гестагенная поддержка – дидрогестерон 10 мг 2 раза в день до 20 недель. Роды самостоятельные в сроке 39 недель. Необходимость назначения дидрогестерона была обусловлена угрозой прерывания беременности и пониманием того, что частота выкидышей статистически выше у женщин с перитонеальным эндометриозом (22,0–35,8%); отношение рисков (ОР) 1,97 (95% доверительный интервал (ДИ) 1,41–2,75) [15]. Дидрогестерон – единственный гестаген, в отношении которого высказаны предположения о повышении шансов на наступление беременности при эндометриозе. Дидрогестерон доказанно снижает риск спорадического и привычного невынашивания беременности при недостаточности лютеиновой фазы. Его прием целесообразен во время беременности, так как при эндометриозе риск самопроизвольной потери повышен в 1,7–3 раза (прочие одобренные для лечения эндометриоза гестагены противопоказаны при беременности) [16].
Непродолжительная послеоперационная гормональная терапия (3–6 месяцев) продемонстрировала небольшую пользу с точки зрения рецидивов заболевания. Однако длительное применение (18–24 месяцев) ведет к значительному снижению частоты послеоперационных рецидивов, в том числе рецидивов эндометриом [7]. Кроме того, представленный клинический случай подтверждает существующее мнение о потенцирующем действии КОК на рецидивы эндометриоза.
Какой же терапии отдать предпочтение при эндометриозе в репродуктивном возрасте? Препарат должен способствовать регрессии эндометриоидных очагов, устранять боль и воспаление, ассоциированные с эндометриозом. Препарат не должен иметь серьезных побочных эффектов, только в этом случае мы можем ожидать приверженности к терапии со стороны пациенток. Препарат не должен негативно влиять на эутопический эндометрий, при этом сохранять овариальный резерв и фертильность при длительном применении.
Клинический случай № 4
Пациентка О., 38 лет, поступила в НИИАП ФБГОУ ВО РостГМУ 11 февраля 2022 г. по поводу инфильтрата правой ягодичной мышцы (гематома с нагноением) и инфильтрата в малом тазу справа (рис. 10, 11). Диагноз при поступлении: эндометриоз ректовагинальной перегородки и влагалища, наружный генитальный эндометриоз, инфильтративная форма, инфильтративный эндометриоз органов малого таза с компрессионно-ишемической нейропатией седалищного нерва, хронический параметрит в стадии обострения, аденомиоз, аномальное маточное кровотечение, постгеморрагическая анемия 2-й степени, спаечный процесс органов малого таза IV степени. Осложнения: болевой синдром. Сопутствующий: лейкемоидная реакция нейтрофильного типа, хронический ДВС-синдром на фоне септического процесса, субкомпенсация, вторичная компрессионно-ишемическая невропатия седалищного нерва справа за счет экстрагенитального эндометриоза с поражением грушевидной, большой ягодичной, внутренней запирательной мышцы справа, вялый нижний правосторонний монопарез, нейропатический болевой синдром.

Считает себя больной с 2014 г., когда впервые был выставлен диагноз глубокого инфильтративного эндометриоза, рекомендовано планирование беременности. Периодически принимала различные КОК продолжительностью от 3 до 6 месяцев. Спонтанная беременность не наступила, в 2018 г. назначен КОК, содержащий диеногест+этинилэстрадиол. На 3-м месяце приема появились неврологические симптомы – онемение правой стопы, боли в ягодице. Диагноз: парез правой стопы. В 2020 г. впервые отметила появление при менструации отека правой ягодичной области, повышение температуры тела до 39,0°С. Для снижения воспаления регулярно принимала антибиотики. В марте 2021 г. находилась на лечении в стационаре Первого Санкт-Петербургского государственного медицинского университета им. академика И.П. Павлова Минздрава России (СПбГМУ им. И.П. Павлова) по поводу наружного генитального эндометриоза, инфильтративной формы, эндометриоидного инфильтрата ректовагинальной перегородки, влагалища, инфильтративного эндометриоза малого таза с компрессионно-ишемической нейропатией седалищного нерва, аденомиоза, экстрагенитального эндометриоза: эндометриоидный инфильтрат ректосигмоидного отдела толстой кишки, мочеточников. Выполнено оперативное вмешательство: лапароскопия, адгезиолизис, сальпингоовариолизис, иссечение ретроцервикального эндометриоидного инфильтрата, резекция крестцово-мышечных связок, циркулярная резекция прямой кишки с аппаратным наложением анастомоза, двусторонний уретеролизис, минилапаротомия, дренирование малого таза, биопсия эндометрия. Назначен трипторелин № 6. На фоне приема агонистов пациентка отметила снижение циклического болевого синдрома и уменьшение отека ягодицы, а также прекращение менструаций только с третьего цикла приема.
Поскольку эндометриоидный очаг вокруг седалищного нерва не полностью удален при первой операции и движение в стопе полностью не восстановлено, была повторно госпитализирована в октябре 2021 г. в СПбГМУ им. И.П. Павлова с диагнозом: ретроцервикальный эндометриоз, эндометриоидный инфильтрат седалищного нерва, состояние после комбинированной терапии: хирургического и гормонального лечения. Осложнение: синдром хронической тазовой боли, анемия I степени, спаечный процесс брюшной полости и малого таза. Проведено оперативное лечение в объеме лапароскопии, иссечения эндометриоидных инфильтратов, адгезиолизиса, установки противоспаечного барьера, биопсии эндометрия. Результат гистологического анализа – эндометриоидный инфильтрат седалищного нерва. Назначен дидрогестерон в пролонгированном циклическом режиме. В декабре 2021 г. отмечала межменструальные кровянистые выделения, боли не беспокоили. С начала января 2022 г. пациентка отметила усиление болей внизу живота, появление кровянистых выделений со сгустками, связанных с менструальным циклом. 1 февраля 2022 г. начало менструаций сопровождалось болевым синдромом, отеком правой ягодичной области, повышением температуры тела до 39,0°С. Консервативное лечение с применением нестероидных противовоспалительных средств – без эффекта. Во время госпитализации в отделении гинекологии РостГМУ проведена антибактериальная, антианемическая терапия. Назначены агонисты гонадотропин-рилизинг-гормона. Пациентка в связи с хирургической патологией направлена в стационар соответствующего профиля для вскрытия нагноившейся гематомы.
Согласно анализу научных публикаций о взаимосвязи между приемом КОК и риском развития эндометриоза за последние четыре десятилетия было сделано заключение о том, что лечение с использованием КОК у молодых женщин с дисменореей может содействовать задержке диагностики эндометриоза [17]. Не исключено, что назначенные в данном конкретном случае КОК при подозрении на глубокий инфильтративный эндометриоз усугубили течение заболевания, что привело к поражению седалищных нервов, парезу стопы. Течение заболевания было отягощено еще и очагом эндометриоза в правой ягодичной мышце с формированием и нагноением гематомы.
Случаи пареза нижних конечностей на фоне эндометриоза крайне редки. В одной из немногочисленных публикаций отмечено, что циклические боли в нижних конечностях могут быть связаны с тазовыми перитонеальными карманами, узлами эндометриоза или поверхностным эндометриозом заднелатеральной тазовой брюшины. Боль, связанная с этими поражениями, скорее является отраженной болью, исходящей из тазовой брюшины, чем прямым раздражением пояснично-крестцового сплетения седалищного нерва [18]. Другой обзор публикаций об эндометриозе седалищного нерва (63 случая в 32 исследованиях) дал анализ локализации поражения – чаще поражение отмечено с правой стороны. 67% зарегистрированных случаев эндометриоза седалищного нерва возникают справа в отличие от внутритазового эндометриоза, который в большей степени встречается слева и подтверждает теорию ретроградной менструации [19]. В более позднем материале представлен случай саркомы эндометриоза седалищного нерва [20]. Недавний систематический обзор случаев внетазового эндометриоза (за последние 20 лет) выявил 12 сообщений о случаях и серии случаев вовлечения внетазовых нервов или мышц [21]. В проспективном отчете о серии случаев с 2004 по 2016 гг. сообщалось о 259 случаях эндометриоза с интра- и экстраабдоминальным эндометриозом, включая поражение седалищного нерва [22]. Есть данные об изолированном эндометриозе седалищного нерва [23]. Примером эндометриоза левого седалищного нерва является случай, зарегистрированный у 25-летней женщины с постоянной болью в бедре в течение 2 месяцев до обращения к врачу общей практики. В конечном итоге она была направлена к ортопедической бригаде после отсутствия ответа на противовоспалительные препараты и физиотерапию, где была проведена микрохирургическая диссекция ткани эндометрия от седалищного нерва с хорошим послеоперационным результатом [24]. Средний интервал диагностики эндометриоза седалищного нерва с момента появления симптомов составляет 3,7 года [25]. В литературе имеется сообщение об одном случае эндометриальной стромальной саркомы низкой степени злокачественности, возникшей из-за эндометриоза седалищного нерва. Однако у пациентки был обширный внутритазовый эндометриоз в дополнение к поражению седалищного нерва [26]. Симптомы эндометриоза седалищного нерва могут сохраняться даже при купировании тазового эндометриоза. Показано, что медикаментозное лечение не помогает контролировать симптомы ишиаса при эндометриозе седалищного нерва [27, 23]. При наличии признаков повреждения нерва хирургическое вмешательство является предпочтительным вариантом [23].
Представленный случай демонстрирует сочетание тазового эндометриоза с поражением седалищного нерва и наличием очага в правой ягодичной мышцы. Такие пациенты требуют мультидисциплинарного подхода, в случаях хирургического вмешательства операции выполняются высокоспециализированными хирургами различных специальностей. При этом сложность выполняемого хирургического вмешательства нередко ассоциирована с осложнениями. Что касается медикаментозной терапии, то она должна подбираться индивидуально с возможными переходами на различные варианты (гестагены, агонисты) с исключением КОК, способных, как мы видим, усугублять глубокий инфильтративный эндометриоз.
Клинический случай № 5
Пациентка С., 53 года, в июне 2020 г. поступила в гинекологическое отделение клиники НИИАП ФБГОУ ВО РостГМУ с жалобами на тянущие боли внизу живота, больше слева, периодические выделения из половых путей в течение 1,5 месяцев. В 2007 г. оперирована по скорой помощи в связи с апоплексией правого яичника. Имеющаяся эндометриома левого яичника не удалена. В январе 2020 г. при УЗИ обнаружено образование левого яичника размером 60×56 мм. Пациентка от предложенного оперативного вмешательства отказалась. На повторном УЗИ в июне 2020 г. левый яичник представлен неоднородным образованием с множественными гетерогенными включениями, размеры 129,3×112 мм (рис. 12). Онкомаркеры в пределах референсных значений. Обратилась в НИИАП РостГМУ. Учитывая быстрый рост образования в постменопаузе, выполнены лапаротомия по Пфанненштилю, разъединение спаек органов малого таза и брюшной полости, удаление левого яичника, экстирпация матки с правой маточной трубой, оментэктомия, дренирование брюшной полости. При гистологическом исследовании выявлен эндометриоидный рак яичника с участками некрозов и воспалением.

В литературе описан подобный случай малигнизации эндометриомы после 8 лет наблюдения и лечения (агонисты гонадотропин-рилизинг-гормона, диеногест) – каждые 3 месяца проводился регулярный медицинский осмотр на онкомаркеры и УЗИ [28]. Примерно через 7 лет лечения результаты магнитно-резонансной томографии (МРТ) выявили высокоинтенсивные сигналы в двух опухолях яичников диаметром 35 мм или меньше. Уровень онкомаркера снизился. Однако позже пациентка сообщила о люмбаго и прошла тщательное медицинское обследование (примерно через 8 лет лечения). На УЗИ заподозрили злокачественную трансформацию опухоли правого яичника (увеличение опухоли и наличие солидного образования). МРТ показала образование в правом яичнике с максимальным диаметром 114 мм.
Считается, что диеногест обладает как прогестиновыми эффектами, так и способностью подавлять рост эндометриоидной ткани, ангиогенез и воспаление, а также способствовать апоптозу. Поскольку эти механизмы могут также снизить рост рака яичников, предполагается, что диеногест уменьшает вероятность злокачественной трансформации эндометриомы. Однако представленные данные не подтверждают эти предположения. Помимо этого случая, в Японии трижды зарегистрирована злокачественная трансформация эндометриом во время лечения диеногестом [28].
Эндометриоз имеет хроническое течение, зачастую требующее длительной терапии. Несмотря на то, что эндометриоз рассматривается как доброкачественное гормональное состояние, невозможно исключить его злокачественную трансформацию. Поскольку, обладая такими свойствами рака, как клеточная инвазия, неконтролируемый рост, способность к метастазированию, стимуляция неоангиогенеза, эндометриоз имеет свойство малигнизироваться в злокачественную опухоль [29]. Есть мнение, что в эндометриоидном очаге может развиваться практически любой вид ракового процесса [30]. Эндометриоз-ассоциированные злокачественные опухоли наиболее часто развиваются в яичниках. Клинически заболевание не всегда сопровождается болевым синдромом и, как мы видим в последнем наблюдении, может протекать бессимптомно. Однако существует вероятность быстрого прогрессирования образования в постменопаузе, что представляет собой опасность развития онкологических процессов. Риск злокачественной трансформации эндометриом увеличивается после 40 лет и при максимальном диаметре опухоли 6 см [31].
Хирургический подход к лечению эндометриом имеет свои pros&cons. С одной стороны, при первичной эндометриоме более 3 см в диаметре всегда есть вероятность «пропустить» злокачественную трансформацию, поэтому рекомендовано удаление эндометриом. С другой стороны, при оперативном вмешательстве происходит снижение овариального резерва, даже если операция выполняется опытным хирургом. Причем более выраженное снижение отмечено при повторных вмешательствах, следовательно, при рецидиве эндометриом и небольших размерах образования при отсутствии выраженного болевого синдрома предпочтительнее медикаментозное лечение.
После хирургического лечения эндометриоза женщинам в качестве медикаментозного лечения назначают гестагены минимум на 6 месяцев: дидрогестерон по 20–30 мг в день с 5-го по 25-й день менструального цикла либо по 20–30 мг в день непрерывно в зависимости от профиля пациенток. В случае отсутствия эффекта препаратами выбора являются агонисты гонадотропин-рилизинг-гормона+add-back терапия, но не более 6 месяцев из-за развития побочных эффектов [32]. Было показано, что гестагены обладают противовоспалительной и антиангиогенной активностью, что снижает прогрессию эндометриоидных гетеротопий и боль, связанную с эндометриозом. В настоящее время накоплено достаточно доказательных данных, свидетельствующих о равной эффективности гестагенов, используемых в терапии эндометриоза, тогда как профиль безопасности их существенно различается. В отличие от других гестагенов (диеногеста, норэтистерона) дидрогестерон высокоселективен в отношении рецепторов прогестерона, что минимизирует возможные побочные эффекты и положительно влияет на приверженность терапии. При этом использование циклического режима дидрогестерона представляется таким же эффективным для купирования боли, как и непрерывный режим применения гестагенов [33].
Заключение
Представленные клинические случаи еще раз подчеркивают необходимость выбора оперативного лечения в нужное время и в полном объеме, желательно однократно в течение жизни. Кроме того, крайне важен выбор препарата для послеоперационной терапии, ее достаточная длительность с точки зрения предупреждения рецидивов эндометриоза.



