При рассмотрении различных патологических состояний в гинекологии в настоящее время требуется обязательный учет роли микробиоты урогенитального тракта и кишечника, микроорганизмы в которых осуществляют самые различные физиологические функции, в том числе проявляют микробный антагонизм, обеспечивающий защиту от инфекции. Установлено, что для стабилизации колонизационной резистентности слизистой оболочки влагалища важное значение имеют биологически активные вещества, такие как органические кислоты и бактерициноподобные ингибирующие субстанции, вырабатываемые в основном лактобактериями и бифидобактериями, населяющими организм здоровых женщин.
Не вызывает сомнения, что исследование микробиоты влагалища особенно актуально для женщин во время беременности, поскольку именно эта экологическая ниша является источником симбионтных микроорганизмов для новорожденных. Считается доказанным, что источником бактериальной колонизации новорожденного в первые часы жизни являются микробиота матери, а также микроорганизмы, получаемые из окружающей среды, в том числе и от родовспомогательного персонала. Однако в настоящее время широко дискутируется проблема заселения организма новорожденного нормальной микробиотой путем транслокации микроорганизмов из просвета кишечника и генитального тракта матери в лимфу и системный кровоток с заносом в различные биотопы ребенка. Микроэкологические нарушения в кишечнике и нижних отделах генитального тракта беременных женщин могут приводить к осложнению беременности и родов, к ухудшению состояния здоровья новорожденных. Необходимо учитывать, что формирование нормобиоты вагинальной микроэкосистемы определяется многими эндо- и экзогенными факторами, а ее структура может значительно варьировать в зависимости от возраста, срока гестации, фазы менструального цикла, этнической принадлежности, характера питания, образа жизни, в том числе модели полового поведения и гигиенических особенностей.
Роль лактобактерий в нормализации микробиоты влагалища
В настоящее время получены данные, однозначно свидетельствующие о доминирующей роли лактобактерий в микробном сообществе влагалища. Ранее в качестве превалирующего вида здоровой вагинальной микроэкосистемы рассматривали вид Lactobacillus acidophilus. Однако совершенствование молекулярно-генетических методов диагностики, основанных на идентификации 16S рибосомальной РНК бактерий, позволило выявить генетическое разнообразие вагинальных лактобактерий 35 штаммов, выделенных у женщин из 7 стран мира [1]. Вагинальные изоляты, наряду с L. сrispatus, в условиях нормоценоза представлены L. gasseri (5%), L. jensenii (23%) и L. iners (15%) [2]. Полагают, что основным источником лактофлоры может быть кишечная микробиота. Однако вагинальная микроэкосистема у каждой здоровой женщины имеет свои индивидуальные особенности. В состав сопутствующей микробиоты могут входить бактерии, относящиеся к самым различным видам и родам: Pediococcus spp., Weissella spp., Streptococcus spp., Leuconostoc spp. и др. [3].
Лактобактериям принадлежит основная роль в регуляции вагинального микробиоценоза за счет выполнения целого ряда функций. Главная из них – поддержание низких значений pH влагалищной среды от 3,8 до 4,4 в результате выработки молочной, уксусной, масляной, янтарной и других короткоцепочечных жирных кислот. Кроме того, лактобактерии способны образовывать на поверхности слизистых оболочек влагалища биопленки, которые препятствуют адгезии к рецепторам эпителиоцитов других транзиторных микроорганизмов. Лактобактерии вырабатывают бактериальный лизоцим, стимулируют фагоцитарную активность нейтрофилов, синтез иммуноглобулинов, образование интерферона и интерлейкина-1, а также обладают повышенными иммуностимулирующими свойствами за счет иммуномодулятора – пептидогликана, основного компонента их клеточной стенки [4].
В составе микробиоценоза лактобактерии проявляют широкий спектр антагонистической активности в отношении патогенных и условно-патогенных микроорганизмов [4]. Антимикробная активность молочнокислых лактобактерий в первую очередь обусловлена продукцией неспецифических антимикробных метаболитов, таких как молочная кислота (МК) и другие органические кислоты, включая уксусную, пропионовую, масляную, перекись водорода, лизоцим, а также бактерициноподобные ингибирующие субстанции (BLIS — bacteriocin-like inhibitory substances) и др. [4, 5]. Антагонистические лактобактерии, продуцируя МК, перекись водорода и антимикробные пептиды, снижают риск развития восходящей инфекции, ингибируя рост патогенных и условно-патогенных микроорганизмов.
Поддержание лактобактериями стабильного уровня рН вагинального секрета
Роль, которую играют вагинальные лактобактерии в подавлении патогенных микроорганизмов, тесно связана с их способностью снижать рН вагинального секрета. Значение рН влагалища колеблется от 6,6 (±0,3) до 4,2 (±0,2) между 2-м и 14-м днем менструального цикла, при этом низкий уровень значений рН поддерживается секрецией органических кислот также и самими клетками влагалищного эпителия [6]. В настоящее время признано, что важнейшую экологическую функцию производства МК могут выполнять также представители других микробных таксонов [7]. Большинство бактерий и вирусов проявляют высокую чувствительность к низким значениям рН [8].
Влияние низких значений рН на различные функции слизистой оболочки влагалища
При исследовании влияния уровня диоксида углерода (CO2) и кислорода (O2) на уровень рН в вагинальной среде обнаружено, что цервико-вагинальное парциальное давление CO2 составляет 38 мм рт.ст. (5%) [9]; а парциальное давление O2 находится в диапазоне 4–14 мм рт.ст. (2%). При увеличении просвета влагалища, связанном с введением тампона [10], с сексуальным возбуждением [11] или половым актом, уровень CO2 быстро снижается и приводит к повышению pH. При этом в условиях пониженной концентрации кислорода вагинальные лактобактерии образуют в основном МК, но с повышением концентрации O2 (парциальное давление O2 160 мм рт.ст., или 21%) лактобактерии многих штаммов преимущественно продуцируют уксусную кислоту [12], а лактобактерии некоторых штаммов даже утилизируют ранее образованную МК [13].
Кроме того, рH среды влияет на широкий спектр иммунологических функций. Описана триггерная роль лактата в продукции цитокинов. Эксперименты in vitro выявили корреляцию между увеличением рН вагинального секрета и повышением уровня воспалительных цитокинов, таких как интерлейкины IL-1β, IL-6 IL-8, IL-10 и фактор некроза опухоли α (TNF-α) [14].
Описан эффект влияния уровня рН на синтез бактериоцинов [15]. Обнаружена зависимость выработки бактериоцинов от рН, что позволяет предположить регуляторную функцию рН в экспрессии генов бактериоцинов [16]. Опубликованы данные о стимуляции выработки низина и педиоцина при снижении pH [17].
Низкий уровень рН на слизистой оболочке влагалища связывают с уменьшением риска инфекций урогенитального тракта женщин, вызванных Trichomonas vaginalis [18], Neisseria gonorrhoeae и Chlamydia trachomatis [19], а также многочисленными видами условно-патогенных бактерий, приводящих к развитию бактериального вагиноза (БВ) [20].
Низкие значения рН во влагалище препятствуют проникновению через слизистую оболочку вирусных частиц ВИЧ-1 [21] и ВПГ-2 (HSV-2) [22].
Кроме того, показано снижение количества РНК ВИЧ-1 в цервиковагинальной жидкости у ВИЧ-положительных женщин с высокой концентрацией лактобактерий [23].
Кроме прямой инактивации возбудителей, низкие значения кислотности вагинальной жидкости способствуют замедлению захвата вирионов ВИЧ-1 цервиковагинальной слизью [24].
Участие перекиси водорода в поддержании стабильности микробиоты вагинальной экосистемы
Защитные свойства лактобактерий часто связывали со способностью производить перекись водорода (H2O2). Действительно, установлено, что H2O2 выделяют 95% клеток L. crispatus и 94% клеток L. jensenii, обнаруженных во влагалищных изолятах [2]. А. Aroutcheva и соавт. обнаружили среди лактобактерий вагинального происхождения примерно 80% штаммов-продуцентов H2O2 [25]. Однако в дальнейших исследованиях установлено, что и шеечно-влагалищная, и семенная жидкости активно подавляют способность лактобактерий выделять перекись водорода. Таким образом, маловероятно, что Н2О2 влагалищных лактобактерий играет важную роль в поддержании защитных свойств микробиоты.
Лактоцины – бактериоцины лактобактерий
Лактоцины (антимикробные пептиды или белки), секретируемые клетками почти всех видов лактобактерий, классифицируют по механизму действия, поскольку они могут вызывать или формирование пор в цитоплазматической мембране, или нарушение синтеза некоторых компонентов, например, клеточной стенки [26]. Однако некоторые исследования показывают, что использование бактериоцинов может привести к нарушению состава вагинальной микробиоты и развитию бактериального вагинита. Охарактеризован бактериоцин, продуцируемый клетками E. faecium 62-6 из вагинального секрета, который обладал широким спектром антимикробного действия против различных грамположительных бактерий (коринебактерий, стрептококков и энтерококков) вагинального происхождения, включая лактобактерии. Показано, что 6 из 100 штаммов Lactobacillus spp., выделенных из вагинальных образцов 75 женщин репродуктивного возраста, проявляли антагонистическую активность против бактерий G. vaginalis и Pseudomonas aeruginosa и вагинальных лактобактерий [27]. Таким образом, естественное ингибирование вагинальных лактобактерий бактериоцинами, выделяемыми другими микроорганизмами, может объяснить механизм развития бактериальных вагинитов.
Иммунитет слизистой оболочки влагалища
Помимо защитного эффекта эндогенной микробиоты влагалища, активность патогенных микроорганизмов сдерживается за счет локальных компонентов врожденной и приобретенной иммунной системы.
К основным компонентам врожденной иммунной системы относятся патоген-ассоциированные молекулярные структуры – PAMPs (Pathogen-associated molecular patterns), среди которых наиболее известны Toll-подобные рецепторы – TLRs (Toll-like receptors). Эпителиальные клетки, выстилающие влагалище, первыми вступают в контакт с микроорганизмами. TLRs, расположенные на их мембранах, отвечают за развитие вагинального врожденного иммунитета [28]. Выделяют 11 типов TLRs, специфически связывающихся с определенными патогенами [29]. Активация врожденного иммунного ответа развивается немедленно после распознавания патогена, в то время как для активации реакций приобретенного иммунитета требуется несколько суток. Эпителиальные клетки способны также выделять молекулы с неспецифическим противомикробным действием. Один из классов этих молекул – дефензинов включает положительно заряженные пептиды, которые способны быстро связываться с отрицательно заряженной поверхностью бактерий, что приводит к разрушению бактериальной мембраны и лизису бактерий [30]. Ингибитор секреторной лейкоцитарной протеазы (SLPI) активен как против грамположительных, так и против грамотрицательных бактерий, при этом показана его эффективность в отношении вирусов иммунодефицита человека [31]. Манноза-связывающий лектин представляет собой антимикробный белок, присутствующий в вагинальном секрете, он синтезируется в основном в печени, при этом его появление в секрете вагины до сих пор остается неясным. Данный белок распознает маннозу, N-ацетилглюкозамин и фукозу – углеводные фрагменты, присутствующие на поверхностях микробных клеток. Связывание белка с мембраной бактериальной клетки приводит к активации системы комплемента и лизису бактерий или к микробной опсонизации фагоцитами [32]. Показано, что женщины с недостаточным содержанием манноза-связывающего лектина более восприимчивы к развитию рецидивирующего кандидоза [33].
Пробиотики в лечении бактериальных вагинозов
В настоящее время пробиотики применяют для лечения и предотвращения рецидивов воспалительных заболеваний влагалища [34]. Однако противомикробная коррекция урогенитальных инфекций пробиотиками не всегда эффективна. По данным Европейских клинических рекомендаций IUSTI 2018 г. по противорецидивному лечению БВ, «не найдено достаточно значимых свидетельств за или против применения пробиотиков для лечения бактериального вагиноза» [35]. Предполагают, что отсутствие эффективности пробиотиков в случае рецидивирующих вагинитов обусловлено образованием патогенными микроорганизмами бактериальных биопленок [36]. Необходимо учитывать, что основная функция пробиотических штаммов заключается в создании условий для восстановления собственной микробиоты, поскольку время пребывания транзиторных лактобактерий обычно не превышает двухнедельного срока.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Объекты исследования
1. Пробиотические лактобактерии:
- Комплекс №1 (L. crispatus, L. rhamnosus, L. gasseri, L. jensenii);
- Комплекс №2 (L. gasseri, L. fermentum, L. plantarum);
- Комплекс №3 (L. crispatus, L. brevis, L. acidophilus);
- L. casei.
2. В качестве источника МК с гликогеном использовали Лактагель (производство «Орион Фарма») – вагинальный гель для восстановления собственной лактофлоры влагалища.
3. Тестовые культуры условно-патогенных микроорганизмов:
- Escherichia coli штамм М17 – из коллекции ГУ «Научно-исследовательский институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН»;
- Staphylococcus aureus штамм 65 – из коллекции ГУ «Научно-исследовательский институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН»;
- Candida albicans 8 из коллекции СПбГУ.
Среды для выращивания тестовых культур микроорганизмов
Для выращивания лактобактерий использовали среды:
- питательную среду МРС (среда Рогоза, Lactobacillus MRS Agar, Himedia, Индия);
- бульон МРС (Lactobacillus MRS Broth, Himedia, Индия).
Для выращивания Escherichia coli М17 и Staphylococcus aureus 65 использовали среды:
- колумбийский агар (Columbia agar base (EurPharm) (ISO 10272), Laboratorios CONDA, S.A. 500 г, США);
- бульон с сердечно-мозговой (СМБ) вытяжкой, 500 г (ФСЗ 2009/03707) M210-500G (HiMedia, Индия).
Для выращивания C. albicans 8 использовали среды:
- среду Сабуро с глюкозой Broth (Himedia, Индия);
- агар (среда Сабуро с глюкозой Agar, Himedia, Индия).
Методы
1. Определение влияния разных концентраций МК в комплексе с гликогеном на рост и развитие условно-патогенных микроорганизмов методом лунок.
Готовили ряд разведений МК в составе Лактагель. Разведения готовили на основе бульона МРС (Lactobacillus MRS Broth, Himedia, Индия) от 4,5 до 225 мг. МК в каждом разведении помещали в лунки агара – плотную питательную среду МРС (Lactobacillus MRS Agar, Himedia, Индия). Для этого в остывший до 30–35°С агар вводили суспензию микроорганизмов, тщательно перемешивали и выливали в чашку Петри. После застывания агара в нем вырезали лунки, в которые вносили по 0,2 мл соответствующего разведения Лактагель. Образцы культивировали в оптимальных для микроорганизмов условиях в термостате в течение 24–48 ч. Результаты эксперимента оценивали визуально. Действие МК в комплексе с гликогеном анализировали визуально по наличию зоны задержки роста в толще агара.
2. Определение количества микроорганизмов в питательной среде, метод Коха.
Исследуемые культуры вносили в питательную среду в количестве 0,1 об. %. В среде культивирования доводили рН до различных значений, вносили одинаковое количество МК в комплексе с гликогеном. Культивирование проводили в стандартных условиях при 37°С 24 ч. В качестве контроля использовали культуры лактобактерий, выращенные в среде культивирования МРС бульон со стандартным значением рН 5,4±0,2.
Из всех образцов отбирали образовавшуюся суспензию бактериальных клеток и высевали на плотные питательные среды методом Коха. Высевы культивировали 24 ч при температуре 37°С. Для определения КОЕ выросшие колонии подсчитывали в каждой чашке и рассчитывали среднее количество КОЕ по стандартной методике.
3. Электронно-микроскопическое исследование. Трансмиссионная электронная микроскопия (ТЭМ).
Метод ультратонких срезов. Морфологический анализ клеток микроорганизмов проводили, исследуя ультратонкие срезы в трансмиссионном электронном микроскопе JEM100C (JEOL, Япония). Пробы отбирали из зон подавления роста клеток, в том числе с участков визуально не выявляемого роста микроорганизмов. Особенность подготовки образцов заключалась в сохранении исходной структуры и пространственного расположения исследуемых объектов. С этой целью участки роста бактерий, вырезанные вместе с агаром, предварительно фиксировали в 2,5% растворе глутарового альдегида на буфере Хэнкса (pH 7,2) при температуре 4°C, наливая фиксатор в основание агаровой пластинки. Пробы промывали дистиллированной водой и подвергали вторичной фиксации в 1% водном растворе четырехокиси осмия (ОsО4), проводя трехкратную отмывку от фиксатора. Затем препараты обезвоживали в серии этиловых спиртов возрастающей концентрации, в смеси спирта и ацетона и в ацетоне, после чего заливали в смолу Spurr. Из заливочных блоков делали заготовки на пирамитоме Pyramitome (LKB-11800, Швеция), что обеспечивало возможность правильно ориентировать исследуемый объект и оценивать местоположение инактивированных участков при дальнейшем изготовлении ультратонких срезов. Срезы готовили на ультратоме LKB-8800 (LKB, Швеция), их окраску проводили уранилацетатом и цитратом свинца. Детали разработанного нами метода подробно описаны ранее [4]. Препараты просматривали в трансмиссионном электронном микроскопе JEM 100C (JEOL, Япония) при ускоряющем напряжении 80 кВ.
Статистическую обработку полученных данных проводили с использованием программы Statistics 19. Различия с p<0,05 считались статистически значимыми.
РЕЗУЛЬТАТЫ
Определение спектра антимикробной активности и минимальной подавляющей концентрации МК в комплексе с гликогеном
Определение чувствительности условно-патогенных микроорганизмов к МК в комплексе с гликогеном проводили на плотной питательной среде по методике, представленной выше. Посевы культивировали в оптимальных для каждого микроорганизма условиях в термостате в течение 24–48 ч. Результаты эксперимента оценивали визуально. Показано, что все исследованные культуры S. aureus 65, E. coli М17 и C. albicans 8 проявили чувствительность к МК в комплексе с гликогеном в исходной концентрации 225 мг (рис. 1). По мере разведения МК зона задержки роста пропорционально уменьшалась и при разведении до 45 мг зону задержки роста в культурах S. aureus 65, E. coli М17 не наблюдали. Для C. albicans 8 концентрация МК, при которой зоны задержки не выявляли, составила 70 мг. Таким образом, при данном методе исследования минимальная подавляющая концентрация МК в комплексе с гликогеном для S. aureus 65, E. coli М17 составляла 45 мг, а для C. albicans 8 –70 мг.
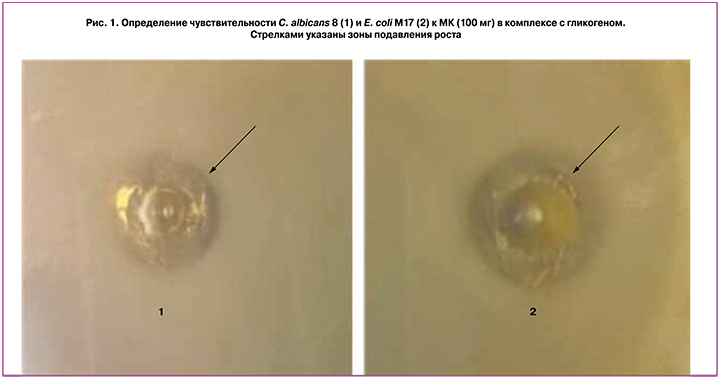
Определение влияния МК с гликогеном на рост условно-патогенных микроорганизмов в присутствии пробиотических лактобактерий и их комплексов
Показатели количества клеток условно-патогенных микроорганизмов, полученные при совместном культивировании с лактобактериями в присутствии МК с гликогеном и без нее, представлены на рисунке 2.
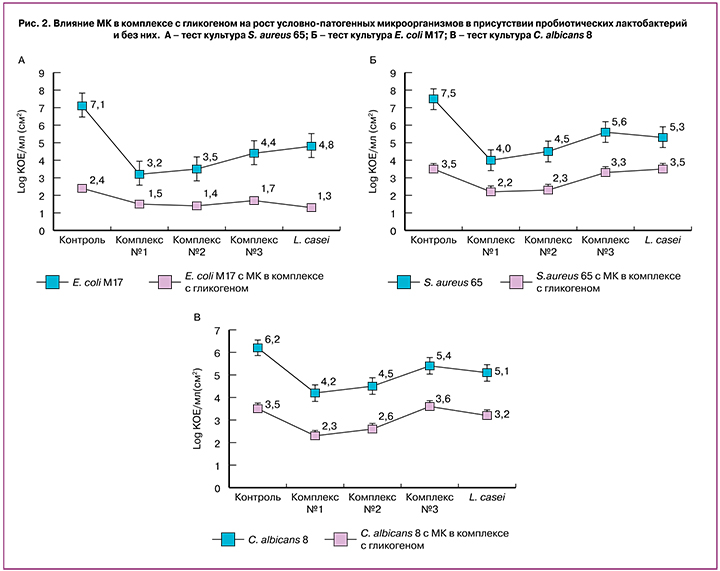
Полученные данные свидетельствуют о подавлении роста всех тестовых культур условно-патогенных микроорганизмов S. aureus 65, E. coli М17 и C. albicans 8 как в присутствии МК в комплексе с гликогеном, так и совместно с пробиотическими лактобактериями. При этом клетки E. coli М17 проявляли большую реакцию на антагонистическое воздействие, чем клетки S. aureus 65 и C. albicans 8.
Действие МК в комплексе с гликогеном на все тестируемые культуры выражалось в подавлении роста клеток в 2–4 раза относительно контрольных показателей, что в среднем было в 1,5–3,5 раза более эффективным, чем действие живых пробиотических культур лактобактерий.
При культивировании каждой тестовой культуры S. aureus 65, E. coli М17 и C. albicans 8 совместно с пробиотическими лактобактериями в присутствии МК в комплексе с гликогеном обнаружено, что степень подавления роста условно-патогенных микроорганизмов сравнима с показателями подавления в случае действия МК в комплексе с гликогеном или выше в 1,5 раза. Таким образом, обнаружено сочетанное действие пробиотических лактобактерий и МК в комплексе с гликогеном на тестовые условно-патогенные микроорганизмы (рис. 2). Контроль – это рост тестовой культуры при рН=7. А – тест-культура S. aureus 65; Б – тест-культура E. coli М17; С – тест-культура C. albicans 8.
Моделирование условий роста пробиотических лактобактерий при различных значениях рН в присутствии МК с гликогеном
Для определения влияния рН на рост пробиотических лактобактерий в присутствии МК в комплексе с гликогеном готовили ряд разведений на основе жидкой среды МРС (рН=5,4±0,2), в которых устанавливали различные исходные значения рН:
- в контроле – pH 6,2±0,2;
- в среде с добавлением МК с гликогеном – pH 5,8±0,2;
- в среде с добавлением щелочи – pH 9,0±0,2;
- в среде с добавлением щелочи и МК с гликогеном – pH 7,2±0,2.
После этого во все среды добавляли живые пробиотические лактобактерии не более 10% объема.
В последнем варианте на начальном этапе рН доводили до 9,0±0,2, затем вносили клетки пробиотических лактобактерий, выдерживали в течение 30 минут при комнатной температуре, затем добавляли МК с гликогеном и измеряли рН, значения которого достигали 7,2±0,2.
 Все образцы помещали в термостат и выращивали при температуре 37°С в течение 24 ч. Для определения количества микроорганизмов в пробах проводили определение оптической плотности на спектрофотометре (UNICO 2800, Россия) при длине волны 600 нм и делали высевы на плотную питательную среду с последующим подсчетом колоний и определением КОЕ в миллилитрах.
Все образцы помещали в термостат и выращивали при температуре 37°С в течение 24 ч. Для определения количества микроорганизмов в пробах проводили определение оптической плотности на спектрофотометре (UNICO 2800, Россия) при длине волны 600 нм и делали высевы на плотную питательную среду с последующим подсчетом колоний и определением КОЕ в миллилитрах.
Показатели количества клеток пробиотических лактобактерий при культивировании в присутствии МК в комплексе с гликогеном при разных значениях рН представлены на рис. 3.
Полученные данные свидетельствуют о том, что рост лактобактерий напрямую зависел от исходной рН в среде культивирования. Так, при оптимальных значениях рН в питательной среде наблюдали активный рост всех пробиотических лактобактерий. Добавление МК в комплексе с гликогеном в стандартную среду МРС не вызывало значительных изменений числа лактобактерий. Защелачивание среды (увеличение рН до 9,0±0,2 при добавлении в питательные среды 0,1 n раствора NaOH) приводило к снижению роста всех пробиотических лактобактерий в 1,6 раза, или на 3 порядка. Присутствие МК в комплексе с гликогеном в среде выращивания со щелочным значением рН вызывало увеличение числа микроорганизмов, но их количество все же было меньше, чем в контрольном варианте, на 1–2 порядка (рис. 3).
Электронно-микроскопический анализ клеток всех исследованных в работе штаммов пробиотических лактобактерий не выявил изменений морфологических свойств лактобактерий и ультратонкого строения их клеток ни в контрольных условиях, ни в присутствии МК в комплексе с гликогеном (рис. 4).

Электронно-микроскопическое исследование клеток условно-патогенных микроорганизмов, использованных в качестве тест-культур, свидетельствовало о деструктивном характере воздействия на них МК в комплексе с гликогеном. На всех исследованных ультратонких срезах тест-культур микроорганизмов выявлены нарушения в строении клеточной мембраны, приводящие к деформации клеточной стенки и цитоплазмы клеток (рис. 5).
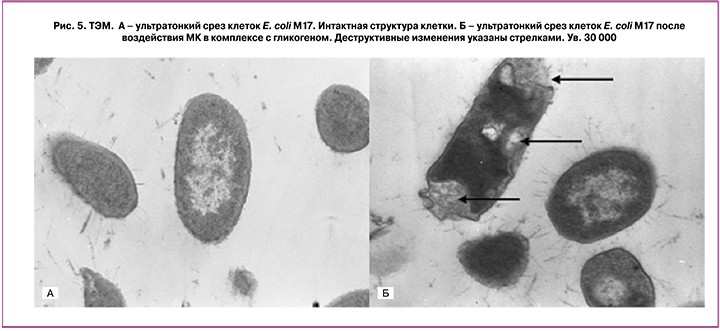
Изменения морфологических свойств клеток различных видов микроорганизмов S. aureus 65, E. coli М17 и C. albicans 8 под действием МК в комплексе с гликогеном свидетельствовали об избирательной антимикробной активности МК в отношении условно-патогенных представителей микробиоты. При этом никакого негативного влияния на структуру и функции лактобактерий, которые составляют основу нормальной микробиоты влагалища, присутствие МК не оказывало.
ОБСУЖДЕНИЕ
В настоящее время известно, что развитие воспалительного процесса любой локализации, в том числе в урогенитальном тракте, происходит на фоне нарушения кислотно-щелочного баланса.
Согласно современным критериям оценки состояния нативности слизистой оболочки влагалища, значение рН выше 4,5 соответствует диагностическому критерию БВ [37]. При патологических состояниях влагалища зарегистрированы значения pH выше 6,5, при этом показано, что повышение уровня рН коррелирует со снижением уровня лактата и приводит к развитию локального воспаления [38].
В исследованиях ряда авторов показана способность МК к инактивации широкого спектра возбудителей инфекций урогенитального тракта, в том числе N. gonorrhoeae [39], а также уропатогенных кишечных палочек [40].
Ранее в экспериментальной работе нами показано, что МК, обладая противомикробным действием, изменяет морфологические свойства и функциональное состояние клеток ряда условно-патогенных бактерий и микроскопических грибов, препятствуя формированию ими микробных сообществ в виде биопленок [41].
Результаты, полученные в настоящем исследовании, посвященном определению влияния МК с гликогеном на условно-патогенные микроорганизмы S. aureus 65, E. coli М17, C. albicans 8, полностью согласуются с данными литературы об ингибирующей роли лактата (рис. 1, 2). При прямом контакте микроорганизмов с комплексом МК (45 мг/мл) и гликогеном наблюдали полную задержку роста S. aureus 65, E. coli М17 и 70 мг/мл C. albicans 8. Воздействие МК в концентрации, уменьшенной до 15 мг/мл, приводило к снижению числа всех микроорганизмов в среднем от 1,5 до 3 раз. Совместное выращивание с лактобактериями пробиотических штаммов приводило к снижению численности клеток условно-патогенных штаммов в среднем в 2 раза (рис. 2).
Исследование антимикробной активности продемонстрировало практически совпадение эффектов комплекса МК с гликогеном в присутствии и без добавления пробиотических штаммов лактобактерий.
Наблюдаемый эффект свидетельствует о повышенной активности комплекса МК с гликогеном в качестве антимикробного агента, при этом показана корреляция между бактерицидным воздействием и концентрацией МК.
Полученные данные свидетельствуют о важной роли бактерицидного воздействия вагинальной МК при преобладании лактобактерий в составе микробиоты влагалища in vivo.
В настоящее время при обследовании микробиоты влагалища значительного числа женщин выявляется замена лактобактерий, продуцирующих МК, на грамотрицательные и грамположительные условно-патогенные бактерии, свидетельствующая о БВ.
Необходимость восстановления структуры собственной микробиоты после антибактериальной терапии, лечения вагиноза или вагинита предполагает два возможных варианта воздействия: 1 – использование пробиотических штаммов лактобактерий и 2 – введение комплекса МК с гликогеном для быстрого воздействия.
Использование пробиотических лактобактерий предполагает осуществление ими транзиторной функции, т.е. временное пребывание на слизистых оболочках, выработку кислот в результате метаболических процессов и постепенное исчезновение из организма в течение 2 недель после последнего применения препарата. Основная цель применения МК с гликогеном заключается в неотсроченной коррекции условий для восстановления индивидуального состава микробиоты влагалища – оптимизации уровня кислотности и обеспечения питательным субстратом. При этом после прекращения применения восстановленная популяция аутентичных лактобактерий способна самостоятельно поддерживать низкий уровень рН во влагалище – необходимое условие поддержания нормальной микробиоты. Данный вывод подтверждается в модельных экспериментах по исследованию влияния различных значений рН на развитие пробиотических лактобактерий. Приведенные в статье экспериментальные данные свидетельствуют о положительном воздействии комплекса МК с гликогеном на развитие лактобактерий при неблагоприятных для них значениях рН 9,0±0,2. Показано, что число КОЕ всех исследованных в работе пробиотических лактобактерий через сутки выращивания при рН 9,0±0,2 было в среднем на 3 порядка меньше, чем в контроле. При этом добавление в среду культивирования с рН 9,0±0,2 МК с гликогеном в концентрации 15 мг/мл позволяло лактобактериям через сутки достичь уровня КОЕ лишь на 1 порядок меньше, чем в контроле (рис. 3).
При электронно-микроскопическом исследовании морфологических свойств пробиотических лактобактерий после воздействия комплекса МК с гликогеном деструктивных изменений в клетках обнаружено не было, клетки сохраняли интактную структуру.
В то же время исследование ультратонких срезов патогенных микроорганизмов выявило, что действие МК с гликогеном приводит к появлению деструктивных изменений в клетках, проявляющихся в нарушении цитоплазматических мембран и интактной структуры цитоплазмы.
Отдельного внимания заслуживает факт обнаружения деструктивных изменений в присутствии МК с гликогеном в клетках микроскопических грибов C. albicans 8, что подтверждает не только бактерицидный, но и микоцидный эффект воздействия данного комплекса.
Полученные результаты указывают на возможность применения комплекса МК с гликогеном в качестве эффективного средства для коррекции микробиоты влагалища in vivo. МК с гликогеном могут способствовать стабилизации рН вагинального секрета и эффективно воздействовать на клетки условно-патогенных бактерий и микроскопических грибов рода Candida, разрушая их и приводя к быстрому восстановлению естественной структуры микробиоты влагалища.
ЗАКЛЮЧЕНИЕ
Одним из факторов естественной эффективной защиты от БВ и урогенитальных инфекций женских половых путей является поддержание низких значений рН за счет образования МК лактобактериями. В настоящее время МК признана в качестве наиболее физиологического средства саморегуляции структуры микробиоты влагалища и комплексного лечения БВ. В данном экспериментальном исследовании продемонстрировано, что добавление в щелочную среду, имитирующую условия воспалительного процесса, МК вызывает активный рост лактобактерий, которые являются главным компонентом нормальной микробиоты влагалища. Электронно-микроскопическое исследование установило наличие бактерицидного и микоцидного эффекта комплекса МК с гликогеном на условно-патогенные микроорганизмы. При этом деструктивные изменения в клетках лактобактерий отсутствуют. Добавление комплекса МК и гликогена подавляет рост условно-патогенных микроорганизмов в 2–4 раза эффективнее, чем исследованные пробиотические культуры. Полученные результаты указывают на возможность применения МК с гликогеном в качестве эффективного фактора для коррекции микробиоты влагалища in vivo. Показано, что МК с гликогеном могут способствовать стабилизации рН вагинального секрета и эффективно воздействовать на клетки условно-патогенных микроорганизмов, приводя к быстрому восстановлению естественной структуры микробиоты влагалища.



