Одной из наиболее актуальных проблем современной гинекологии является эндометриоз – сложное гетерогенное хроническое воспалительное заболевание, определяющееся доброкачественным ростом вне матки ткани, подобной эндометрию по морфологическим и функциональным свойствам. Клинически различают следующие формы заболевания: эндометриоидные импланты на поверхности брюшины малого таза и яичников (перитонеальный эндометриоз), кисты яичников (эндометриомы) и солидные образования сложной структуры. Эндометриоидные поражения делят на подтипы: поверхностный перитонеальный, глубокий (инфильтрирующий) и яичниковый (эндометриомы), причем у одного и того же пациента может существовать более одного подтипа. Наиболее распространенной формой заболевания является поверхностный перитонеальный эндометриоз [1–3].
Образование очагов эндометриоидного поражения диагностируется у 7–10% женщин, связано с хронической болью в тазу, бесплодием, усталостью, что оказывает существенное влияние на качество жизни женщины. Несмотря на интенсивные научные и клинические исследования, этиология и патофизиология эндометриоза недостаточно выяснены [4, 5]. В настоящее время большинство исследователей склоняются к мнению о том, что развитие эндометриоза связано с комплексом патологических изменений, включающим в себя генетические и эпигенетические, гормональные, иммунологические, анатомические и другие факторы [6].
Иммунная система, в норме ответственная за обнаружение и удаление аномально растущей ткани, может играть центральную роль в патогенезе эндометриоза [7, 8]. Данное положение подтверждается результатами исследований, свидетельствующих об активном участии иммунной системы в развитии эндометриоза [9–11]. При этом ключевыми эффекторами являются клетки и гуморальные факторы системы врожденного иммунитета (NK-клетки, макрофаги, нейтрофилы, дендритные клетки). Известно, что некоторые субпопуляции эффекторных клеток выполняют и регуляторную функцию.
У женщин с эндометриозом наблюдали изменения в популяциях иммунных клеток, макрофагов, нейтрофилов и дендритных клеток, и нарушение их функции [3, 11–13]. Показано, что у перитонеальных макрофагов нарушен процесс фагоцитоза, а NK-клетки обладают пониженной цитотоксичностью, положительно коррелирующей с тяжестью заболевания [11, 12].
Естественные клетки-киллеры (NK-клетки) обладают такими функциями, как неограниченная MHC цитотоксичность и выработка цитокинов. Субпопуляции NK-клеток, проявляющие функциональные различия в цитотоксичности, продукции цитокинов и регуляторной способности, идентифицируются по интенсивности экспрессии CD16- и CD56-маркеров. NK-клетки с высокой плотностью экспрессии CD56 на клеточной поверхности (CD56bright) и с низкой (CD56dim) обладают различными функциональными свойствами. CD56brightCD16-/dim-NK-клетки считаются эффективными продуцентами цитокинов с иммунорегуляторными свойствами, но способны становиться цитотоксическими при активации, в то время как CD56dim-NK-клетки проявляют большую цитотоксичность, экспрессируя больше иммуноглобулиноподобных рецепторов, а также Fcγ-рецепторы (CD16) [14–16].
Большинство NK-клеток не экспрессируют Т- или В-клеточные рецепторы, распознающие антиген. Но среди них выделяют субпопуляцию NKT-клеток, экспрессирующих Т-клеточный рецептор (TCR). Известны два варианта TCR, обозначаемые как αβTCR и γδTCR, различающиеся составом полипептидных цепей антигенраспознающего участка. Выявляется субпопуляция NK-клеток, экспрессирующих gdTCR, которые, как предполагается, обладают регуляторными свойствами.
Наиболее распространенными иммунными клетками, присутствующими в поражениях эндометриоза, имеющими решающее значение для роста, развития, васкуляризации и иннервации поражений эндометриоза, являются макрофаги, предшественники которых – моноциты находятся в кровотоке и перитонеальной жидкости. Различают две основные субпопуляции моноцитов: классическая (CD14highCD16low) и неклассическая (CD14lowCD16high), идентифицируется также промежуточная субпопуляция (CD14highCD16high) [17, 18]. При различных заболеваниях выявляется изменение количества и соотношения субпопуляций моноцитов [18, 19]. При воспалении классические моноциты перемещаются в ткани, дифференцируются в макрофаги или дендритные клетки [20] и выполняют такие функции, как клиренс апоптотических тел, стимуляция ангиогенеза и восстановление целостности тканей [21]. Неклассические моноциты, участвующие в обеспечении иммунологического контроля сосудистой сети и окружающих тканей, также рекрутируются в ткани во время воспаления, но несколько позже [22, 23].
Изучение иммунных нарушений при эндометриозе проводится на клеточном и молекулярном уровнях, в клинических исследованиях и на экспериментальных моделях, однако до сих пор недостаточно выяснены вопросы о том, какие иммунные механизмы обеспечивают формирование эндометриоидных очагов и какие изменения в содержании молекулярных и клеточных факторов приводят к развитию эндометриоза. Выявлена функциональная роль макрофагов при воспалении и травмах, однако мало известно о фенотипической гетерогенности моноцитов и изменениях соотношения их субпопуляций на системном и локальном уровнях при эндометриозе. Недостаточно известно также о соотношении цитотоксических и регуляторных субпопуляций NK-клеток при эндометриозе различной степени распространения. Поскольку эти вопросы важны для понимания механизмов иммунных нарушений при данной патологии, необходимо учитывать не только изменения в количестве клеток разных субпопуляций, но и в их соотношении.
Цель данного исследования состояла в изучении особенностей фенотипа субпопуляций клеток врожденного иммунитета в периферической крови и перитонеальной жидкости женщин с эндометриозом.
Материалы и методы
В проспективное исследование были включены 65 пациенток, наблюдавшихся и оперированных в гинекологическом отделении ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ. Группу исследования составили 40 пациенток с наружным генитальным эндометриозом. Диагноз эндометриоза был установлен на основании интраоперационного обследования и подтвержден обзорным гистологическим исследованием удаленных очагов эндометриоза. Женщины с эндометриозом разделены на 2 подгруппы в соответствии со степенью распространения поражения: I–II степени (ЭМ-1, n=12) и III–IV степени (ЭМ-2, n=28). Контрольную группу составили 15 женщин (9 практически здоровых фертильных женщин и 6 женщин, оперированных лапароскопическим доступом, с наличием неполной внутриматочной перегородки и отсутствием эндометриоидных поражений).
Критерии включения в группу исследования: возраст пациенток 18–45 лет; подтвержденный диагноз «наружный генитальный эндометриоз); подписанное информированное согласие на участие в исследовании. Критерии исключения: злокачественные новообразования; острые воспалительные заболевания органов малого таза; тяжелая сопутствующая экстрагенитальная патология.
Кровь для анализа у женщин с эндометриозом забирали натощак из локтевой вены на 13–24-й день цикла перед оперативным вмешательством, перитонеальную жидкость собирали после лапароскопического вхождения в брюшную полость, в контрольной группе кровь и перитонеальную жидкость забирали на 15–23-й день цикла. Фенотипирование лимфоцитов периферической крови и перитонеальной жидкости осуществлялось методом проточной цитометрии с помощью моноклональных антител (мАт) (Becton Dickinson и eBioscience, США), меченных FITC, PE или АРС. Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45 (Dako, Дания). Оценивалось содержание субпопуляций NK-клеток (СD56+СD16+), моноцитов (СD14+СD16+). Т-регуляторные клетки определяли как клетки, экспрессирующие Т-клеточный рецептор типа γδ (TCRγδ, или TCRgd), а также Трег с фенотипом CD4+CD25+CD127low/-. Анализ проводили на проточном цитофлуориметре Navios (Beckman Coulter, США) с использованием программы Kaluza.
Статистический анализ
Статистическая обработка данных проводилась с использованием пакета Microsoft Office Excel 2007 и программы MedCalc v16.8. Проверку гипотезы о нормальном распределении осуществляли, используя критерии Колмогорова–Смирнова и Шапиро–Уилка. Данные представлены средней арифметической величиной и стандартным отклонением (M (SD)). В случае отклонения распределения количественных признаков от нормального данные были представлены как медиана и интерквартильный размах (Ме (Q1;Q3)). Проверку статистических гипотез об отсутствии межгрупповых различий количественных признаков в нескольких группах осуществляли с помощью критерия Краскела–Уоллиса с последующим апостериорным анализом.
Качественные данные представлены как абсолютное значение (n) и %, для их сравнения был использован точный тест Фишера. Различия считали значимыми при p<0,05.
Результаты
Клинико-анамнестическая характеристика женщин с эндометриозом и контрольной группы представлена в таблицах 1 и 2.
В целом различия в возрасте, индексе массы тела, среднем возрасте менархе, времени менструации между пациентами и контролем не были статистически значимыми. Отмечались различия между группами женщин с эндометриозом (ЭМ-1 и ЭМ-2) и каждой из них с контролем.
Болезненные менструации и боли внизу живота, не связанные с менструацией, наблюдались значимо чаще у женщин с эндометриозом. Диспареуния отмечалась чаще среди пациенток группы ЭМ-2, по сравнению с ЭМ-1 и контрольной группой.Количество родов было меньше, а бесплодие имело место чаще в группе женщин с ЭМ-2 при сравнении с контролем. Бесплодием страдали треть женщин в группе ЭМ-1 и половина женщин в группе ЭМ-2, значимо меньше по сравнению с контролем. В наследственном анамнезе статистически значимо чаще отмечалось наличие онкологических заболеваний у близких родственников пациенток с ЭМ-2 при отсутствии указанных заболеваний в контроле. По наличию гинекологической патологии группы пациенток между собой не различались.
Существенных различий в частоте аллергических заболеваний (поллиноз, лекарственная аллергия), заболеваний органов дыхательной, сердечно-сосудистой, мочевыделительной систем и заболеваний желудочно-кишечного тракта между группами не наблюдалось. Различий между группами по частоте ожирения не выявлено.
Различий по ранее перенесенным негинекологическим оперативным вмешательствам (аппендэктомия) и операциям по поводу эндометриоза между группами женщин с эндометриозом не наблюдалось.
Наиболее выраженными жалобами у пациенток явились боли внизу живота, не связанные с менструацией, не имевшие места у женщин из группы контроля; болезненные и/или обильные менструации, диспареуния, значительно чаще наблюдавшиеся у женщин с эндометриозом по сравнению с контрольной группой.
При осмотре у пациенток в группе ЭМ-2 чаще, чем у пациенток в группе ЭМ-I, отмечалась болезненность при пальпации придатков матки (у 100% и у 41,6% соответственно, р<0,0001) и при пальпации крестцово-маточных связок (у 81,5% и у 25% соответственно, р<0,0001). В группе ЭМ-2 у пациенток чаще определялся спаечный процесс в малом тазу (у 81,5% и 58,3%, р<0,1329).
При сравнительном анализе показателей общего содержания лейкоцитов в крови женщин с эндометриозом до операции не выявлено различий между группами ЭМ-1 и ЭМ-2, но определено значимое увеличение количества этих клеток по сравнению с группой контроля (табл. 3). Изменение количества лейкоцитов происходило в основном за счет увеличения доли нейтрофилов.

Доля лимфоцитов в периферической крови женщин с эндометриозом была значимо снижена, а количество нейтрофилов увеличено в обеих группах по сравнению с контролем, но различий в содержании популяций этих клеток в крови женщин с эндометриозом между группами ЭМ-1 и ЭМ-2 не выявлено. По сравнению с контрольной группой в обеих группах женщин с ЭМ значимо выше соотношение (или нейтрофильный индекс, равный НФ/ЛФ) этих клеток (табл. 3). Значимых изменений доли моноцитов у женщин с эндометриозом по сравнению с контрольной группой не выявлено, однако абсолютное количество их увеличено (р1-к=0,01, р2-к=0,01).
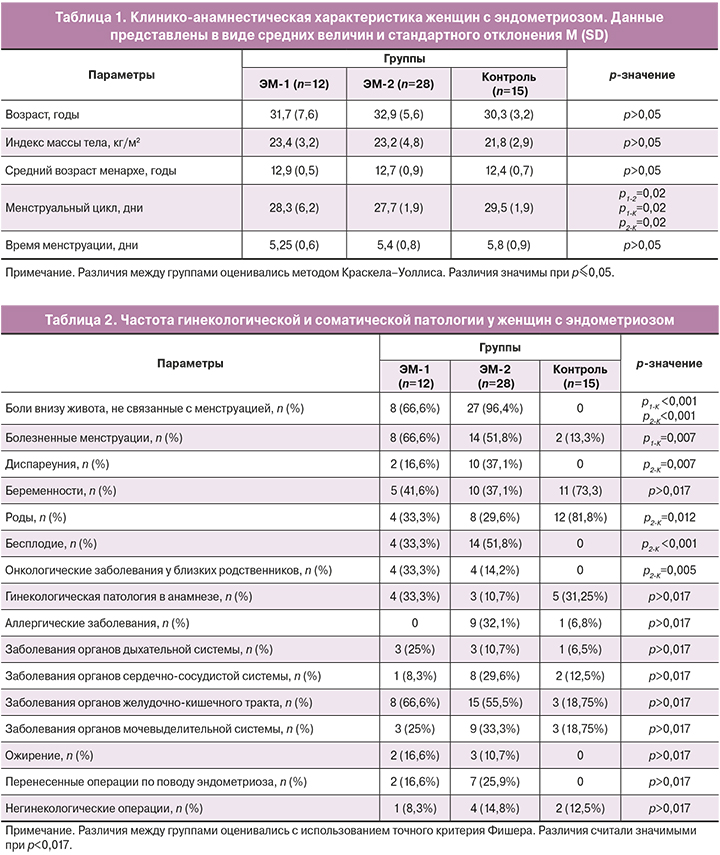
Результаты определения содержания субпопуляций эффекторных (CD3+CD56+CD16+, CD3-CD56+CD16+ и CD56dimCD16bright) и регуляторных (CD56brightCD16dim) NK-клеток в периферической крови у исследуемых женщин с эндометриозом и в контрольной группе до оперативного вмешательства, а также в перитонеальной жидкости, полученной интраоперационно, представлены на рисунке 1.
Различия между группами одной биологической жидкости оценивались методом Краскела–Уоллиса.
В периферической крови женщин с эндометриозом значимых изменений в субпопуляциях NК-клеток по сравнению с контрольной группой не отмечено. При этом в перитонеальной жидкости этих женщин более выражены различия в субпопуляционном составе мононуклеарных клеток, чем в периферической крови. В перитонеальной жидкости наблюдается существенное увеличение доли цитотоксических СD3-CD56+CD16+- и регуляторных CD56brightCD16dim-клеток по сравнению с контролем. Значимых различий в количестве других субпопуляций NК-клеток не выявлено.
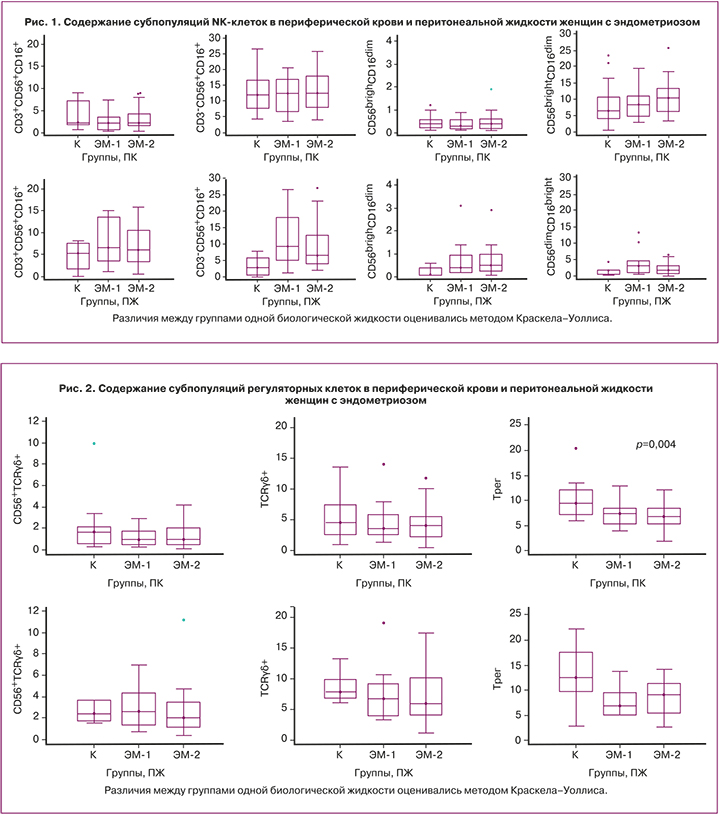
Результаты определения содержания регуляторных клеток, экспрессирующих Т-клеточный рецептор типа γδ (TCRγδ, или TCRgd), а также регуляторных Т-клеток (Трег) с фенотипом CD4+CD25+CD127low/-, представлены на рисунке 2.
Различия между группами одной биологической жидкости оценивались методом Краскела-Уоллиса.
У женщин с разной степенью распространенности эндометриоза (ЭМ-1 и ЭМ-2) значимых различий с контрольной группой по содержанию субпопуляции CD56+TCRgd и TCRgd-клеток в периферической крови не выявлено, но доля Tрег с фенотипом CD4+CD25+CD127low/- значимо меньше в обеих группах (р1-к=0,004, р2-к=0,004). В перитонеальной жидкости различие с контролем в содержании регуляторных клеток было статистически незначимым.
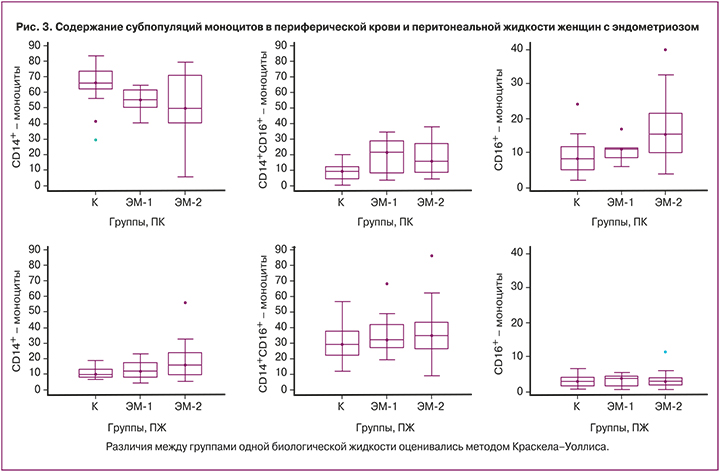
Содержание субпопуляций моноцитов в периферической крови и перитонеальной жидкости существенно различалось во всех группах. В периферической крови преобладала субпопуляция классичеких, а в перитонеальной жидкости – промежуточных моноцитов (рис. 3).
Различия между группами одной биологической жидкости оценивались методом Краскела-Уоллиса.
При анализе содержания субпопуляций моноцитов в периферической крови женщин с эндометриозом и в группе контроля установлено снижение количества классических моноцитов (р1-к=0,04, р2-к=0,04) и увеличение промежуточных моноцитов (р1-к=0,03, р2-к=0,03) в обеих группах с эндометриозом по сравнению с группой контроля, тогда как в перитонеальной жидкости значимых изменений субпопуляционного состава моноцитов не наблюдалось.
Обсуждение
Клинико-анамнестическими особенностями обследованных женщин с эндометриозом явились: наблюдающиеся у большинства пациенток боли внизу живота, не связанные с менструацией; болезненные менструации; диспареуния; бесплодие почти у каждой второй пациентки; онкологические заболевания у близких родственников; часто встречающиеся заболевания желудочно-кишечного тракта; аллергия на лекарственные препараты.
При обследовании выявлено более высокое содержание лейкоцитов в периферической крови женщин с эндометриозом в обеих группах по сравнению с контролем при значимом увеличении доли нейтрофилов и снижении доли лимфоцитов, что может свидетельствовать о наличии воспалительного процесса при эндометриозе. Установлено значимое различие в соотношении нейтрофилов и лимфоцитов у женщин с распространенной степенью эндометриоза и в контрольной группе. В литературе присутствуют неоднозначные сведения о результатах оценки популяций лейкоцитов и о возможности использования увеличения соотношения нейтрофилов и лимфоцитов как диагностического маркера при эндометриозе. Есть данные об отсутствии изменения их содержания и соотношения при эндометриозе [24], соответствующие нашим результатам об увеличении количества нейтрофилов и соотношения их с лимфоцитами [25]. Представленные результаты, по мнению авторов, подтверждают возможность использования увеличенного соотношения нейтрофилов и лимфоцитов в качестве диагностического маркера при эндометриозе III и IV стадии, особенно в комбинации с CA-125.
Функциональную направленность клетки определяет ее фенотип [14–16]. Функциональные свойства NК-клеток (цитотоксичность, продукция цитокинов и регуляторная способность) связывают с плотностью рецепторов CD56 и CD16 на клеточной поверхности. В периферической крови не выявлено значимых различий в содержании исследуемых нами субпопуляций NК-клеток, тогда как в перитонеальной жидкости наблюдается существенное увеличение по сравнению с контролем доли цитотоксических СD3-CD56+СD16+- и продуцирующих обильное количество цитокинов CD56brightCD16dim-клеток, что дает возможность проявлять им регуляторную способность [14]. По-видимому, иммунологические факторы определяют межклеточные взаимодействия и регуляцию процессов апоптоза и пролиферации всех типов клеток в основном на локальном уровне [26]. Не было обнаружено ни на системном, ни на локальном уровне значимых изменений при эндометриозе в количестве других регуляторных субпопуляций, относящихся к врожденному иммунитету и принимающих участие в регуляции иммунных реакций. Мы не выявили ожидаемого увеличения в перитонеальной жидкости исследованных нами женщин Трег-клеток. Напротив, в перитонеальной жидкости наблюдалась явная тенденция к уменьшению доли клеток с фенотипом CD4+CD25+CD127low/- по сравнению с контролем. Более значительным было уменьшение доли Трег в периферической крови. Эти клетки представляют субпопуляцию Т-лимфоцитов, специализирующихся на иммунной регуляции. Предполагается, что Трег играют важную роль в патогенезе эндометриоза и с ними связано нарушение регуляции иммунного ответа [27–29]. Тенденция к повышению NKТ-клеток, ответственных за индукцию и поддержание хронического воспаления, может быть связана с выявленным снижением доли Трег-клеток. Уменьшение содержания Трег-клеток отражает ослабление механизмов самоограничения воспаления и отмену локального Т-клеточного иммунного ответа, которое может лежать в основе бесплодия, ассоциированного с эндометриозом.
Важное значение для роста, развития, васкуляризации и иннервации эндометриоидных поражений имеют присутствующие в них макрофаги. При определении в периферической крови и перитонеальной жидкости моноцитов – предшественников макрофагов – показано, что значимые изменения в количестве моноцитов между группами отсутствуют, но наблюдаются изменения в соотношении субпопуляций моноцитов, наиболее выраженные в периферической крови. Во всех группах женщин среди моноцитов значимо больше в периферической крови содержалось классических CD14highCD16low-моноцитов, а в перитонеальной жидкости было больше менее зрелых клеток (промежуточных CD14highCD16high и CD14lowCD16high неклассических). Изменение количества и соотношения субпопуляций моноцитов выявляется при различных заболеваниях, ассоциирующихся с воспалительным процессом или опухолевым ростом [18, 19]. Возможно, такое изменение соотношения субпопуляций связано с хроническим воспалительным процессом при эндометриозе, а снижение количества классических моноцитов можно объяснить перемещением их в ткани, где они дифференцируются в макрофаги или дендритные клетки [20] и выполняют такие функции, как клиренс апоптотических тел и стимуляция ангиогенеза [21].
Заключение
Изменение соотношения нейтрофилов и лимфоцитов в периферической крови женщин с эндометриозом, заключающееся в увеличении доли нейтрофилов и снижении доли лимфоцитов, а также соотношения субпопуляций моноцитов, выраженное в уменьшении доли классических и увеличении промежуточных моноцитов, может свидетельствовать о наличии воспалительного процесса при эндометриозе. В перитонеальной жидкости женщин с эндометриозом наблюдается существенное увеличение по сравнению с контролем доли цитотоксических СD3-CD56+CD16+- и регуляторных CD56brightCD16dim-NК-клеток, а в периферической крови выявлено уменьшение доли регуляторных клеток с фенотипом CD4+CD25+CD127low/-, являющихся субпопуляцией Т-лимфоцитов. Нарушение регуляции иммунных реакций, по-видимому, является одним из механизмов, способствующих развитию эндометриоза.



