Как известно, диагностика характера образований яичников до настоящего времени имеет
существенные трудности вообще, а у беременных в частности. Вместе с тем для выбора правильной
тактики лечения перед оперативным вмешательством необходимо с определенной долей вероятности знать характер образования [3–5, 8–10, 12, 13, 15, 17].
В 1990 г. I. Jacobs и соавт. [11] предложили «индекс злокачественности», впервые создав модель, анализирующую комбинацию клинических, ультразвуковых и биохимических маркеров. В дальнейшем были предприняты попытки создания моделей на основе логистической регрессии. Мы также проводили подобную работу у беременных [2], результативность которой составила около 65%. У небеременных точность субъективной оценки ультразвуковых данных высококвалифицированным специалистом существенно превосходила точность модели [16]. Отчасти, это было связано с недостаточным количеством ультразвуковых параметров у беременных с опухолевой патологией, а дифференциальная диагностика проводилась на разрозненных материалах. В дальнейшем была создана многоцентровая международная группа исследования опухолей яичников с обязательным
использованием единого протокола при проведении ультразвукового исследования (УЗИ). Мы продолжили набор клинических наблюдений в рамках данной проблемы.
Целью нашего исследования явилось улучшение качества дифференциальной диагностики доброкачественных, пограничных и злокачественных опухолей яичников с помощью построения логистической регрессионной модели.
Материал и методы исследования
В статистическое исследование вошли данные 223 проспективно обследованных в 12–39 нед
беременности пациенток, у которых при проведении УЗИ обнаруживали опухолевидные образования или опухоли яичников. У 14 пациенток в момент обследования гестационный возраст плода не достигал 12 нед, у 67 составлял от 12 до 24 нед, у 51 – от 24 до 36 нед и у 86 – более 37 нед. До 12 нед беременности использовали влагалищный датчик, от 12 до 24 нед – влагалищный и абдоминальный, после 24 нед – только абдоминальный. Оперативному вмешательству в I–II триместрах были подвергнуты 12 пациенток, в III – 4, кесарево сечение с удалением образования яичника было проведено 47 пациенткам, прооперированы в течение 3 мес после родов – 85, от трех мес до года – 63 пациентки. Полученные результаты сопоставлялись с морфологическими исследованиями.
На основании ультразвуковых и морфологических диагнозов все беременные были разделены
на две группы. Первую группу составили 83 беременные, у которых были констатированы опухолевидные образования, из них у 25 была киста желтого тела, у 1 – лютеома беременных, у 1 – фолликулярная киста, у 30 – параовариальная киста и у 26 – эндометриоидная киста. Вторую группу
составили 126 беременных, у которых выявили истинные опухоли яичников: 58 эпителиальных опухолей (46 серозных и 12 муцинозных цистаденом), у 6 пациенток – опухоли стромы полового тяжа (4 фибромы и 2 текомы), у 62 – тератомы.
Помимо этого, мы обследовали 13 пациенток, у 8 из которых были выявлены пограничные папиллярные серозные цистаденомы, у 2 – дисгерминомы, у 2 – незрелые тератомы и у 1 – андробластома.
Ультразвуковое исследование проводили на аппарате Сименс Х-300, модель СА 94043, США. При этом определяли размер яичниковых образований, одно- или двусторонность поражения, структуру, число камер, эхогенность, толщину стенки образования и ее наружные и внутренние контуры, толщину неизмененной ткани яичника, локализацию сосудов и показатели допплерометрии – индекс резистентности (RI) и пульсационный индекс (РI). Затем изучаемые показатели кодировали следующим образом:
Локализация: односторонняя – 1, двусторонняя – 2.
Ткань яичника: определяется – 1, не определяется – 2.
Величина неизмененной ткани яичника:
не визуализируется – 1, визуализируется менее 1 см – 2, визуализируется более 1 см – 3.
Число камер: однокамерное – 1, двукамерное – 2, многокамерное – 3.
Размер образования: 3–5 см – 1, 6–10 см – 2, более 10 см – 3.
Толщина стенки: 1–3 мм – 1, более 3 мм – 2.
Структура: кистозная – 1, кистозно-солидная – 2, солидно-кистозная – 3, солидная – 4.
Содержимое: однородное жидкостное – 1, неоднородное жидкостное со взвесью – 2, неоднородное жидкостное с перегородками – 3, неоднородное жидкостное с папиллярными разрастаниями – 4, иные структуры – 5, недифференцируемая ткань – 6, плотная ткань – 7.
Наружные контуры: четкие – 1, нечеткие – 2, бугристые – 3, ровные – 4.
Внутренние контуры: ровные – 1, неровные – 2, четкие – 3, нечеткие – 4, не определяются – 5.
Эхогенность: высокая – 1, средняя – 2, низкая – 3, анэхогенная – 4, анэхогенная с плотным компонентом – 5.
Локализация сосудов: в папиллярных разрастаниях – 1, в стенке – 2, в перегородках – 3,
в пристеночном компоненте – 4, другое – 5, не определяется – 6, в стенке и разрастаниях – 7,
в плотном компоненте – 8.
Кровоток: определяется – 1, не определяется – 2.
Характер кровотока: артериальный – 1, венозный – 2, мозаичный – 3.
Индекс резистентности (RI): высокий более 0,6 – 1, средний 0,4—0,6 – 2, низкий менее 0,4 – 3, нет – 4.
Пульсационный индекс (PI): – высокий более 1,5 – 1, средний 1–1,5 – 2, низкий менее 1 – 3. Ультразвуковые и допплерометрические данные, полученные при описании визуализируемых опухолевидных образований и опухолей малого таза, преобразовывали в коды. Для статистической обработки данных применяли прикладной пакет программ SPSS 15.0, использовали описательную статистику и корреляционный анализ по методу Спирмена. Для поиска достоверных различий между выборками использовали критерий Вилкоксона-Манна-Уитни, различия считались статистически значимыми при значении p<0,05. Кроме того, данные подвергали частотному анализу путем построения кросс-таблиц.
Прогностические модели создавали для дифференциальной диагностики 1) истинных опухолей от опухолевидных образований и 2) доброкачественных опухолей от пограничных и злокачественных.
Среди 223 пациенток истинные опухоли были у 139 (62,3%), опухолевидные образования – у 83 (37,2%), доброкачественные опухоли – у 126 (56,5%); в одном наблюдении диагноз установлен не был. Пациенток с пограничными и злокачественными опухолями было 13 (5,8%), злокачественная опухоль отсутстсвовала у 210 беременных. Для обоих прогнозируемых состояний было проведено разбиение (общепринятая терминология математиков) исходных данных на обучающую и тестовую выборки в соотношении 60%/40%. В группах сохранялось соотношение наблюдений исследуемому состоянию. Затем была произведена оценка значимости различий по всем входным параметрам. Оказалось, что ультразвуковые параметры имеют статистически значимые различия
(табл. 1).
Таблица 1. Значимость различий (р) ультразвуковых параметров по группе и типу образования
(критерий Манна-Уитни).
Для построения моделей использовали методы бинарной логистической регрессии и дискриминантного анализа. Бинарная логистическая регрессия – метод нелинейного регрессионного анализа, позволяющий прогнозировать параметры, имеющие два состояния. Этот метод активно используется для построения прогностических моделей в биологии и медицине. Для логистической регрессии вероятность попадания в исследуемую группу рассчитывается по формуле:
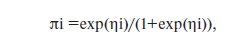
где ηi=многочлен Bi*xi I=0…n
Построение модели сводится к нахождению коэффициентов B[i](I=0…n, B[0] – регрессионная константа).
Оценка переменных происходит методом минимизации логарифмической функции подобия (Log likehood function), являющейся аналогом расстояния в линейных регрессионных моделях. Log likehood function:
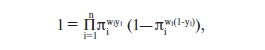
где y – наблюдаемые значения.
Для проверки точности построенных моделей использовались методы скользящего экзамена и метод
bootstrap.
Скользящий экзамен позволяет проверить качество обучающей выборки. Для проведения анализа из обучающей выборки исключалось одно наблюдение и строилась требуемая модель. Затем проверялась точность диагностики для исключенного наблюдения. Так делалось для определенного числа (или для всех) наблюдений в обучающей выборке. Затем считалось число верных срабатываний модели. Это число являлось уточняющей точности модели, построенной на всей обучающей выборке.
Метод bootstrap заключается в повторяющемся разбиении массива данных на обучающую и тестовую выборки и проверке построенных моделей. Распределение значений точности показывает случайность разбиения исходных данных на обучающую и тестовую выборки, то есть исключает возможность случайного (и неверного) увеличения точности построенных моделей. В исследовании при проверке методом bootstrap повторение разбиения проводилось 1000 раз.
Для оценки точности моделей, помимо собственно процента верных отнесений, учитывались
параметры чувствительности и специфичности. Чувствительность равна доле верно определенных случаев более тяжелого состояния среди всех наблюдений с более тяжелым состоянием. Специфичность рассчитывается аналогично для менее тяжелого состояния. Необходимость использования именно этих параметров наиболее актуальна для моделей с неравным разделением по наблюдениям, что имеется в нашем исследовании в части диагностики злокачественных новообразований.
Результаты исследования
1. Модель для диагностики пограничных и злокачественных опухолей у беременных.
С помощью пошагового метода в модель были включены четыре параметра: ткань яичника, RI, PI, расположение сосудов (табл. 2). Включенные параметры незначительно коррелируют друг с другом, за исключением пары «RI» – «Расположение сосудов». Однако при удалении любого из этой пары точность модели снижается. Это касается всех последующих моделей. Полученная модель на тестовой выборке продемонстрировала чувствительность 100% и специфичность 92,3% при суммарной точности модели 92,8%. Проверка с помощью скользящего экзамена и методом bootstrap показала устойчивость модели. Следует учитывать, что при оценке модели приоритет остается за чувствительностью, а вовсе не за точностью модели в сумме.
Таблица 2. Коэффициенты корреляции между параметрами, включеными в регрессионную модель.
Построение дискриминантной функции осуществлялось на основе тех же параметров, что и модели регрессии. Незначительная разница коэффициентов позволяет перейти от сложной
функции к модели балльной оценки. Наибольшую значимость имеет коэффициент при параметре
RI, поэтому его высокое значение приравнивается к 2 баллам, каждый из остальных параметров дает один балл. Дискриминантная функция в таком виде приобретает форму суммы баллов. Cумма баллов до 2 включительно означает низкую вероятность злокачественной опухоли, более 2 баллов – высокую вероятность (табл. 3).
Таблица 3. Дискретная модель для диагностики злокачественных и пограничных образований.
На имеющихся данных правило определяет все случаи со злокачественными образованиями и 94% случаев с отсутствием злокачественного образования.
Модель имеет преимущество перед непрерывными моделями, в частности в связи с неоднозначностью расположения кодов для расположения сосудов. Простое умножение кода, используемое в непрерывных моделях, уступает по точности определению диагностически важных параметров.
Дискретная модель обладает сравнимой точностью с непрерывной моделью, при этом имея большую практическую ценность, поскольку может применяться в клинических условиях без необходимости использования вычислительной техники.
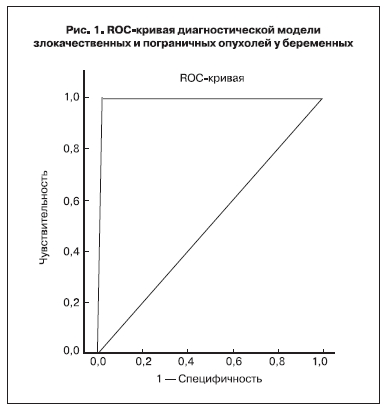
Площадь под графиком ROC-кривой для суммы баллов составляет 0,988 (рис. 1). Это очень высокий результат, характеризующий высокую эффективность модели для дифференцирования наблюдений со злокачественными образованиями.
2. Модель для диагностики доброкачественных опухолей у беременных.
Аналогично модели для диагностики злокачественных образований на первом этапе строилась
модель логистической регрессии с целью отбора параметров, имеющих максимальное прогностическое значение.
Для диагностики доброкачественных опухолей были отобраны следующие параметры: ткань яичника, структура, число камер и неизмененная ткань яичника. Корреляция между параметрами незначительная, максимальное значение не превышает 0,3 (табл. 4).
Таблица 4. Коэффициенты корреляции между параметрами, включаемыми в регрессионную модель.
Таблица 5. Дискретная модель для диагностики доброкачественных опухолей яичников.
Построенная модель на основе бинарной логистической регрессии имела чувствительность 97% и специфичность 96%. Проверка с помощью скользящего экзамена и методом bootstrap показала устойчивость модели. При скользящем экзамене неправильно диагностировано было лишь одно наблюдение из правильно определенных моделью.
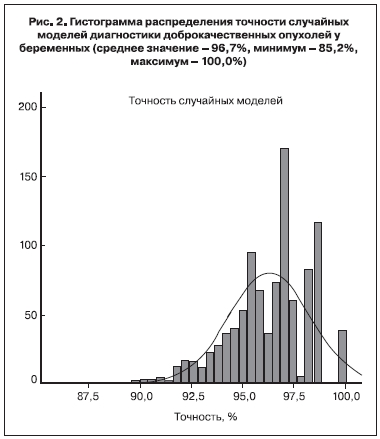
Случайные модели, построенные при проверке методом bootstrap, в среднем были точны на 96,7%
(рис. 2). В отличие от предыдущей модели, общая точность определяет качество модели.
Значения коэффициентов одного порядка, отрицательное значение коэффициента для параметра «Величина неизмененной ткани яичника» означала то, что принятая кодировка обратно пропорционально диагностическому значению параметра. В результате мы можем построить дискретную диагностическую функцию, как и в случае со злокачественными новообразованиями. По каждому параметру добавляется один балл. Истинная опухоль вероятна при любой сумме баллов выше 0 (табл. 5).
Чувствительность и специфичность модели составляют 97 и 95% соответственно (рис. 3). Это
превышает точность непрерывной дискриминантной модели.
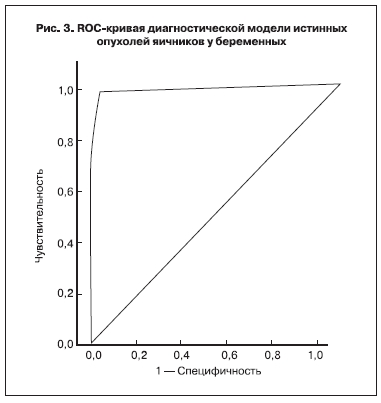
Площадь под графиком ROC-кривой для суммы баллов составляет 0,98. Это очень высокий результат, характеризующий высокую эффективность модели для диагностики опухолей.
Обсуждение результатов
Проведенные исследования показали, что предложенные нами логистические регрессионные модели для дифференциальной диагностики доброкачественных, пограничных и злокачественных опухолей чичникову беременных высоко воспроизводимы, обладают высокой чувствительностью и специфичностью. При диагностике доброкачественных опухолей яичников у беременных чувствительность и специфичность модели составляют 97 и 95% соответственно. При диагностике пограничных и злокачественных опухолей яичников у беременных чувствительность модели составляет 100%, а специфичность – 92,3% при суммарной точности 92,8%. В нашей стране при субъективной оценке ультразвуковых параметров, полученных высококвалифицированными специалистами, работающими в области онкологии, возможность выявления пограничных опухолей яичников составила более 50% [6, 7]; в других исследованиях эта патология выявлялась в 72,6% [1] и в 89% наблюдений[4]. Исследования проводились у небеременных. Зарубежные авторы считают, что у высококвалифицированных врачей при диагностике рака яичников на основании субъективных данных, чувствительность диагностики достигает 96%, специфичность 90%. У менее квалифицированных врачей эти показатели составляют 86 и 80% соответственно [14].
Таким образом, проведенные нами исследования продемонстрировали возможность с помощью
созданных нами регрессионных логистических моделей помочь практическому врачу своевременно
проводить дифференциальную диагностику опухолей яичников у беременных и тем самым использовать рациональную тактику их лечения.



