Работа поддержана грантом Президента НШ-366.2012.7.
Важным условием благополучного течения беременности является формирование толерантности к плоду, в частности путем блокирования иммунного ответа материнского организма на антигены плода отцовского происхождения. Наличие феномена иммуносупрессии, сопровождающей развитие нормальной беременности, определяется присутствием в сыворотке крови так называемых блокирующих факторов, среди которых имеются неспецифические и специфические [1–6]. Предполагается, что с недостаточным образованием в организме будущей матери блокирующих факторов может быть связано формирование различных осложнений гестации, в том числе и
самопроизвольное прерывание беременности на ранних сроках [7–9]. Особый интерес представляет изменение супрессивной активности сывороточных растворимых факторов у женщин с привычным невынашиванием под влиянием введения аллогенных лимфоцитов – иммуноцитотерапии (ИЦТ), используемой в предгестационной подготовке женщин с осложненным акушерским анамнезом [10, 11].
Основное внимание при изучении иммуносупрессии уделялось изучению антител, специфичных к аллоантигенам плода (антиотцовских антител), так как в ряде работ показано, что недостаточная аллогенная стимуляция материнской иммунной системы отцовскими антигенами вследствие совпадения у партнеров аллелей генов главного комплекса гистосовместимости HLA I и II класса может являться причиной невынашивания [12, 13]. Однако в настоящее время эта связь ставится под сомнение [14–16]. Поэтому большой интерес приобретает изучение феномена неспецифической иммуносупрессии, которая проявляется в подавлении (блокировании) митогенной активации лимфоцитов матери in vitro в присутствии аутологичной сыворотки.
До последнего времени анализ влияния сывороточных блокирующих факторов на пролиферативный ответ лимфоцитов, индуцированный митогенным стимулом, проводился по включению в синтезируемую ДНК радиоактивно меченного H3-тимидина [17, 18]. Охарактеризовать ответ на пролиферативный стимул можно также по появлению различных мембранных маркеров активации, например, по экспрессии поверхностного антигена CD69 методом проточной цитофлуориметрии [19–21]. Нами был предложен способ оценки блокирующего эффекта (БЭ) сыворотки по ее влиянию на экспрессию раннего маркера активации CD69 аутологичными лимфоцитами, стимулированными in vitro митогеном [22].
Цель настоящей работы – исследование БЭ аутологичной сыворотки на активацию лимфоцитов женщин с привычным невынашиванием в анамнезе при подготовке к беременности и в течение ее.
Материал и методы исследования
В контрольной группе было обследовано вне беременности 11 фертильных здоровых женщин
в возрасте от 25 до 38 лет, имеющих последнего ребенка не старше 2 лет.
В основной группе обследована вне беременности 31 женщина с тремя и более ранними потерями беременности в I триместре. В обследование включены женщины в возрасте от 20 до 42 лет, не имеющие в анамнезе урогенитальных инфекций, аутоиммунных, аллергических и эндокринных заболеваний, которым был поставлен диагноз привычного невынашивания беременности (ПНБ) неясного генеза.
При подготовке к беременности этим женщинам была назначена ИЦТ аллогенными клетками партнеров. Процедура ИЦТ заключалась во внутрикожном введении пациенткам в переднюю
часть предплечья 50 млн клеток лейкоцитарной взвеси партнеров на 5–9-й день менструального
цикла. Пациенток обследовали через месяц после процедуры ИЦТ. 3 женщины через 2–3 мес после двух процедур ИЦТ забеременели. При наступлении беременности ИЦТ повторяли в сроки 5, 9 и 12 нед.
17 женщин доносили беременность, у 5 произошел выкидыш на сроке 8–9 нед, у одной на сроке
9–10 нед беременность замерла. Представлены данные проспективного обследования.
Кровь у женщин для анализа брали натощак из локтевой вены в стерильные пробирки.
Мононуклеары (МНК) выделяли стандартным методом центрифугирования в градиенте плотности с использованием смеси фиколл-верографин плотностью 1,077. Сыворотку крови получали стандартным способом и для проведения анализа инактивировали нагреванием при 56ºС в течение 30 мин.
БЭ аутологичной сыворотки определяли вне беременности до и после ИЦТ, а также в 5, 8–9,
11–12, 15–17, 23–25 и 33–35 нед гестации по ингибированию экспрессии CD69 МНК периферической крови при стимуляции митогеном (фитогемагглютинином) in vitro в течение 72 ч [22]. Содержание живых МНК, экспрессирующих CD69 (CD69+), оценивали методом проточной цитофлуориметрии с использованием прямых меченных FITC-антител на цитофлуориметре FACScan (Becton-Dickinson, США). Для оценки жизнеспособности клеток использовали иодид пропидия.
Оценивали содержание СD69+ клеток после инкубации МНК в АВ- или аутологичной сыворотке и в безсывороточной среде. Рассчитывали процент ингибирования экспрессии CD69 как отношение содержания СD69+-клеток в образцах с АВ-сывороткой и аутологичной сывороткой к этому показателю в бессывороточной среде. БЭ аутологичной сыворотки определяли как разницу между процентом ингибирования экспрессии CD69 в присутствии аутологичной сыворотки и АВ-сыворотки.
Статистическую обработку данных проводили по общепринятым методам вариационной статистики. Данные представлены как среднее ± ошибка среднего. Соответствие выборок контрольной и основных групп пациенток нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием пакета Statistica 6 для Windows XP. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007. Для оценки диагностической значимости теста определения блокирующих свойств аутологичной сыворотки у женщин с невынашиванием беременности в анамнезе использовали ROC-анализ пакета MedCalc8 для Windows 7.
Результаты исследования и обсуждение
В настоящем исследовании анализировали БЭ аутологичной сыворотки пациенток с ПНБ, забеременевших после проведенной предгестационной подготовки с использованием ИЦТ.
До начала лечения БЭ сыворотки пациенток с ПНБ был сходен с БЭ сыворотки фертильных
женщин (рис. 1).
Рисунок 1. БЭ аутологичной сыворотки на митогенную активацию МНК женщин с ПНБ.
При подготовке к беременности женщинам с ПНБ были проведены два курса ИЦТ. После первой процедуры ИЦТ БЭ сыворотки снизился по сравнению со значением в контрольной группе
(р<0,05), но не с исходными значениями. После второй процедуры эти различия исчезли.
В течение I триместра беременности БЭ сыворотки пациенток, впоследствии доносивших беременность, в целом оставался сходным с контрольными и с исходными значениями, а также не
отличался от значений БЭ после второй ИЦТ, но отличался от значений после первой процедуры
ИЦТ (р<0,05).
БЭ сыворотки женщин с выкидышем в I триместре беременности существенно отличался от
значений БЭ сыворотки пациенток с доношенной беременностью (р<0,01) (рис. 1).
Рассчитана диагностическая значимость оценки БЭ сыворотки женщин с ПНБ в I триместре беременности: чувствительность теста при прогнозировании потери беременности составляла 100%,
специфичность – 46% в том случае, если БЭ был ниже 23,2%.
У 17 женщин в течение данной беременности, завершившейся рождением живого ребенка, прослежена динамика блокирующей активности сыворотки периферической крови. Во время беременности у этих пациенток наблюдались значительные изменения БЭ (рис. 2).
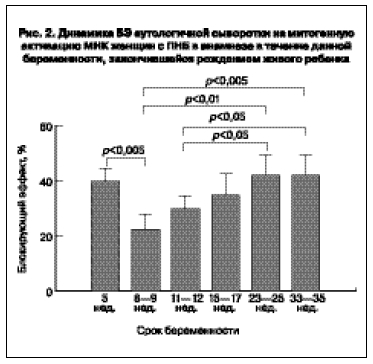
Максимальные значения БЭ наблюдались на ранних сроках беременности (5 нед) и на более поздних сроках беременности (23–25 нед и 33–35 нед). Резкое уменьшение БЭ было зарегистрировано на
сроке 8–9 нед, а при дальнейшем развитии беременности наблюдался плавный рост этого параметра.
Проспективное исследование блокирующей активности аутологичной сыворотки у женщин с ПНБ показало наличие динамики этого показателя и во время предгестационной подготовки с
использованием двух процедур ИЦТ, и в течение беременности. Установлено, что низкий уровень
блокирующей активности сыворотки на ранних сроках беременности является маркером угрозы
прерывания беременности: при условии БЭ<23,2% могут быть выявлены практически все пациенты с
угрозой выкидыша (чувствительность теста 100%). При этом с вероятностью 46% (специфичность теста 46%) в эту группу будут попадать и пациентки без такой угрозы. Однако, учитывая, что все женщины с ПНБ в анамнезе в течение I триместра обязательно получают соответствующую терапию, то те из них, у которых на фоне терапии БЭ<23%, должны рассматриваться как группа повышенного
риска. Дальнейшие исследования, как нам представляется, должны быть направлены на изучение
особенностей иммунной системы таких пациенток с ПНБ.
Полученные данные свидетельствуют о важной роли неспецифических растворимых факторов,
обусловливающих БЭ сыворотки при неосложненной беременности.
Ранее нами была показана высокая диагностическая ценность определения БЭ у женщин с ПНБ
вне беременности до назначения лечения [23]. В настоящем исследовании после проведения
предгестационной подготовки с использованием ИЦТ в группе женщин с доношенной беременностью динамика БЭ показала тенденцию к снижению его значений (рис. 1), поэтому выявленный характер динамики БЭ можно связать с «нормализацией» этого показателя после ИЦТ.
Динамика блокирующей активности сыворотки у женщин с доношенной данной беременностью также отмечена в течение I триместра. На сроке 5 нед беременности зарегистрирован максимально высокий уровень блокирующей активности сыворотки в сравнении с последующими периодами I триместра. В работе по оценке значения ИЦТ в оптимизации программы ЭКО у супружеских пар с совместимостью по
антигенам HLA-системы также было показано, что увеличение БЭ после ИЦТ является важным
для прогнозирования успеха имплантации перенесенного после ЭКО эмбриона [24].
Данные о динамике блокирующей активности сыворотки в течение I триместра у женщин с доношенной беременностью подтверждают значимость при имплантации высокого уровня иммуносупрессии. На сроке 8–9 нед происходило резкое падение БЭ до минимальных значений, зарегистрированных в I триместре. Вероятно, высокая блокирующая активность имеет значение именно для периода имплантации, а дальнейший процесс развития беременности, видимо, протекает на фоне снижения иммуносупрессии. Минимальное значение блокирующей активности сыворотки в
8–9 нед гестации может отражать необходимость иммунного контроля первой волны инвазии трофобласта в спиральные артерии матки.
Начиная с 11–12 нед беременности блокирующая активность сыворотки увеличивается, и на
сроке 23–25 и 33–35 нед она значимо выше, чем в I триместре. Такая динамика свидетельствует об изменении функционального состояния иммунной системы женщин в ходе беременности, связанном с увеличением содержания в сыворотке факторов, подавляющих функциональную активность собственных иммунокомпетентных клеток, что согласуется с представлениями о развитии неспецифической гестационной иммуносупрессии [3–6, 17]. Считается, что с развитием беременности пролиферативный ответ на аллоантигены и митогены постепенно ослабевает, и во второй половине беременности начинают преобладать неспецифические иммуносупрессивные эффекты сыворотки, связанные с присутствием в крови белков и гормонов беременности, с наличием блокирующих антител, с повышением уровня кортизола, с усилением синтеза простагландина Е макрофагами и Т-лимфоцитами и др. [4, 7, 17]. Не исключено, что увеличение блокирующей активности в
III триместре может отражать и специфическую активацию иммуносупрессивных механизмов, подавляющих избыточный иммунный ответ на усиленную аллогенную стимуляцию со стороны
развивающегося плода.
Заключение
Таким образом, нами подтверждено наличие феномена неспецифической иммуносупрессии,
сопровождающей развитие неосложненной беременности, и показана важная роль неспецифических растворимых факторов в формировании БЭ сыворотки [3–6, 17]. Полученные данные согласуются с имеющимися в научной литературе представлениями о характере изменений иммунной системы при подготовке таких женщин к беременности и во время беременности. Оценка блокирующей активности сыворотки периферической крови представляется перспективной для использования в качестве одного из лабораторных критериев эффективности предгестационной подготовки с использованием ИЦТ, а также в качестве одного из показателей угрозы выкидыша у женщин с ПНБ на сроке 8–9 нед гестации.



