Ежегодно примерно у 70 миллионов супружеских пар в мире диагностируется бесплодие [1]. Среди всех доступных в настоящее время методов лечения наиболее эффективными являются вспомогательные репродуктивные технологии (ВРТ). Тем не менее, по данным Европейского общества репродукции человека и эмбриологии (ESHRE) частота наступления клинической беременности в Европе в 2013 г. составила 29,6% в расчете на забор ооцитов и 34,5% в расчете на перенос эмбрионов [2]. С учетом репродуктивных потерь лишь около четверти циклов экстракорпорального оплодотворения завершается рождением ребенка. По всей вероятности дальнейшее повышение результативности ВРТ невозможно без глубокого изучения механизмов регуляции имплантации у человека.
Имплантация эмбриона представляет комплекс молекулярных и клеточных взаимодействий, регулируемых пара- и аутокринными факторами [3]. Наступление беременности во многом зависит от двух составляющих — функционально полноценного эмбриона и рецептивности эндометрия [4]. В настоящее время оценка качества эмбрионов в первую очередь основывается на морфологических критериях, однако точность такого метода отбора эмбрионов остается недостаточно высокой, хотя его использование и привело к значительному повышению результативности программ ЭКО [5].
В последние годы отмечается рост интереса к разработке новых неинвазивных методов анализа качества ооцитов, эмбрионов и имплантации эмбриона. В последнем процессе принимает участие множество факторов, включая интегрины эндометрия, молекулы экстрацеллюлярного матрикса, молекулы адгезии, факторы роста и ионные каналы. С целью улучшения понимания механизмов неудач имплантации разрабатывается моделирование имплантации эмбриона in vitro. Понимание точных молекулярных путей, ассоциирующихся с неудачами имплантации, позволит разработать новые прогностические и диагностические биомаркеры и в последующем идентифицировать молекулярные мишени для терапевтического воздействия [6].
Среди широкого спектра биохимических маркеров, определяемых в различных биологических материалах, в последнее время особое внимание исследователей привлекает матриксцеллюлярный белок периостин, который может являться одним из будущих биомаркеров, характеризующих процесс взаимодействия эндометрия и эмбриона при имплантации [7], и сыграть определенную роль в улучшении будущих результатов программ ЭКО. В литературе имеются данные, свидетельствующие о корреляции между уровнем периостина в сыворотке крови у женщин, проходящих лечение бесплодия в программе ЭКО/ИКСИ и качеством полученных ооцитов и бластоцист [8].
Периостин (POSTN), также известный как остеобласт-специфический фактор 2, относится к семейству белков внеклеточного матрикса и выступает в качестве лиганда интегринов (молекулы межклеточной адгезии), участвует в адгезии и миграции клеток. По данным литературы, периостин является витамин К-зависимым белком [8]. Витамин К обеспечивает карбоксилирование остатков глютаминовой кислоты, входящих в состав некоторых белков. В результате они превращаются в остатки гамма-карбоксилглютаминовой кислоты (Gla-радикалы) и приобретают способность связывать кальций. Белки, для активации которых требуется такое карбоксилирование, называются «витамин К-зависимыми» [9]. Известно, что степень активности витамин К–эпоксид редуктазы обусловлена генетически, и одной из причин дефицита активированного витамина К являются мутации гена VKORC1, кодирующего субъединицу 1 комплекса витамин К–эпоксид редуктазы и приводящие к снижению синтеза данного фермента [10,11].
Авторы из Японии продемонстрировали, что витамин K также служит лигандом для рецептора стероидов и ксенобиотиков (SXR) [12]. SXR относятся к надсемейству ядерных рецепторов. Ядерные рецепторы (ЯР) представляют собой класс внутриклеточных белков, регулирующих транскрипцию специфических генов в определённых последовательностях ДНК генома, активирующих синтез ферментов и различных белков, управляющих эмбриональным развитием, клеточной дифференцировкой, апоптозом, иммунным ответом, гомеостазом и метаболическими процессами. Как следствие, ЯР играют ключевую роль в эмбриональном развитии, в росте и дифференцировании стволовых клеток, апоптозе, гомеостазе и метаболизме экзогенных и эндогенных липофильных соединений [13].
Таким образом, целью настоящего исследования явился поиск биохимических и молекулярно-генетических предикторов наступления беременности в программе ЭКО/ИКСИ.
Материалы и методы исследования
В исследование были включены супружеские пары, обратившиеся в отделение вспомогательных технологий в лечении бесплодия ФГБУ «Национальный Медицинский Исследовательский Центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
Обследованы 100 пациенток, в соответствии с критериями включения (трубный фактор бесплодия, мужской фактор бесплодия с невыраженной патозооспермией, возраст пациентки не более 37 лет, регулярный менструальный цикл, отсутствие системных аутоиммунных заболеваний). Критериями исключения были: противопоказания для проведения ЭКО, в том числе экстрагенитальная патология, онкологические заболевания, наружный и внутренний эндометриоз III и IV стадии, миома матки больших размеров, патозооспермия III-IV степени, злокачественные новообразования любой локализации, пороки развития внутренних половых органов.

В результате лечения бесплодия методом ЭКО/ИКСИ в соответствии с результатами лечения бесплодия были сформированы две основные группы: I группа – пациентки с наступлением клинической беременности (n=28); II группа – пациентки с отрицательным результатом лечения (n=72).
Для стимуляции функции яичников был использован стандартный протокол стимуляции функции яичников с препаратами антагониста гонадотропин-рилизинг гормона и рекомбинантного ФСГ и/или человеческого менопаузального гонадотропина. Триггер овуляции был введен при наличии в яичниках фолликулов диаметром ≥ 17 мм. В качестве триггера овуляции был использован человеческий хорионический гонадотропин в дозе 10000 МЕ. Пункция яичников производилась через 36 часов после введения триггера овуляции. Оплодотворение ооцитов было проведено методом ЭКО/ИКСИ. Поддержка лютеиновой фазы цикла у всех пациенток проводилась препаратами прогестерона, начиная со дня пункции фолликулов.
Фолликулярная жидкость отбиралась из первого фолликула из каждого яичника, с промывкой иглы после каждого фолликула, в индивидуальные маркированные пробирки без гепарина. Каждая порция фолликулярной жидкости была центрифугирована в течение 20 минут. В исследование были включены те образцы фолликулярной жидкости, в которой был найден ооцит (n=87). Поскольку уровень периостина в фолликулярной жидкости, полученной из разных яичников у одной пациентки, был сопоставим, анализировали средний уровень периостина в фолликулярной жидкости, полученной из разных фолликулов. Оплодотворение ооцитов из данных фолликулов проводилось методом ЭКО или ИКСИ. Культивирование эмбрионов было проведено в отдельных каплях.
 Определение концентрации периостина (POSTN) в фолликулярной жидкости проводили иммуноферментным методом c использованием коммерческого набора «Human periostin/OSF-2 ELISA» (Кат. № SK00072-08, США) в клинико-диагностической лаборатории ФГБУ «НМИЦ АГиП им. академика В.И. Кулакова» МЗ РФ.
Определение концентрации периостина (POSTN) в фолликулярной жидкости проводили иммуноферментным методом c использованием коммерческого набора «Human periostin/OSF-2 ELISA» (Кат. № SK00072-08, США) в клинико-диагностической лаборатории ФГБУ «НМИЦ АГиП им. академика В.И. Кулакова» МЗ РФ.
Морфологическая оценка качества эмбрионов была произведена на 5-е сутки, согласно классификации, принятой Istanbul consensus workshop on embryo assessment (ESHRE, 2011) («модифицированная» классификация D. Gardner). Всем пациенткам переносили эмбрионы только хорошего качества. Количество переносимых эмбрионов не превышало двух.
Генотипирование проводили методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия. При исследовании генотипа CYP2C9 определяли наличие одного из трех наиболее распространенных в европейской популяции гаплотипов *1, *2, *3 на основании NCBI Reference Sequence M61857.1 с помощью исследования локусов 430 C>T (Arg144Cys) rs1799853 и 1075 A>C (Ile359Leu) rs1057910.
ДНК для генотипирования выделяли из образцов периферической крови взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Концентрация ДНК, определенная на ДНК-минифлуориметре (Ноеfer, США), составляла, в среднем, 50-100 мкг/мл.
Уровень витамина К в сыворотке крови определяли иммуноферментным методом с использованием коммерческого набора «Vitamin K1 (VK1) (Кат. № CEA926Ge, США) в клинико-диагностической лаборатории ФГБУ «НМИЦ АГиП им. академика В.И. Кулакова» МЗ РФ. Для исследования использовали образцы сыворотки крови, полученные у пациенток в день проведения трансвагинальной пункции.
Исследование было одобрено комитетом по этике ФГБУ «НМИЦАГиП им. В.И. Кулакова» МЗ РФ. Статистическая обработка данных выполнена с помощью пакета прикладных программ «SPSS Statistics 21.0». Соответствие анализируемых параметров закону нормального распределения оценивали по значениям тестов Колмогорова-Смирнова, Лиллиефорса и W-критерия Шапиро-Уилка. Для оценки нормально распределенных количественных данных были определены среднее значение (М), среднеквадратическое отклонение (δ) и ошибка среднего (m). Результаты представлены ввиде М±m. Для данных, распределение которых отличалось от нормального, в качестве меры центральной тенденции была выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Результаты представлены в виде Me (L-H).
Для оценки значимости межгрупповых различий применялся U-критерий Манна-Уитни для несвязанных совокупностей. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию χ2 с поправкой на правдоподобие.
Для выявления взаимосвязи количественных признаков вычисляли коэффициент корреляции Спирмена.
Статистически значимыми считались различия при р<0,05 (95-й уровень значимости) и при P<0,01 (99-й уровень значимости). Отношение шансов приведено с 95% доверительным интервалом (ДИ).
Результаты исследования
При оценке клинико-анамнестических данных, параметров фолликулогенеза, оогенеза и раннего эмбриогенеза у пациенток исследуемых групп статистически значимых отличий не было выявлено, группы были однородны и сопоставимы по анализируемым параметрам (таблица).
В результате исследования было выявлено, что уровень витамина К в сыворотке крови у пациенток, проходящих лечение бесплодия в программе ЭКО/ИКСИ, и полиморфизм гена VKORC1 не имеют значимой корреляции с наступлением беременности. Но стоит отметить, что уровень витамина К в сыворотке крови значительно ниже у пациенток, имеющих эмбрионы класса С (т.е. эмбрионы низкого или плохого качества) по классификации D. Gardner. С помощью ROC-анализа был определен критический уровень витамина К, равный 1190 пг/мл. Среди женщин с уровнем витамина К ниже порога доля пациенток, у которых были получены эмбрионы класса С, составила 57% (4 из 7), тогда как среди женщин с высоким уровнем витамина К таких пациенток было всего 16% (13 из 81). Отношение шансов составило 0,14 (95% ДИ 0.03–0.65), р=0,024.
В ходе проведенного исследования не было выявлено значимой корреляции между качеством полученных эмбрионов и полиморфизмом гена VKORC1. Не наблюдалась ассоциации уровня витамина К в крови у женщин в стимулированных циклах с полиморфизмом гена VKORC1. Также не было выявлено значимой корреляции между уровнем периостина в фолликулярной жидкости и уровнем витамина К.
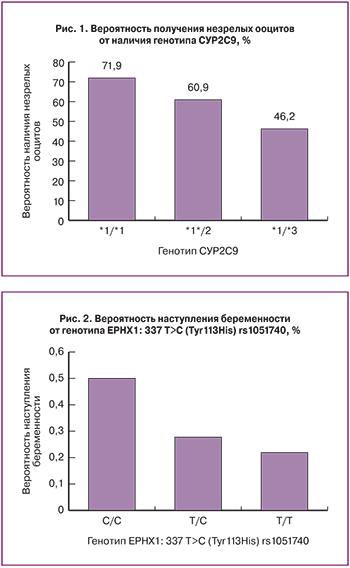
При анализе вероятности получения незрелых ооцитов у женщин, проходящих лечение в программе ЭКО/ИКСИ, была выявлена связь с генотипом CYP2C9 (рис 1.). Для носительниц «медленных» гаплоипов (*2 и *3) вероятность получения незрелых ооцитов составила 61% и 46% соответственно, тогда как для пациенток с нормальным генотипом (*1/*1) в 72% случаях получали незрелые ооциты. Выявленная зависимость имела пограничную статистическую значимость (р=0,055). При этом, статистически значимой связи генотипа CYP2C9 с уровнем витамина К и периостина в данном исследовании не наблюдалось, хотя для носителей гаплотипа *3 уровень витамина К был все-таки несколько ниже: 3540 (2495–5022) пг/мл по сравнению с другими генотипами: 4540 (2730–5747) пг/мл.
По результатам исследования также была выявлена связь вероятности наступления беременности в программе ЭКО/ИКСИ с генотипом EPHX1: 337 T>C (Tyr113His) rs1051740 (рис. 2), хотя различия не достигали уровня статистической значимости.
Обсуждение
В ходе исследования было выявлено, что уровень витамина К в сыворотке крови значительно ниже у пациенток, имеющих эмбрионы класса С (эмбрионы низкого или плохого качества) по классификации D. Gardner; при этом статистически значимых различий в частоте наступления беременности не наблюдалось. По-видимому, это может быть связано с небольшой выборкой и требует дальнейших исследований, т.к. качество ооцитов является значимым предиктором успеха программы ЭКО [4].
Поскольку витамин К служит лигандом для рецептора стероидов и ксенобиотиков, возможно, его биологические эффекты при проведении программ ВРТ опосредуются через изменение системы детоксикации. Этим может объясняться его влияние именно на качество ооцитов и эмбрионов. Полиморфизм других генов системы детоксикации ксенобиотиков в нашем исследовании продемонстрировал сходные эффекты.
Таким образом, остается открытым вопрос о влиянии генотипа CYP2C9 на процесс созревания ооцитов. Ген CYP2C9 кодирует аминокислотную последовательность фермента цитохрома P450 (семейство 2, подсемейство С, полипептид 9). CYP2C9 является одним из ферментов системы детоксикации организма от ксенобиотиков. Если у носителей «дикого типа» — CYP2C9*1, скорость метаболизма ксенобиотиков является стандартной, то при наличии вариантов CYP2C9*2 и CYP2C9*3 активность фермента может быть снижена до 90%, что приводит к снижению скорости метаболизма ксенобиотиков, что, в свою очередь, может приводить к накоплению различных ксенобиотиков. Данный механизм лежит в основе изменения эффективности ряда препаратов и приводит к необходимости снижать дозировку соответствующих лекарственных средств. Возможно, что полиморфизм гена CYP2C9 модифицирует эффективность фармакологической поддержки созревания ооцитов.
По данным литературы, роль полиморфизма генов системы детоксикации показана при развитии гестационных осложнений [14]. Также имеются данные о значимости этой системы для проведения программ ВРТ. Малышкина А.И. и др. в своей работе, посвященной полиморфизму генов детоксикации в супружеских парах, участвующих в программе ЭКО, показали роль системы детоксикации у женщин с трубно-перитонеальным бесплодием и низким качеством эмбрионов, полученных при прохождении процедуры ЭКО [15].
В ходе исследования также была выявлена зависимость вероятности наступления беременности от генотипа EPHX1. Ген микросомальной эпоксидгидролазы — фермент системы биотрансформации ксенобиотиков. Полиморфизм Т-337С ответственен за снижение активности фермента на 50% («медленный» аллель) в результате чего снижается эффективность инактивации токсических метаболитов, что ведет к развитию «оксидативного стресса», сущность которого заключается в выделении большого количества свободных радикалов, значительно превышающего физиологические потребности. Показано, что существует ассоциация полиморфизма гена EPHX с развитием хронического обструктивного заболевания легких, бронхиальной астмой, патологией женской репродуктивной сферы: эндометриозом, осложненным течением беременности (гестозы, невынашивание беременности), реализуемая через мощное повреждающее действие свободных радикалов.
Гены системы детоксикации участвуют в механизмах защиты клеток от повреждающего действия ксенобиотиков и эндогенных субстанций, в том числе продуктов перекисного окисления. Вероятно, отсутствие генетической «защищенности» организма от средового прессинга с одной стороны, и неспособность ферментативных систем клетки адекватно обезвреживать эндогенные токсические вещества в ходе их метаболических превращений, негативно сказывается на качестве ооцитов, и как следствие, на качестве эмбрионов в программе ВРТ.
Заключение
Таким образом, учитывая результаты настоящего исследования можно предположить, что уровень витамина К в сыворотке крови может являться прогностическим критерием для определения качества эмбриона в программе ЭКО/ИКСИ. Также заслуживает внимания вопрос о влиянии генов системы детоксикации на качество ооцитов, и, как следствие, качество эмбрионов и вероятность наступления беременности в программах ВРТ.



