Особенности течения беременности и исходное соматическое состояние будущей матери являются определяющими факторами качества здоровья плода. Недоношенность per se связана с повышенной заболеваемостью и смертностью, тем не менее исходы для новорожденного напрямую зависят от антенатальных событий, происходивших в течение всего периода гестации [1], поэтому оценка потенциальных факторов риска до рождения является одной из фундаментальных исследовательских задач.
Развивающийся мозг плода особенно подвержен неблагоприятным воздействиям из-за четко очерченной траектории развития на фоне происходящих транскрипционных и эпигенетических изменений [2–4]. Нарушение последовательности сетей экспрессии может в определенной степени способствовать рискам атипичного развития нервной системы [4]. Нейротрофический фактор головного мозга (BDNF) – жизненно важный нейротрофин, способствующий росту и дифференцировке нейронов в развивающейся нервной системе новорожденного [5]. BDNF участвует в синаптической пластичности, а также различных аспектах обучения, в том числе долговременной памяти [6]. Инсулиноподобный фактор роста 1 (IGF-1), или соматомедин-С, представляет собой анаболический гормон с мультипотентным действием, включающим митогенный, дифференцирующий, антиапоптотический и метаболический эффекты [7, 8]. Во внутриутробном периоде на этапах формирования головного мозга плода IGF-1 активно экспрессируется во многих его областях. IGF-1 модулирует проницаемость гематоэнцефалического барьера для других системных нейроактивных белков и увеличивает активность других факторов роста, таких как BDNF и фактор роста эндотелия сосудов [8, 9], что позволяет его рассматривать в качестве полноценного нейротрофического фактора [10].
Антенатальная профилактика респираторного дистресс-синдрома (РДС) новорожденного является обязательным компонентом акушерского менеджмента преждевременных родов (ПР) [11]; более чем у 50% пациенток, получивших курс антенатальных глюкокортикостероидов (ГКС), беременность пролонгируется на 7–10 дней [12]. Дискутабельным вопросом остается применение антибактериальных препаратов у пациенток с угрожающими ПР [13, 14], тем не менее данный вид терапии и/или профилактики продолжает активно применяться. Эпидемиологические исследования показывают, что воздействие антибиотиков может увеличить риск развития иммунных и метаболических заболеваний во взрослом возрасте, а экспериментальные исследования – что введение высоких доз антибиотиков оказывает неблагоприятные долгосрочные эффекты на развитие центральной нервной системы [15, 16]. Несмотря на очевидные и неоспоримые краткосрочные положительные эффекты терапии женщины во время беременности, долгосрочные риски остаются предметом активных споров. Результаты экспериментальных исследований доказывают, что уровни нейротрофических факторов головного мозга в плазме крови потомства могут зависеть от кортикостероидной и антибактериальной терапии матери во время беременности [17, 18].
Цель исследования: поиск антенатальных факторов, ассоциированных с уровнями нейротрофического фактора головного мозга (BDNF) и инсулиноподобного фактора роста-1 (IGF-1) плазмы крови новорожденных различного гестационного возраста.
Материалы и методы
В ходе проспективного исследования обследованы 62 пары мать–новорожденный. Женщины и новорожденные были разделены на две группы в зависимости от срока беременности на момент родов. I группу составили 21 пара мать–новорожденный со спонтанными преждевременными родами (ПР), средний срок родоразрешения был 33,3±1,93 недели, II группу – 41 пара мать–новорожденный со своевременными родами (СР), наступившими в 39,4±1,04 недели.
Всем пациенткам, включенным в исследование, проводился анализ анамнестических и клинико-лабораторных данных: соматический и акушерско-гинекологический анамнез, оценка течения беременности, стандартная панель лабораторных параметров периферической крови, оценка микробного композиционного состава отделяемого нижнего генитального тракта; методы функциональной и фетометрической оценки состояния плода. По завершении беременности были проанализированы методы родоразрешения и перинатальные исходы. У новорожденных проводилась оценка состояния по шкале Апгар после родов, течения раннего и позднего неонатального периодов, анализировались клинико-лабораторные и инструментальные данные.
Критериями включения в группы сравнения и контроля были одноплодная, спонтанно наступившая беременность; для ПР – срок гестации 280–346 недель; а также наличие добровольного информированного согласия пациентки на участие в исследовании и забор дополнительного объема крови у новорожденного для научных целей при выполнении стандартных клинических тестов. Критериями невключения для женщин являлись: многоплодная беременность, предлежание плаценты, тяжелая экстрагенитальная и акушерская патология. Критериями невключения для новорожденных были: асфиксия в родах, признаки задержки роста у плода, диагностированные антенатально, врожденные пороки развития центральной нервной системы и поражения других органов. Из исследования были исключены пациентки с симптомами острых инфекционных и/или обострениями хронических заболеваний, а также в случае отказа от участия в исследовании и тяжелого состояния новорожденного, не позволяющего получить биологический материал. Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ.
Образцы венозной крови ребенка собирались в вакутейнеры с ЭДТА в течение первых 12 ч жизни. Центрифугирование крови проводилось в течение 20 минут (300 g) при температуре 4°С с отбором плазмы и повторным центрифугированием (14 000 g) в течение 10 минут при комнатной температуре. Образцы плазмы крови хранились при -80°C для последующего анализа в лаборатории. Количественное определение уровней BDNF и IGF-1 в плазме крови проводили методом иммуноферментного анализа коммерческими наборами Research & Diagnostics Systems, Inc. (США) и Mediagnost (Германия) соответственно. Аналитическая чувствительность теста при определении BDNF составила 20 пг/мл, IGF-1 – 0,09 нг/мл. Измерение концентрации BDNF и IGF-1 производилось на спектрофотометре Infinite F50 (TECAN, США).
Статистический анализ
Статистический анализ полученных данных проводили с использованием программ GraphPad Prism 8.3 и IBM SPSS Statistics 22 с соблюдением общих рекомендаций для медицинских и биологических исследований. Описание количественных данных, имеющих нормальное распределение, представлено как среднее арифметическое и стандартное отклонение; при распределении, отличном от нормального, данные представлены в виде медианы и квартилей. Для определения нормальности распределения использовали обобщенные тесты Д'Агостино–Пирсона и Андерсона–Дарлинга, а также критерий Колмогорова–Смирнова и критерий равенства дисперсий Левена (Levene's test). В работе были применены следующие методы обработки данных: критерий Фишера, сравнительный анализ переменных с помощью параметрического t-критерия Стьюдента для несвязанных совокупностей, при отсутствии нормального распределения данных применялись методы непараметрической статистики – U-критерий Манна–Уитни. Для исследования зависимостей между параметрами применяли корреляционный анализ методом Спирмена. Статистически значимыми различиями для всех видов анализа считались различия при p<0,05.
Результаты
В исследование были включены 62 пары мать–новорожденный. Женщины были сопоставимы по возрасту, массо-ростовым показателям и индексу массы тела (ИМТ). Клинико-демографическая характеристика пациенток представлена в таблице 1.

Анализ клинико-демографических показателей, представленных в таблице 1, отражает характерные для спонтанных ПР детали анамнеза. У пациенток с досрочными родами в репродуктивной истории статистически значимо чаще отмечено привычное невынашивание (ОР 3,0; 95% ДИ 1,54–4,88) и предшествующие ранее ПР (ОР 2,94; 95% ДИ 1,51–5,06) на фоне более высокого паритета. При оценке влияния возраста супруга также отмечено статистически значимое его увеличение в группе пациенток с ПР, что согласуется с данными литературы [19]. Такие факторы, как курение, а также наличие СПКЯ, эндометриоза, миомы матки, гестационного сахарного диабета, преэклампсии и различного спектра экстрагенитальной патологии, в обеих группах значимо не различались (р>0,05).
При анализе течения беременности (табл. 2) начиная со II триместра отмечается более высокая частота эпизодов угрозы прерывания в группе ПР (12/21 (57,1%) и 5/41 (12,2%) соответственно; р=0,001; ОР 3,53; 95% ДИ 1,83–6,84) и ее терапевтическая коррекция в виде назначения токолитических препаратов (нифедипин 7/21 (33,3%) и 1/41 (2,44%) соответственно; р=0,002; гинипрал 5/21 (23,8%) и 0/41 (0%) соответственно; р=0,003). Обращает на себя внимание высокий процент применения антибактериальной терапии в группе пациенток со спонтанными ПР (ОР 3,45; 95% ДИ 1,82–6,46) в связи с наличием воспалительных маркеров, а также после наложения серкляжа. Назначение антенатальной профилактики РДСН в группе ПР при сроке беременности 240–346 недель – обязательный элемент подготовки плода к родам, однако эффект от терапии сохраняется в течении 7 дней. При детальном анализе нами обнаружено, что средний временной интервал от проведения профилактики РДСН до родов составляет 1,5 [0,4;4,3] недели.
При сравнительном анализе особенностей родоразрешения не было выявлено значимых отличий; вне зависимости от гестационного срока преобладающим методом родоразрешения в обеих группах были роды через естественные родовые пути (13/21 (61,9%) и 29/41 (70,7%) соответственно; р=0,40). Тем не менее накануне родов у беременных из группы ПР отмечался статистически значимо более высокий уровень лейкоцитов (WBC; р=0,04) в периферической крови.
Для новорожденных, кроме характерных логически обоснованных гестационным возрастом различий, таких как оценка по Апгар при рождении (7,0 [6;8] и 8 [8;8]; р<0,0001 – на 1-й минуте; 8,0 [7,5;8] и 9 [9;9]; р<0,001 – на 5-й минуте) и антропометрических данных (средняя масса тела 2130±526 и 3347±348; р<0,001), была отмечена более высокая и статистически значимая распространенность инфекций, специфичных для пери
натального периода (11/21 (52,4%) и 0/41 (0%); р<0,001). Оценка степени тяжести дыхательных нарушений по шкале Сильвермана у недоношенных новорожденных составила 2,0 [2;3]. Кроме того, для недоношенных новорожденных была характерна более высокая частота осложнений, обусловленных морфофункциональной незрелостью: РДСН (11/21 (52,4%)), транзиторное тахипноэ (6/21 (28,6%)), врожденная пневмония (9/21 (42,7%)), ретинопатия (2/21 (9,5%)), синдром угнетения ЦНС (7/21 (33,3%)).
При оценке уровней нейротрофинов BDNF и IGF-1 на первом этапе проводилось сравнение между недоношенными и доношенными новорожденными, по результатам которого были найдены статистически значимые различия (рис. 1). Уровень BDNF был выше в группе СР, в то время как IGF-1, напротив, был ниже. Медиана BDNF в группе ПР составила 476,5 [72,7;2219] пг/мл, в группе СР – 3785 [2707;6915] пг/мл, р<0,0001. Медиана IGF-1 в группе ПР составила 52,8 [38,1;85,3] нг/мл, в группе СР – 35,5 [30,4; 41,5] нг/мл, р=0,004. Графическое изображение уровней BDNF и IGF-1 в плазме крови недоношенных и доношенных новорожденных представлено на рисунке 1. Проведенный анализ зависимостей между уровнями BDNF и IGF-1 методом Спирмена не выявил статистически значимых корреляций в обеих группах.

В то же время множественный корреляционный анализ методом Спирмена в группе ПР выявил статистически значимую положительную корреляционную зависимость между уровнем IGF-1 и массой тела недоношенного новорожденного (r=0,5; р=0,04), а также гестационным возрастом (r=0,5; р=0,04). Интересной находкой оказалось наличие положительной корреляции между уровнем IGF-1 и абсолютным количеством палочкоядерных нейтрофилов в периферической крови (r=0,5; р=0,05). Значения BDNF отрицательно коррелировали с количеством койко-дней, проведенных новорожденным в палате интенсивной терапии (r=-0,5; р=0,03).
Вопрос рационального назначения антенатальной профилактики РДСН, особенно первого курса и исключительно в рамках неминуемости преждевременного родового процесса, активно обсуждается и требует значительной доработки. Учитывая многочисленные литературные данные о воздействии ГКС, используемых для пренатальной профилактики РДСН, на долгосрочные последствия у новорожденных [20, 21], нами проведен анализ уровней BDNF и IGF-1 у недоношенных новорожденных в зависимости от наличия проведенного антенатально курса профилактики РДСН. ГКС были назначены 15/21 (71,4%) беременным с угрозой ПР. Медиана BDNF в группе ПР с проведенной профилактикой РДСН составила 488,5 [70,9;2295] пг/мл, а без профилактики РДСН – 326,5 [133,4;2730] пг/мл, р=0,96. Медиана IGF-1 в группе ПР с проведенной профилактикой РДСН составила 45,3 [28,3;58,1] нг/мл, а без профилактики РДСН – 90,9 [57,7;252,3] нг/мл, р=0,02. Графическое изображение уровней BDNF и IGF-1 в плазме крови недоношенных в зависимости от проведенного курса антенатальной профилактики РДСН представлено на рисунке 2.
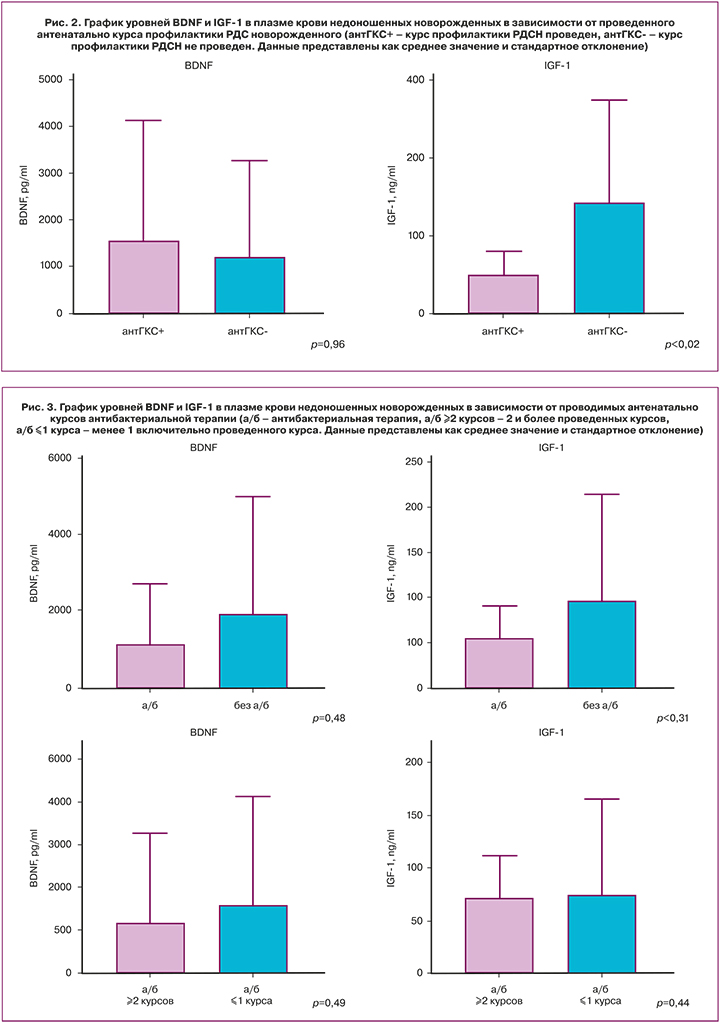
Анализ особенностей течения беременности, проведенный ранее (табл. 2), показал высокую частоту назначения в группе ПР антибактериальной терапии. Антибактериальная терапия была отмечена у 11/21 (52,4%) беременных с ПР, при этом частота назначения двух и более курсов за весь период гестации составила 5/21 (23,8%) в группе пациенток с ПР. На рисунке 3 представлены графики уровней BDNF и IGF-1 в плазме крови недоношенных новорожденных в зависимости от антенатально проводимых курсов антибактериальной терапии. Несмотря на отсутствие статистически значимых различий, на графиках отчетливо видно, что на фоне антибактериальной терапии уровень BDNF и IGF-1 ниже в сравнении с пациентами, которым данная терапия не проводилась.
Обсуждение
Современная концепция «Истоки развития здоровья и болезней» (англ. аббревиатура DOHaD), предложенная David Barker и основанная на взаимосвязи между уровнем младенческой смертности с 1921 по 1925 гг. и уровнем ишемической болезни сердца с 1968 по 1978 гг., подтвердила гипотезу внутриутробного происхождения болезней у взрослых [22]. Активное изучение перинатальных истоков формирования патологических состояний после рождения обязывает врачей акушеров-гинекологов быть максимально объективными в своем менеджменте с учетом строгих показаний и срока беременности.
Оценка антенатальных факторов риска, ассоциированных с преждевременными родами, показала характерные для данной нозологии показатели: паритет, привычный выкидыш/спонтанные ПР в анамнезе, возраст супруга, угроза прерывания данной беременности [11, 19]. Наряду с применением токолитической терапии беременным со спонтанными ПР статистически значимо чаще назначалась антибактериальная терапия (ОР 3,45; 95% ДИ 1,82–6,46) в связи с наличием воспалительных маркеров, а также после наложения серкляжа. Стоит отметить, что в нашем исследовании комбинированное применение токолитической и антибактериальной терапии, вероятно, способствовало пролонгированию беременности. Вместе с тем многочисленные литературные данные о долгосрочном воздействии антибактериальной терапии, в частности масштабное исследование ORACLE [23], оценивающие исходы для новорожденного, показали ряд неблагоприятных последствий. В нашем исследовании не было получено значимых различий между уровнями нейротрофинов у недоношенных новорожденных в зависимости от проводимой антенатально антибактериальной терапии, что, вероятно, обусловлено недостаточной мощностью исследования. Тем не менее данные, представленные на рисунке 3, показывают отчетливое снижение уровня BDNF в плазме крови недоношенных новорожденных после антенатально проведенной антибактериальной терапии. Вероятнее всего, данный факт можно объяснить как дополнительный фактор риска в формировании дисбиоза, вызванного лечением антибиотиками, которое способствует снижению экспрессии мРНК BDNF, как описано в ряде исследований [17, 24]. При оценке IGF-1 отмечена та же тенденция – его снижение на фоне проводимой антибактериальной терапии, что согласуется с результатами экспериментальных исследований, которые показывают, что нормальная кишечная микробиота индуцирует его секрецию [25].
Глюкокортикоиды являются важными регуляторами во время внутриутробной жизни, которые детерминируют многие аспекты фетального программирования. [26]. Проведение антенатального курса профилактики РДСН улучшает исходы для недоношенных новорожденных, и необходимость его применения не вызывает сомнений [11]. Однако узкое терапевтическое окно сохраняющегося эффекта от терапии (7 дней!) и данные о долгосрочных отрицательных эффектах для новорожденного [27–29] требуют проводить тщательный анализ всех факторов риска ПР, которые говорят о неминуемости их наступления, особенно при назначении первого курса. В нашем исследовании при оценке влияния проведенного курса РДСН на уровни нейротрофинов отмечено характерное, обусловленное акселерационным потенциалом ГКС увеличение BDNF, однако статистически незначимое. Статистически значимое снижение уровня IGF-1 после проведенного курса антенатальной профилактики РДСН однозначно трактовать сложно, тем не менее литературные данные не противоречат полученному результату. В ряде исследований показано, что ГКС могут снижать уровень IGF-1 у недоношенных новорожденных за счет повышения экспрессии генов, ответственных за синтез семейства белков, связывающих инсулиноподобные факторы роста I и II (IGFBP) [18, 30].
Заключение
Рациональное назначение любого вида терапии, особенно в акушерской практике, должно основываться на отношении потенциальная польза/вероятные риски. Полученные в ходе проведенного нами исследования данные о различных уровнях нейротрофинов у недоношенных новорожденных в зависимости от антенатальных особенностей подтверждают классические медицинские каноны и постулат современной перинатологии – не навреди. Назначение антибактериальной терапии должно проводиться только при наличии ряда объективных факторов, свидетельствующих об инфекционно-ассоциированной этиологии ПР в декретируемые гестационные сроки. И в этом плане верификацией инфекционно-воспалительного процесса являются результаты исследования амниотической жидкости, полученной при трансабдоминальном амниоцентезе. Профилактика РДСН улучшает перинатальные исходы, тем не менее, чтобы польза была выше нежелательных последствий, она должна проводиться только при неминуемых ПР, что обусловливает поиск маркеров ПР. Учитывая небольшой объем выборки, для подтверждения выводов, полученных по результатам данного исследования, необходимы дальнейшие исследования.



