Синдром поликистозных яичников (СПКЯ) рассматривается в качестве основной формы гиперандрогении (ГА), его доля в структуре гиперандрогенных состояний достигает 80–90% [1]. Диагностика СПКЯ основывается на критериях Европейского общества репродукции и эмбриологии человека и Американского общества репродуктивной медицины (ASRM/ESHRE, Роттердам, 2003). Для постановки диагноза необходимы 2 или 3 признака из указанных: гиперандрогения (ГА), овуляторная дисфункция (чаще олигоменорея, ОМ), поликистозная морфология яичников по данным УЗИ (ПКЯ). Принято выделять 4 репродуктивных фенотипа: 3 андрогенных — классический (ГА+ПКЯ+ОМ), ановуляторный (ГА+ОМ), овуляторный (ГА+ПКЯ) и неандрогенный (ПКЯ + ОМ), его существование признают не все эндокринологические школы. Так, по критериям Национального института здоровья США (NIH, 1990) и рекомендациям Общества по гиперандрогенным состояниям и СПКЯ (AE-PCOS Society, 2006) ГА должна являться обязательным диагностическим критерием СПКЯ. Следует отметить, что до настоящего времени нет единого мнения относительно оптимальных подходов к диагностике биохимической ГА. В большинстве клинических протоколов в качестве 1-й линии диагностики ГА при СПКЯ рекомендуется определять содержание общего тестостерона (Тобщ) в сыворотке крови [2]. В рекомендациях Общества по гиперандрогении и СПКЯ указывается на приоритетное значение определения свободного тестостерона (Тсв) и расчетного индекса свободных андрогенов (ИСА). Измерение Тобщ по мнению этой экспертной группы вносит лишь ограниченный вклад в диагностику синдрома [3]. Европейское общество эндокринологов рекомендует оценивать уровень Тобщ и ПССГ с расчетом ИСА, а не уровень Тсв, ссылаясь на отсутствие доступных для клинической практики высокоточных методов его определения. В этих же рекомендациях указывается на целесообразность определения уровня андростендиона (А4) в сыворотке крови в случаях нормальных уровней Тобщ и Тсв [4]. Андростендион, являясь предшественником тестостерона, циркулирует в крови в больших концентрациях в несвязанном с ПССГ виде, что потенциально обеспечивает более высокую точность диагностики ГА по сравнению с Тобщ [5]. Однако в международных рекомендациях 2018 года определение А4 при СПКЯ рассматривается, как условная 2-я линия диагностики, а уровень достоверности рекомендаций определен как низкий ввиду недостаточного количества исследований [6]. Таким образом, информативность уровня А4 и его место в алгоритме диагностики СПКЯ четко не определены. Вместе с тем, важно отметить, что недооценка биохимической ГА затрудняет диагностику СПКЯ и не позволяет корректно определить фенотип при неполных формах синдрома.
Точность диагностики ГА важна также с позиций ее взаимосвязи с ИР и ГИ, повышенным риском НТГ, эндотелиальной дисфункции, субклинического атеросклероза, как по сравнению со здоровыми женщинами, так и с женщинами с неандрогенным фенотипом СПКЯ [7–9]. Дискуссия об оптимальной диагностике ГА и возможности прогнозирования метаболических нарушений по андрогенному профилю пациенток продолжается. Это послужило поводом для проведения данного исследования, его цель — оптимизация диагностики биохимической ГА и оценка ее взаимосвязи с метаболической дисфункцией при СПКЯ.
Материалы и методы
Исследование проведено на базе отделения гинекологической эндокринологии ФГБУ «НМИЦ акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России. В исследование включены 437 женщин с СПКЯ, установленным в соответствии с Роттердамскими критериями. С целью проведения ROC-анализа и определения диагностической значимости Тобщ, Тсв и А4 были обследованы 160 соматически здоровых женщин с нормальной морфологией яичников по данным УЗИ, отсутствием признаков гирсутизма и нарушений репродуктивной функции. Обе группы были сопоставимы во возрасту (ср. возраст – 25,5 (4,6) года и ср. возраст 25,2 (3,8) лет соответственно, p=0,68) и ИМТ (ср ИМТ 25,2 (6,8) кг/м2 и ИМТ – 24,2 (5,6) кг/м2 соответственно, p=0,73).
Оценка гормонального профиля включала определение уровней ЛГ, ФСГ, Тобщ и Тсв, А, ПССГ, пролактина, ТТГ в сыворотке крови. Исследования проводились на 2–3 день менструального цикла иммунохемилюминесцентным методом (анализатор Immulite 2000, Siemens, USA). Уровень АМГ в сыворотке крови определяли методом ELISA (тест-система AMH GenII ELISA, Beckman Coulter, USA). На 5–7 день менструального цикла проводили ультразвуковое исследование органов малого таза трансвагинальным датчиком, частотой 7,5 Мгцс определением объема яичников (аппарат Toshiba SSA-240, Япония). Контроль овуляции осуществлялся с помощью определения уровня прогестерона и/или УЗИ на 20–24 д.м.ц. в 3-х менструальных циклах.
В рамках исследования проводили 2-х часовой глюкозотолерантный тест (ГТТ) с 75 г глюкозы, уровни глюкозы и иммунореактивного инсулина определяли натощак, через 1 и 2 ч после нагрузки. Оценка липидного спектра крови включала измерение уровней ХС, ЛПВП, ТГ (анализатор «Airon 200», диагностические наборы «Biocon»), расчет КА по формуле А.Н.Климова, ЛПНП – по формуле Фридвалда.
Статистический анализ осуществлялся с помощью программы SPSS (IBM Statistical Package for the Social Sciences, 21 версия). С помощью теста Колмогорова-Смирнова установлено нормальное распределение данных. Количественные показатели представлены как среднее арифметическое и стандартное отклонение (М(SD)), сравнение производилось с помощью t-критерия Стьюдента. Для сравнения нескольких подгрупп применялся дисперсионный анализ ANOVA. Сравнение качественных характеристик производилось с помощью критерия χ2 Пирсона. Для оценки взаимосвязи количественных показателей применялся критерий корреляции Пирсона. При интерпретации результатов статистического анализа за критическую принята величина уровня значимости (p) равная 0,05.
 Результаты
Результаты
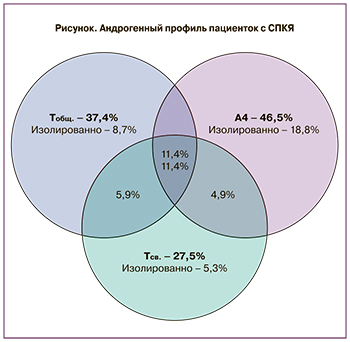
Оценка андрогенного профиля показала, что определение уровня Тобщ дает возможность диагностировать ГА у 37,4% (n=164) больных, определение Тсв — у 27,5% (n=120), тогда как определение А4 — у 46,5% (n=203) (рисунок). Исходя их полученных данных дополнительное определение уровня Тсв увеличивает частоту выявления ГА, традиционно диагностируемой по уровню Тобщ, с 37,4 до 47,6%. Определение уровня А4 при нормальных показателях Тобщ и Тсв дает возможность диагностировать биохимическую ГА еще у 18,8% больных. В целом комплексная оценка андрогенного статуса повышает частоту выявления биохимической ГА с 37,4 до 66,4%. Наряду с увеличением уровня андрогенов у 57,9% больных выявлено снижение уровня ПССГ (менее 50 нмоль/л), ассоциированное с увеличением биологической доступности андрогенов.
Для уточнения вклада различных андрогенов в диагностику биохимической ГА был проведен ROC-анализ, в него были включены пациентки с андрогенными фенотипами СПКЯ (n=296) и пациентки без нарушения репродуктивной функции и признаков СПКЯ (n=160). Наибольшая площадь под кривой установлена для А4 – 0,946 (95% ДИ: 0,927–0,965), для Тобщ ее значение составило – 0,837 (95% ДИ: 0,794–0,880), для Тсв – 0,766 (95% ДИ: 0,719–0,812). Чувствительность и специфичность каждой из моделей определены в соответствии с установленными референсными значениями для использованных стандартизированных тест-систем. Для Тобщ при пороговом уровне 1,97 нмоль/л чувствительность составила 79,2%, специфичность – 85,0%, для Тсв при пороговом уровне 4,1 нг/мл – 68,0 и 88,1%, для А4 при пороговом уровне 19,0 нмоль/л – 79,2 и 98,1% соответственно.
Анализ клинико-лабораторных данных показал отсутствие корреляции Тобщ, А4, Тсв с возрастом пациенток с СПКЯ и с ИМТ (p>0,05). Наряду с этим выявлена взаимосвязь ИМТ с ПССГ и ИСА (r=-0,525, p<0,001 и r=0,444 p<0,001 соответственно), а также слабая корреляция ИМТ с Тсв (r=0,124, p=0,03). Установлено наличие прямой корреляционной зависимости уровня Тобщ и А4 с ЛГ и АМГ (r=0,407 и r=0,538 для Тобщ и r=0,539и r=0,612 для А соответственно, p<0,001).
В рамках данного исследования была проанализирована также взаимосвязь ГА с метаболической дисфункцией. НТГ натощак или на фоне ГТТ было выявлено у 17,8% (n=78), ИР – у 32,5% (n=142), ГИ – у 25,2% (n=110), ДЛП – у 37,5% (n=164). Как видно из данных, представленных в таблице, наиболее часто ДЛП проявлялась в виде изолированной гиперхолестеринемии (22,2%). Комбинированная ДЛП диагностирована у 10,3%, крайне редко выявлялась гипертриглициридемия (менее 3% случаев). Корреляционный анализ не выявил статистически значимой взаимосвязи Тобщ, Тсв с уровнем глюкозы, инсулина и показателями липидограммы (p>0,05). Для А4 установлены корреляции с уровнем инсулина натощак (r=0,178, p=0,03), через 1 час поле нагрузки (r=0,169, p=0,01) и индексом НОМА (r=0,182, p=0,02), а также уровнем ХС (r=0,129, p=0,02). Отрицательная корреляция установлена между уровнем ПССГ и уровнем тощаковой глюкозы (r=-0,182, p=0,001), уровнем инсулина натощак (r=-0,400, p=0,001), через 1 час (r=-0,322, p=0,001) и 2 часа (r=-0,281, p=0,001) на фоне ГТТ. Индекс НОМА коррелировал с уровнем ПССГ (r=-0,416, p=0,001) и ИСА (r=0,315, p=0,001). Выявлена взаимосвязь ПССГ с уровнем ТГ (r=-0,271, p=0,01), ЛПВП (r=0,370, p=0,001), ЛПНП (r=-0,201, p=0,05) и значением КА (r=-0,284, p=0,01).
В соответствии с приведенными данными, можно высказать предположение, что уровень ПССГ и значение ИСА являются наиболее значимыми маркерами метаболической дисфункции при СПКЯ. Однако при более детальном рассмотрении оказалось, что 64,5% пациенток с повышенными значениями ИСА имели нарушение жирового обмена (22,6% избыточную массу тела, 41,9% – ожирение I–II степени). При сниженном уровне ПССГ избыточная масса тела диагностирована у 33,2% пациенток, ожирение – у 49,7%. Приведенные данные, а также корреляция ПССГ и ИСА с ИМТ при СПКЯ указывают на то, что данные маркеры теряют свою информативность для пациенток с нормальным ИМТ.
Для оценки вклада А4 и Тобщ в развитие метаболической дисфункции при СПКЯ был проведен сравнительный анализ клинико-лабораторных показателей 246 пациенток с СПКЯ, разделенных на следующие группы: с высоким уровнем Тобщ и А4 (ВT/ВA) – 28,8% (n=126), с высоким уровнем Тобщ при нормальном А4 (ВT/НA) – 8,7% (n=38), с высоким уровнем А4 при нормальном Тобщ (НТ/ВA) – 17,6% (n=77), а также группа НТ/НА, с нормальными уровнями Тобщ и А4 – 32,3% (n=141).
Как видно из данных, приведенных в таблице 1, группы не различались по возрасту (p=0,72), ИМТ (p=0,25), частоте избыточной массы тела (p=0,41) и ожирения (р=0,47). Анализ гормонального профиля показал, что более высокие средние уровни АМГ и ЛГ характерны для группы ВТ/ВА, а наиболее низкие – для группы НТ/НА (p=0,001). Средние уровни Тобщ, А4 и Тсв в группе ВТ/ВА превышали аналогичные показатели в других андрогенных группах (p=0,001). Средний уровень ПССГ в группе ВТ/ВА (49,1 (37,4) нмоль/л) был ниже, чем в группе НТ/НА (57,1 (29,6) нмоль/л, p=0,001). Различий по уровню ПССГ среди других андрогенных групп не выявлено (p=0,19). Данные, представленные в таблице, свидетельствуют также о более высоких уровнях глюкозы и инсулина натощак в группе ВТ/ВА, чем в группе НТ/НА (р=0,03 и р=0,01 соответственно). Между другими группами с ГА статистически значимых различий не выявлено (р=0,65).
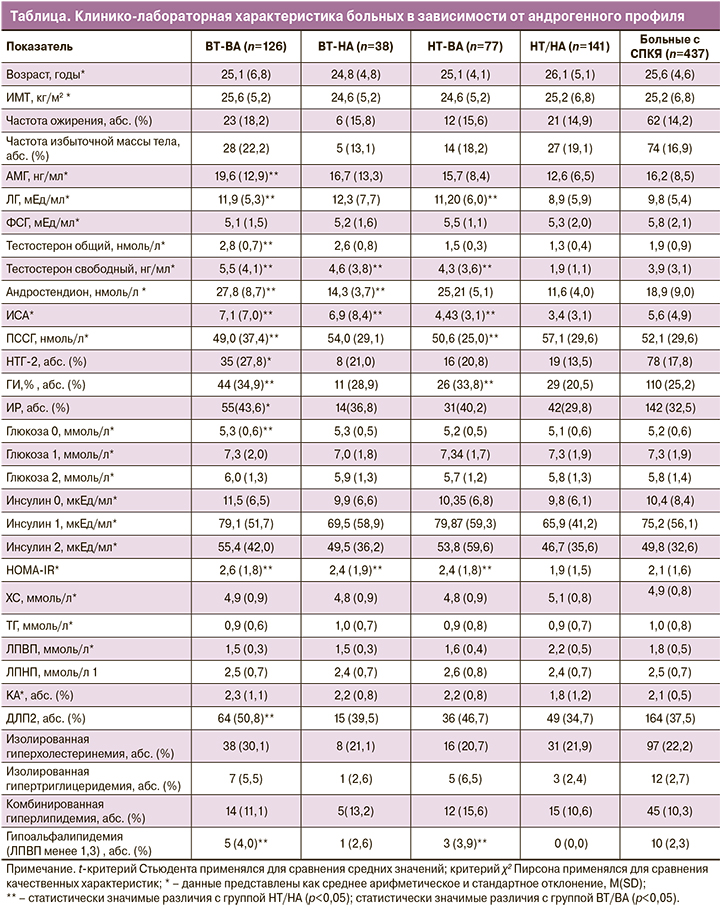
Частота НТГ (натощак и на фоне ГТТ) в группе ВТ/ВА (27,8%) статистически значимо превышала таковую в группе НТ/НА (13,5%, p=0,01), но существенно не отличалась от показателей в группах НТ/ВА и ВТ/НА (р=0,49). В группах ВТ/ВА и НТ/ВА частота ГИ была сопоставима (34,9% и 33,8% соответственно) и значительно превышала таковую в группе НТ/НА (р=0,001 и р=0,01 соответственно). Средний показатель индекса НОМА-ИР во всех группах с ГА статистически значимо не различался (р=0,52), но превышал показатель в группе НТ/НА (для группы ВТ/ВА, р=0,001, ВТ/НА и НТ/ВА, р=0,01).
Не выявлено различий между группами по уровню ХС, ЛПНП и ТГ (p>0,05). Уровень антиатерогенных ЛПВП в группе НТ/НА превышал показатели во всех андрогенных группах (p=0,03). КА был максимальным в группе ВТ/ВА, а наиболее низким в группе НТ/НА (p=0,01). В группе ВТ/ВА ДЛП встречалась у каждой второй пациентки, в группе НТ/НА – у каждой третьей (p=0,02).
На основе полученных результатов можно сделать заключение о целесообразности проведения комплексной оценки андрогенного профиля, включающей не только определение уровня Тобщ и Тсв, но и А4, который является более значимым в диагностике СПКЯ. Больные с ГА имеют достаточно высокую частоту метаболических нарушений, особенно при сочетании повышенных уровней Тобщ и А4. При избыточной массе тела и ожирении в качестве предиктора ГИ и ИР метаболической дисфункции можно рассматривать снижение уровня ПССГ.
Обсуждение
Многообразие клинических проявлений СПКЯ, наряду с недостаточной информативностью методов определения андрогенов, создает трудности в диагностике синдрома, которая помимо оценки овуляторной дисфункции и поликистозной морфологии яичников основывается на определении андрогенного статуса пациенток. Диагностика ГА при СПКЯ включает оценку уровней Тобщ, ПССГ с расчетом ИСА или определение уровня Тсв. Однако измерение Тсв в сыворотке крови методом ИФА считается недостаточно точным и информативным, а определение Тобщ затруднено в связи с физиологически более низкими его концентрациями в сыворотке крови женщин по сравнению с мужчинами. При использовании некоторых коммерческих наборов уровень Тобщ в образце может оказаться даже ниже диапазона определения. В литературе представлены немногочисленные исследования о преимуществах определения А4 по сравнению с Тобщ при СПКЯ [4]. Однако клиницисты, как правило, не проводят оценку уровня А4 ввиду неоднозначности информации о целесообразности такого подхода.
Для оптимизации диагностики ГА нами было проведено исследование по изучению андрогенного статуса больных с СПКЯ и его ассоциации с метаболической дисфункцией. Оказалось, что традиционное измерение уровня Тобщ позволяет выявить ГА лишь у каждой 3-й пациентки, дополнительное определение Тсв – у каждой 4-й пациентки с СПКЯ. Так совместное их определение повышает частоту выявления ГА до 47,6%. Повышение уровня А4 было диагностировано почти у каждой 2-й (46,5%) пациентки с СПКЯ. В том числе изолированное повышение уровня А4 выявлено у 18,8% пациенток, тогда как изолированное повышение уровня Тобщ и Тсв наблюдалось только у 8,7% и 5,2% больных соответственно. Согласно результатам некоторых исследований ГА по уровню Тобщ выявляется чаще, чем по уровню А4 [10]. В настоящем исследовании около трети пациенток имели сочетанное повышение Тобщ и А4 (группа ВТ/ВА), каждая 5-я пациентка имела повышенный уровень А4 при нормальном Тобщ (группа НТ/ВА) и только каждая 10-я – повышенный уровень Тобщ при нормальном уровне А4 (группа ВТ/НА). Исходя их этого можно сделать заключение, что определение уровня А4 вносит существенный вклад в диагностику СПКЯ, позволяя выявить ГА дополнительно у каждой 5-й больной с нормоандрогенным фенотипом установленным по уровню Тобщ и Тсв. По данным ряда авторов измерение уровня А4 позволило выявить ГА у 30–60% больных с СПКЯ, в том числе примерно у 10% больных с фенотипом Д, диагностированным по уровню Тобщ [11]. В ряде других исследований также обсуждается большая информативность определения А4 в сравнении с Тобщ в диагностике ГА, но при использовании метода жидкостной хроматографии и тандемной масс-спектрометрии. Настоящее исследование показало преимущества комплексной оценки андрогенного статуса, позволяющей повысить частоту выявления ГА с 37,4% (по уровню Тобщ) диагностированных при измерении только уровня Тобщ, до 66,4%. Данный подход представляется наиболее целесообразно использовать при обследовании женщин с овуляторной дисфункцией и поликистозной морфологией яичников по УЗИ при отсутствии клинических признаков ГА.
СПКЯ рассматривают также как метаболический репродуктивный синдром, ассоциированный с ИР, НТГ, повышенным риском сердечно-сосудистых заболеваний и гестационных осложнений [13, 14]. Известно, что частота и выраженность метаболических нарушений коррелируют с избыточной массой тела и ожирением. Однако нарушения углеводного обмена характерны для 30–40% пациенток с СПКЯ даже при нормальном показателе ИМТ. Частота ИР у данной категории больных выше в 5,7 раз, а НТГ в 3,4 раза по сравнению со здоровыми сверстницами, сопоставимыми по возрасту и ИМТ [13]. Повышение частоты НТГ, ИР и компенсаторной ГИ у женщин с СПКЯ без ожирения в значительной степени связывают с избыточным уровнем андрогенов. В исследованиях на животных было показано, что избыток андрогенов может привести к формированию ИР путем избыточного фосфорилирования серина субстрата рецепторов инсулина (IRS), снижения его тирозинкиназной активности и нарушению сигнального пути инсулина [15, 16]. В большинстве клинических исследований взаимосвязь ГА и ИР была прослежена, в некоторых других – не установлена. Это не позволяет прогнозировать развитие сердечно-сосудистых заболеваний и гестационных осложнений синдрома. Несмотря на имеющуюся патофизиологическую основу ассоциации ГА и ИР, нет единого мнения относительно возможности предикции метаболических нарушений по андрогенному профилю пациентки. В настоящем исследовании была была установлена взаимосвязь ИР, ГИ и НТГ со снижением уровня ПССГ, прослеженная преимущественно у пациенток с нарушением жирового обмена. В связи с этим уровень ПССГ логично рассматривать как маркер ИР и ГИ у пациенток с избыточной массой тела или ожирением. Корреляционный анализ не показал статистически значимой взаимосвязи уровня Тобщ и Тсв в сыворотке крови с уровнем глюкозы, инсулина, индексом НОМА, частотой НТГ, ИР, ГИ, ДЛП. Возможно, это связано с относительно низкой частотой ожирения и избыточной массы тела и/или молодым возрастом обследованных больных, то есть с теми параметрами, которые вносят существенный вклад в развитие метаболического синдрома. Вместе с тем установлено, что уровень А4 коррелировал с уровнем инсулина (натощак и через 1 ч на фоне проведения ГТТ) и индексом НОМА. В литературе представлены данные об ассоциации изолированного повышения уровня А4 и его комбинации с повышенным уровнем Тобщ с индексом чувствительности к инсулину ISI [17]. Более детальный анализ показал, что пациентки из группы ВТ/ВА характеризовались более высоким уровнем тощаковой глюкозы и инсулина, более высокой частой ИР и ГИ по сравнению с группой НТ/НА. Результаты проведенного исследования свидетельствуют о наибольших метаболических рисках у женщин с комбинированной ГА по уровню Тобщ и А4. Так частота НТГ в данной группе превышала в 2 раза, а частота ИР и ДЛП в 1,5 раза аналогичные показатели пациенток с нормандрогенией. Частота нарушений углеводного и липидного обмена в группах НТ/ВА и ВТ/НА была выше, чем в группе НТ/НА, однако различия не достигли статистической значимости. Сходные данные были получены в исследовании O’Reilly, согласно результатам которого наличие ГА по А4 или его комбинации с повышенным уровнем Тобщ увеличивало вероятность развития ИР и НТГ. Интересно, что данная взаимосвязь была установлена авторами не только в группе с ГА, но и в группе с нормальными уровнями андрогенов по сравнению с группой здоровых женщин [17]. В проведенном нами исследовании частота НТГ в группе НТ/НА составила 13,5%, что превышает показатель для российской популяции (8,3%) в ходе многоцентрового эпидемиологического исследования (2007 г.) [18]. Данные наблюдения указывают на скрытое метаболическое неблагополучие даже у пациенток с неандрогенным фенотипом синдрома.
Заключение
На основании полученных в исследовании данных, можно сделать заключение, что при подозрении на СПКЯ выявление биохимической ГА должно основываться на комплексной оценке андрогенного профиля, позволяющей повысить точность почти в два раза по сравнению с традиционным определением уровня Тобщ. Наибольший вклад в диагностику ГА вносит определение уровня А4, повышение которого характерно для каждой 2-й больной с СПКЯ. Сочетанную ГА по уровню Тобщ и А4 можно рассматривать как предиктор развития метаболической дисфункции у пациенток с СПКЯ.



