По данным Всемирной организации здравоохранения, острые респираторные вирусные инфекции (ОРВИ) являются самой распространенной патологией и составляют до 90% всех случаев инфекционных заболеваний [1–4]. Ежегодно в России ОРВИ переносят порядка 50 млн человек. За возникновение заболеваний ответственны вирусы гриппа типов А, B и С, вирус парагриппа, респираторно-синцитиальные вирусы, аденовирусы, риновирусы и др. [3, 4]. Встречаются также микст-инфекции гриппа А и В, а также гриппа и респираторно-синцитиальной инфекции, гриппа и аденовирусных заболеваний и микст-инфекции, вызванные различными возбудителями.
Риск заболевания и смертности для беременных при гриппе выше, чем для небеременных женщин, что первую очередь связано с развитием осложнений, а именно пневмоний, регистрируемых в период эпидемий [2–5]. При этом следует отметить лидирующее место ОРВИ в структуре экстрагенитальной патологии при беременности (более 2/3 от общей заболеваемости острыми инфекциями). Это обусловлено высокой восприимчивостью беременных к вирусным инфекциям, склонностью к хронизации патологических процессов. Для беременных характерно затяжное течение ОРВИ при отсутствии тяжелых клинических проявлений; это связано с повышенной способностью вирусов респираторной группы к репликации в плаценте, а также с особенностями иммунной системы беременной женщины.
Основной проблемой является решение вопроса о необходимости назначения противовирусной терапии при беременности, поскольку традиционно в лечении ОРВИ широко используют симптоматические средства, а этиотропные препараты рекомендуются только для тяжелых форм ОРВИ и в случаях, когда эпидемиологические данные дают основание подозревать наличие вируса гриппа. Наиболее часто используемые средства этиотропной терапии гриппа: ремантадин, осельтамивир (тамифлю), занамивир (реленза), арбидол, ингавирин, рекомбинантные интерфероны относятся к категории С по классификации FDA (Food and Drug Administration – Управление по контролю качества продуктов и лекарственных средств, США) и должны назначаться только в случае, если потенциальная польза от их применения превышает риск.
Хорошо известно, что наиболее эффективна противовирусная терапия, начатая в первые 24–48 часов с момента дебюта заболевания. Своевременное лечение позволяет существенно сократить продолжительность лихорадки и других клинических симптомов заболевания [6]. В то же время особенностью течения ОРВИ при беременности является наличие стертых клинических форм заболевания. Именно поэтому необходимость точной и своевременной диагностики гриппа не вызывает сомнений.
Другой наиболее уязвимой категорией пациентов в плане развития тяжелых форм ОРВИ являются дети первых лет жизни, прежде всего рожденные раньше положенного срока. Это обусловлено целым рядом факторов: во-первых, особенностями иммунного статуса глубоко недоношенных детей; во-вторых, высокой частотой встречаемости среди данной когорты пациентов детей с такими проблемами, как бронхолегочная дисплазия. Особенностью морфофункционального состояния их респираторного тракта является склонность к развитию бронхоспастического синдрома и гиперпродукции слизи, в связи с чем особенно опасной для таких пациентов является респираторно-синцитиальная вирусная инфекция [7, 8]. В-третьих, наблюдение за данной группой детей в постнеонатальном периоде предполагает более частое, чем у доношенных детей, посещение различных медицинских учреждений, а соответственно, повышенный риск контактов с больными ОРВИ.
Практически каждый ребенок переносит респираторно-синцитиальную вирусную инфекцию на протяжении первых двух лет жизни. Большинство заболевших на первом году жизни переносят заболевание в виде обструктивного бронхита, бронхиолита или даже пневмонии [9]. Группу высокого риска тяжелого течения данной инфекции составляют недоношенные дети, дети с бронхолегочной дисплазией и различными врожденными пороками сердца. Именно у них наиболее высок риск развития тяжелого респираторно-синцитиального вирусного бронхиолита, требующего госпитализации пациента в отделение реанимации и проведения комплексной респираторной, медикаментозной, инфузионной и ингаляционной терапии. По данным крупных исследований наиболее грозным заболеванием, обусловливающим максимальную смертность у недоношенных детей в постнеонатальном периоде, на сегодняшний день является респираторно-синцитиальная вирусная инфекция. Для сравнения, летальность при ней превышает таковую от гриппа у детей в возрасте до 1 года в 8,8 раза [10]. Учитывая отсутствие широких возможностей для лечения респираторно-синцитиальной вирусной инфекции, в настоящее время на первый план выходит ее диагностика и профилактика.
Клиническая диагностика ОРВИ очень трудна, и на практике обычно ставится нозосиндромальный диагноз. Лабораторная диагностика является решающей при постановке этиологического диагноза. Несмотря на высокую информативность, большинство методов идентификации вирусов не удовлетворяет клиницистов, так как результаты исследований можно получить спустя длительное время после взятия материала. Для лабораторного подтверждения диагноза используют экспресс-метод – реакцию иммунофлюоресценции, позволяющий определить антигены респираторных вирусов в цилиндрическом эпителии носовых ходов (в «отпечатках» со слизистой оболочки полости носа). Результативность метода существенно зависит от соблюдения методических условий получения клинических материалов, сроков и температурных условий их доставки в лабораторию, качества используемых реагентов, а также компетентности специалистов, ответственных за интерпретацию результатов [11]. В то же время в рутинной диагностике все большее распространение получают молекулярно-генетические методы выявления микроорганизмов и, в частности, полимеразная цепная реакция (ПЦР). Данные методы имеют максимально доступную на сегодня чувствительность и специфичность, однако практический опыт и нормативная база, касающиеся применения ПЦР для диагностики ОРВИ, крайне ограничены.
Таким образом, целью исследования было определение возможностей метода ПЦР в режиме реального времени в диагностике ОРВИ, в том числе респираторно-синцитиальной вирусной инфекции и гриппа, у беременных женщин и новорожденных детей.
Материал и методы исследования
Исследование проводилось в ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова в период с сентября 2012 по май 2013 г. В исследование включены 174 взрослые пациентки, находящиеся в стационаре, доставленные по каналу экстренной медицинской помощи и обратившиеся в поликлиническое отделение центра (среди них 113 беременных и 61 пациентка гинекологического профиля), с направительным диагнозом ОРВИ либо грипп, и 52 ребенка, в том числе недоношенные, родившиеся ранее 35-й недели гестации, наблюдавшиеся в 1-м и 2-м детских физиологических отделениях центра (1 Д/О и 2 Д/О), проходившие лечение в отделении реанимации и интенсивной терапии новорожденных (ОРИТН), отделении хирургии, реанимации и интенсивной терапии новорожденных (ОХРИТН), отделении патологии новорожденных и недоношенных детей (ОПН и НД), научно-консультативном педиатрическом отделении (НКПО).
Средний возраст женщин составил 31,5±1,6 года (от 16 до 57 лет). Критериями включения в исследование были: наличие симптомов гриппа и ОРВИ (повышение температуры тела, симптомы интоксикации и катарального воспаления дыхательных путей). Обследование проводилось методом ПЦР в режиме реального времени в первые двое суток от момента появления симптомов или поступления больного в стационар. Критериями исключения из исследования были: наличие хронической обструктивной болезни легких. Всем пациентам, включенным в исследование, проводилось стандартное общеклиническое обследование: сбор анамнеза заболевания, объективный осмотр, анализ клинической картины в сопоставлении с данными лабораторно-инструментальных методов исследования (общие анализы крови и мочи, рентгенологическое исследование органов грудной полости). При наличии у пациента признаков пневмонии по данным рентгенологического исследования органов грудной полости дополнительно назначался биохимический анализ крови (определение уровней аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), мочевины, креатинина, креатининфосфокиназы), а также анализ электролитного состава и кислотно-основного состояния крови.
В ходе обследования педиатрических пациентов были выполнены 67 исследований биоматериала, полученного из носа и зева, а также буккального соскоба и аспирата из трахеи. Поводом для проведения обследования стало клиническое ухудшение состояния детей, появление катаральных симптомов, симптомов интоксикации, а в ряде случаев – повышения температуры тела и дыхательных нарушений различной степени выраженности. Всем пациентам было проведено клинико-лабораторное и инструментальное обследование в соответствии с диагностическими протоколами, включавшее в себя клинический анализ крови, общий анализ мочи, определение уровня С-реактивного белка, ПЦР-диагностику, в ряде случаев – определение прокальцитонина и рентгенологическое исследование органов грудной полости.
Молекулярно-генетическое исследование во всех случаях осуществлялось методом ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации с использованием коммерческих тест-систем производства «ДНК-Технология» (Россия). Для выявления генетического материала РНК-содержащих вирусов предварительно проводили реакцию обратной транскрипции. Биоматериал для исследования получали методом соскоба эпителиальных клеток из соответствующих локусов одноразовыми стерильными зондами. Аспират из трахеи получали в объеме 500 мкл и центрифугировали в течение 10 мин при 16000 G. Осадок ресуспендировали в 100 мкл. Контроль адекватности взятия материала проводили по количеству ДНК человека. Реакцию амплификации проводили на детектируюшем амплификаторе ДТ-96 «ДНК-Технология» (Россия).
Результаты исследования
Все женщины были обследованы по клиническим показаниям, среди которых основное значение имела степень выраженности катарального и интоксикационного синдромов. Клиника ОРВИ у беременных в 85,3% случаев характеризовалась средним и среднетяжелым течением. В 52% случаев больные были обследованы на 1–2-й день, в 31,6% случаев – на 3–5-й день, в 16,4% – на 6-й и более дни болезни, когда уже наблюдались осложнения и обострения других хронических заболеваний.
В большинстве случаев заболевание начиналось остро с повышения температуры тела, которое было зарегистрировано у всех пациенток, при этом в 30,1% случаев температура тела повышалась до 38°С и выше. Длительность лихорадки составляла от 1–2 до 3–4 дней. При этом температурная реакция была наиболее выраженной в I и II триместрах гестации. Симптомы интоксикации проявлялись также в виде слабости, недомогания, отмеченных у всех больных, выраженной головной боли в 34,1% случаев. Катаральный синдром проявлялся в виде сухого кашля на 1–2-й день заболевания у 34,1 % женщин, першение, боли в горле при глотании наблюдались у 64,6% беременных независимо от периода гестации.
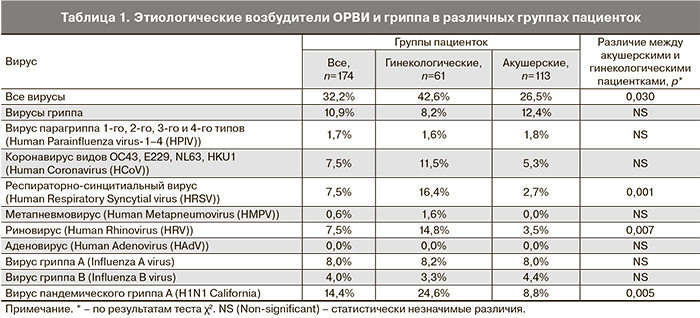
Среди всех пациенток, обследованных с направительным диагнозом ОРВИ либо грипп, доля положительных результатов ПЦР-исследования составляла 32,2%, среди которых у 10,9% (19 из 174) был выявлен генетический материал вируса гриппа: вирус гриппа А (Influenza A virus) у 7,5% (13 пациенток), а также вирус гриппа B (Influenza B virus) у 4,0% (7 пациенток). При этом среди беременных женщин, обследованных с направительным диагнозом ОРВИ либо грипп, доля положительных результатов ПЦР-исследования была гораздо выше, чем у небеременных, и составила 42,6% по сравнению с 26,5% (p=0,03) (табл. 1). Среди остальных типов вируса также встречался респираторно-синцитиальный вирус (Нuman Respiratory Syncytial virus (HRSV)) и риновирус (Нuman Rhinovirus (HRV)) как в 1-й, так и во 2-й группе пациенток. Аденовирус не был выявлен ни в одном случае.
Анализ распределения этиологических причин возникновения ОРВИ в обеих группах свидетельствует, что хотя частота выявления респираторных вирусов у беременных женщин была ниже, чем у небеременных в тот же временной интервал (45,9% в 1-й группе и 26,5% во 2-й), доля респираторных инфекций, вызванных вирусами гриппа, характеризующихся более тяжелым течением и осложнениями, была выше в группе беременных женщин и составила 8,1% в 1-й группе и 13,2% во 2-й. Достоверных различий среди остальных штаммов вируса между двумя группами выявлено не было, хотя отмечалась более низкая встречаемость респираторно-синцитиального вируса и риновируса в группе беременных пациенток по сравнению с небеременными.
Анализируя данные общеклинического исследования крови беременных пациенток, следует отметить, что в начале заболевания не отмечалось выраженного лейкоцитоза с палочкоядерным сдвигом у 98 из 113 (86,5%) женщин, в то же время к 10-му дню от начала заболевания у 22,5% отмечались количественные и качественные изменения состава лейкограммы на фоне возникновения осложнений вирусного заболевания. Аналогичная динамика наблюдалась и в отношении СОЭ. Существенного изменения уровня эритроцитов, гемоглобина, цветового показателя крови в процессе заболевания у наблюдаемых больных отмечено не было.
Частота основных осложнений у пациенток с лабораторно подтвержденной ОРВИ представлена в табл. 2. Угроза прерывания беременности наблюдалась у 15 больных (50%). Статистически значимых различий между беременными и небеременными пациентками выявлено не было.
При физикальном обследовании больных отмечалось улучшение аускультативной картины дыхания. Так, если при поступлении у 17 (56,7 %) больных аускультативно отмечались влажные хрипы, то к 5-му дню лечения они сохранялись только у 5 (16,7%), а к 16–20-му дню у 23 (76,7%) пациентов полностью отсутствовали какие-либо патологические звуки при аускультации. В процессе лечения у 20 (66,7%) больных в течение 3–5 дней уменьшилась интенсивность кашля.
У 52 новорожденных детей, обследованных в эпидемический период, было выполнено 67 исследований, 7 из которых (10,4%) дали положительный результат в плане выявления вирусов респираторной группы (4 новорожденных ребенка из 52, что составило 7,7%). Следует отметить, что во всех случаях вирусы были детектированы методом ПЦР в режиме реального времени в соскобе из зева детей. У одного пациента четыре из пяти выполненных в динамике исследований выявили РНК респираторно-синцитиального вируса. Необходимо также подчеркнуть, что временной интервал от момента забора биоматериала на исследование до получения результата во всех случаях не превысил 6 ч.
Общее количество обследованных детей в различных отделениях центра, локусы, из которых осуществлялся сбор биоматериала на исследования, а также спектр выявленных респираторных вирусных патогенов представлены в табл. 3.
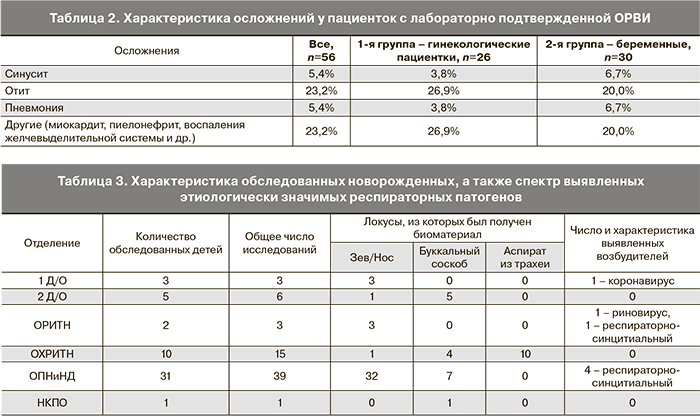
Исходя из результатов, представленных в табл. 3, ведущим этиологически значимым вирусным агентом, выявленным методом ПЦР и вызывавшим тяжелые поражения респираторного тракта у новорожденных, являлся респираторно-синцитиальный вирус. Так, дебют респираторно-синцитиальной вирусной инфекции у недоношенного пациента С., рожденного на 31-й неделе гестации и находившегося на выхаживании в ОПНиНД, сопровождался развитием выраженных дыхательных нарушений, потребовавших его перевода в ОРИТН. В отделении было диагностировано течение вирусного бронхиолита, ателектаз верхней доли правого легкого, проводилась комплексная терапия, включавшая пролонгированную искусственную вентиляцию легких, терапию положением, иммунозаместительную, антибактериальную и муколитическую терапию. После эрадикации респираторно-синцитиального вируса из дыхательных путей и стабилизации клинического состояния ребенок был иммунизирован препаратом паливизумаб.
У пациента К., близнеца из двойни, длительно отмечалась персистенция респираторно-синцитиального вируса в дыхательном тракте, что сопровождалось сохранением стойких дыхательных нарушений и необходимости проведения оксигенотерапии.
Пациентка А., глубоконедоношенная девочка, рожденная на 27-й неделе гестации, массой 450 г, страдающая бронхолегочной дисплазией, перенесла риновирусную инфекцию без существенного нарастания потребности в дополнительной подаче кислорода. В динамике, в постэпидемический период, была повторно обследована методом ПЦР, и после отсутствия детекции респираторных вирусов в соскобе из зева и носа было принято решение о начале курса иммунизации препаратом паливизумаб. В настоящее время ребенок выписан домой, кислородонезависим, демонстрирует догоняющий рост. Курс иммунизации паливизумабом продолжается, выполнено 3 инъекции препарата.
Обсуждение
Учитывая особенности отбора пациенток (направительный диагноз ОРВИ либо грипп), нельзя сделать однозначный вывод о распространенности того или иного вируса в популяции в период эпидемии. Тем не менее, полученные данные свидетельствуют о том, что предварительный диагноз, предполагающий вирусную природу заболевания, статистически значимо чаще подтверждается у небеременных пациенток. По-видимому, это является отражением стертого клинического течения респираторной инфекции у беременных. Этиотропная терапия оказывает эффект в ранние сроки от момента начала заболевания, что обуславливает необходимость надежной лабораторной диагностики.
Известно, что течение заболевания имеет некоторые отличительные черты в соответствии с тропностью тех или иных вирусов к дыхательной системе. Вирусы гриппа, респираторно-синцитиальные вирусы, аденовирусы поражают эпителий как верхних, так и нижних дыхательных путей с возможным развитием острого бронхита, бронхиолита, сопровождающихся синдромом обструкции нижних дыхательных путей. При риновирусной инфекции поражается преимущественно эпителий носовой полости, при парагриппе — гортани, а аденовирусная инфекция характеризуется возникновением конъюнктивита. Проведенное нами исследование продемонстрировало низкую точность клинической диагностики при респираторной инфекции, что особенно важно для беременных пациенток, учитывая ограничения при назначении соответствующих этиотропных препаратов.
Обращала на себя относительно невысокая частота выявления вирусных агентов у пациенток с диагнозом ОРВИ. Среди возможных причин следует прежде всего отметить, что существенная доля пациенток, обратившихся в поликлиническое отделение, была обследована спустя 3–5 дней после начала заболевания, что существенно снижало потенциальную вероятность выявления вируса. В данном исследовании не проводилась идентификация бактериальных патогенов. Однако в свете того, что вирусная природа заболевания была подтверждена менее чем в половине случаев, данное направление диагностики представляется актуальным.
При этом беременные женщины на основании проведенного анализа относятся к группе повышенного риска в отношении развития осложнений во время пандемии гриппа и чаще нуждаются в госпитализации. Одно из обоснований необходимости стационарного лечения гриппа при беременности – высокая материнская смертность (более 10%), отмечавшаяся другими авторами в ходе проведенных ранее исследований. Во время сезонных эпидемий гриппа беременные в большей степени предрасположены к формированию осложнений, причем риск их развития увеличивается пропорционально возрастанию срока гестации и наличию хронических заболеваний.
На основании результатов исследований, выполненных у новорожденных пациентов, необходимо отметить ведущую роль респираторно-синцитиального вируса в общей этиологической структуре вирусных инфекций, зарегистрированных среди пациентов неонатальных отделений центра, а также особую тяжесть течения данного вида инфекции.
Учитывая отмечавшийся ранее авторами ограниченный круг возможностей в плане терапии, целесообразность проведения профилактики респираторно-синцитиальной вирусной инфекции у детей особых групп в настоящее время не вызывает сомнений. Наиболее оптимальной и действенной в плане снижения показателей летальности на сегодняшний день является пассивная иммунизация путем введения препарата синагис (паливизумаб), представляющего собой класс моноклональных антител IgG, для специфической иммунопрофилактики респираторно-синцитиальной вирусной инфекции у детей из групп высокого риска ее тяжелого течения. В первую очередь это касается детей, в наибольшей степени подверженных данной инфекции, а именно: недоношенных в возрасте до 6 месяцев, рожденных на 35-й неделе беременности и ранее, детей в возрасте до 2 лет, которым требовалось лечение по поводу бронхолегочной дисплазии в течение последних 6 месяцев, а также детей в возрасте до 2 лет с гемодинамически значимыми врожденными пороками сердца.
Следует подчеркнуть высокую скорость выполнения, чувствительность и специфичность метода ПЦР в сравнении с традиционно принятыми в клинике иммунологическими методами в диагностике респираторных вирусных патогенов у новорожденных детей. Немаловажным является также и тот факт, что своевременно проведенная, высокоинформативная молекулярно-генетическая диагностика позволила во всех случаях быстро установить причину клинического ухудшения состояния пациентов и максимально рано начать этиопатогенетическую терапию. У всех новорожденных лечение привело к купированию патологических симптомов, летальности среди пациентов, включенных в исследование, выявлено не было.
В свете изложенного выше значимость метода ПЦР в диагностике респираторной патологии у беременных женщин и новорожденных представляется весьма убедительной. Дальнейшее совершенствование самого метода и разработка обновленных диагностических панелей, а также совершенствование нормативно-правовой базы поможет в будущем успешно решать вопросы ранней диагностики вирусной патологии в эпидемический период среди различных категорий пациентов.
Заключение
Использование метода ПЦР в режиме реального времени для диагностики острых респираторных заболеваний и гриппа в условиях стационара третьего уровня позволяет в короткие сроки выставить этиологический диагноз, необходимый для решения вопроса о госпитализации и выборе адекватных противоэпидемических мер. Необходимо подчеркнуть, что временной интервал от момента забора биоматериала на исследование до получения результата во всех случаях не превысил 6 часов.
Исследование, проведенное в рамках одного лечебного учреждения в эпидемический период, продемонстрировало существенные различия в этиологической структуре ОРВИ в различных группах пациентов.
ОРВИ при беременности следует рассматривать как фактор риска развития перинатальной патологии, обострения сопутствующих заболеваний, также оказывающих отрицательное влияние на течение беременности и родов. По результатам проведенного исследования выявлено, что заболевание чаще регистрируется в III триместре, при этом симптомы интоксикации наиболее выражены на ранних сроках беременности, а развитие осложнений в основном связано с поздней обращаемостью за медицинской помощью и госпитализацией больных.
Показана ведущая роль респираторно-синцитиального вируса в структуре вирусных инфекций новорожденных, а также особая тяжесть течения данного вида инфекции.
Опыт применения ПЦР в режиме реального времени в диагностике респираторных вирусных патогенов демонстрирует большие возможности и перспективы использования данного метода у больных различных категорий, в том числе у беременных женщин и новорожденных детей в эпидемический период. Несомненным преимуществом данного метода по сравнению с применявшимся ранее традиционным иммуноферментным анализом, является высокая скорость выполнения и информативность полученных результатов, которые вкупе позволяют клиницистам максимально рано начинать проведение не эмпирической, а этиопатогенетической терапии, направленной на борьбу с возбудителем. Использование ПЦР позволило в большинстве случаев назначить наиболее эффективную противовирусную терапию в первые 24–48 часов с момента дебюта заболевания, которая позволяет существенно сократить продолжительность лихорадки и других клинических симптомов заболевания.
Своевременная диагностика и профилактика респираторно-синцитиальной вирусной инфекции у новорожденных должны привести в первую очередь к улучшению показателей здоровья среди детей группы высокого риска тяжелого течения данного заболевания. Несомненно положительными факторами должны стать снижение частоты госпитализаций, уменьшение числа койко-дней и экономических затрат при лечении данных пациентов в условиях отделений реанимации, а также предотвращение потенциально возможных летальных исходов среди них.



