Эндометриоз традиционно признается одним из наиболее распространенных гинекологических заболеваний, увеличивающих риск бесплодия. Если у фертильных женщин эндометриоз обнаруживается с частотой 6–10%, то в контингенте больных, страдающих бесплодием, его диагностируют у 35–50% [1]. Среди пациенток с бесплодием и эндометриозом примерно у 1/3 заболевание проявляется в виде эндометриоидных кист яичников (ЭКЯ), которые могут быть единственным проявлением заболевания или сочетаться с другими локализациями эндометриоза. Кроме того, бесплодие у пациенток с ЭКЯ может ассоциироваться и с сопутствующими трубным и мужским факторами бесплодия [2, 3].
В отношении лечения бесплодия у женщин с ЭКЯ актуальной проблемой продолжает оставаться разработка оптимальных терапевтических алгоритмов, регламентирующих порядок использования хирургических методов и ЭКО с учетом клинической ситуации, определяемой особенностями репродуктивного статуса пациенток (связанного с возрастом и состоянием овариального резерва) и характером эндометриозного поражения яичников [4–7].
Цель исследования – у пациенток с ЭКЯ определить востребованность и эффективность алгоритмов лечения бесплодия с применением ЭКО и хирургических методов, подбираемых индивидуально с учетом проявлений эндометриоза яичников и особенностей клинического статуса, связанных с возрастом, состоянием овариального резерва и наличием сопутствующих показаний к ЭКО.
Материалы и методы
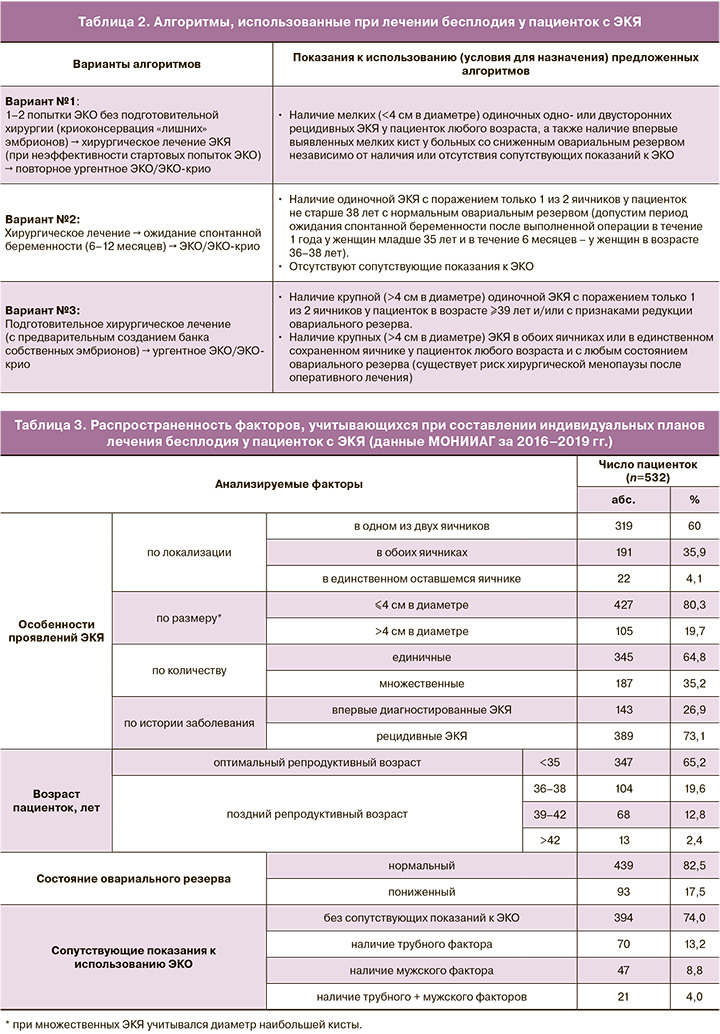
Обследуемый контингент составили 532 инфертильных пациентки с ЭКЯ, проходившие лечение бесплодия в отделении репродуктологии МОНИИАГ в 2016–2019 гг. При включении «профильных» больных в исследование проявления ЭКЯ характеризовали в соответствии с классификацией К.В. Краснопольской (табл. 1) [8]. Помимо особенностей ЭКЯ, приводимых в указанной классификации, анализировали распределение пациенток с учетом их возраста, состояния овариального резерва, наличия/отсутствия сопутствующих показаний к ЭКО, а также исключали возможную злокачественную природу обнаруживаемых яичниковых образований.
При представлении возрастного распределения пациенток с ЭКЯ выделяли интервалы, соответствовавшие «оптимальному» репродуктивному возрасту (<35 лет) и «позднему» репродуктивному возрасту, который, в свою очередь, подразделяли на интервалы (возраст от 36 до 38 лет, от 39 до 42 лет и более 42 лет).
Овариальный резерв оценивали по уровню антимюллерова гормона (АМГ) и базального числа антральных фолликулов (чАФ) диаметром более 10 мм. Редукцию овариального резерва констатировали при значениях АМГ <0,3 нг/мл и/или чАФ <4 в обоих яичниках [9].
Сопутствующие показания к ЭКО связывали с наличием у пациентки с ЭКЯ трубного и/или мужского факторов бесплодия, устанавливаемых по данным анамнеза и соответствующих диагностических методов.
Степень онкологической опасности обнаруживаемых кистозных образований оценивали с использованием ультразвуковых критериев, приводимых в классификации IOTA (International Ovarian Tumor Analysis) [10, 11]. В сложных случаях практиковали экспертное ультразвуковое исследование в динамике 2–3 циклов, цветовую допплерографию, магнитно-резонансную и компьютерную томографию. Учитывали также уровни онкомаркеров в крови (в обязательном порядке – НЕ-4 + СА-125 с расчетом индекса ROMA; дополнительно – СА-19-9, раковый эмбриональный антиген и альфа-фетопротеин).
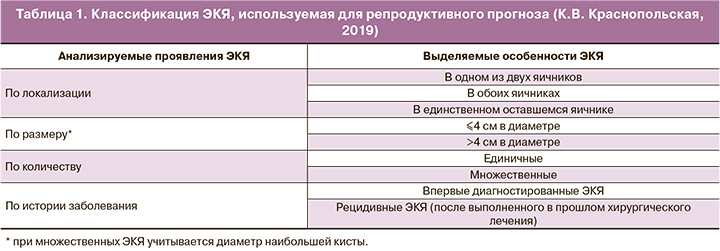
По результатам исходного обследования, учитывающего особенности проявлений ЭКЯ (табл. 1), возраст пациенток, состояние их овариального резерва, а также наличие/отсутствие сопутствующих показаний к ЭКО, принимали решение об использовании одного из трех вариантов «базовых» алгоритмов лечения бесплодия, регламентирующих порядок использования ЭКО и хирургических методов (табл. 2). В задачи работы входила оценка востребованности (частоты использования) каждого из этих трех терапевтических алгоритмов.
Хирургическое лечение ЭКЯ выполняли c учетом симптомов заболевания, размеров и локализации патологических яичниковых образований с применением эндоскопической техники и, у части больных, робот-ассистированных методик.
Одновременно при хирургическом лечении ЭКЯ удаляли другие очаги эндометриоза при его распространенной форме поражения; при наличии спаечного процесса проводилась соответствующая коррекция с восстановлением анатомических взаимоотношений органов малого таза.
Программу ЭКО реализовывали с учетом стандартных рекомендаций, регламентирующих ведение пациенток на до- и посттрансферном этапах процедуры [12]. При стимуляции суперовуляции в 60% случаях назначали «длинный» протокол с агонистом гонадотропин-рилизинг-гормона (ГнРГ) и в 40% – протокол с антагонистом ГнРГ. Криотехнологии (методику витрификации [13]) использовали с целью сохранения эмбрионов, генерированных при реализации программы стандартного ЭКО, для обеспечения возможности выполнения переноса эмбриона в нестимулированных циклах (ЭКО-крио). Криоконсервацию применяли также и для создания банка собственных эмбрионов перед проведением подготовительного оперативного лечения ЭКЯ в случаях повышенного риска индукции хирургической менопаузы (например, при необходимости проведения операции на обоих яичниках, а также у пациенток старше 38 лет и с исходно сниженным овариальным резервом). Размороженные эмбрионы использовали в послеоперационном периоде для переноса (ЭКО-крио) при возникновении сложностей с получением свежих эмбрионов.
Эффективность лечения бесплодия у пациенток с ЭКЯ при использовании предложенных вариантов терапевтических алгоритмов (табл. 2) оценивали по кумулятивной частоте наступления беременности (ЧНБ) на пациентку. Кумулятивную ЧНБ рассчитывали:
- при применении терапевтического алгоритма №1: по сумме беременностей, возникших в результате «стартового» применения ЭКО и ургентного ЭКО (назначавшегося после хирургической подготовки) с нативными или криоконсервированными эмбрионами;
- при применении терапевтического алгоритма №2: по сумме беременностей, обеспеченных хирургическим лечением (спонтанных беременностей в послеоперационном периоде) и ЭКО/ЭКО-крио;
- при применении терапевтического алгоритма №3: по сумме беременностей, достигнутых в результате применения после выполненной операции ургентного ЭКО с нативными и (у части больных) с криоконсервированными эмбрионами.
Статистический анализ
Статистический анализ полученных данных проводили с использованием программы Statistica V.8.0. Для оценки статистической значимости различий между сопоставляемыми группами по качественным признакам использовали критерий χ2 (χ2-тест) с поправкой Йейтса на непрерывность и двусторонний точный критерий Фишера. Различия между сравнивавшимися группами по анализируемым признакам во всех случаях расценивали как статистически значимые при уровне значимости р<0,05.
Результаты
При оценке распространенности среди наблюдавшихся пациенток с ЭКЯ факторов, подлежащих учету при составлении индивидуальных планов лечения бесплодия, были установлены следующие закономерности (табл. 3).
Обнаруженные ЭКЯ у 319/532 (60%) больных локализовались в одном из двух яичников (в 2 раза чаще в левом), тогда как двустороннее поражение яичников было диагностировано у 191/532 (35,9%) больных, а еще у 22/532 (4,1%) имело место поражение единственного сохраненного яичника. По размеру преобладали ЭКЯ менее 4 см в диаметре – 427 (80,3%) случаев, а относительно крупные эндометриомы (>4 см) встречались в 4 раза реже – у 105 (19,7%) пациенток. При уточнении распространенности одиночных и множественных ЭКЯ было установлено, что они встречаются соответственно у 345 (64,8%) и 187 (35,2%) больных, т.е. выявляемые одиночные и множественные ЭКЯ соотносятся примерно как 2:1. Изучение истории заболевания (по данным анамнеза и архивной медицинской документации) позволило установить, что диагностированные ЭКЯ в большинстве случаев являлись рецидивными 389 (73,1%), тогда как впервые выявленными они оказывались лишь у 143 (26,9%) пациенток.
Анализ возрастного распределения пациенток с ЭКЯ показал, что 347/532 (65,2%) были в возрасте <35 лет, т.е. находились в «оптимальном» репродуктивном периоде. Остальные пациентки пребывали в «позднем» репродуктивном периоде (в возрасте 36–38 лет – 104 (19,6%), 39–42 года – 68 (12,8%), >42 лет – 13 (2,4%) больных).
Состояние овариального резерва было расценено как удовлетворительное у 439 (82,5%) больных, признаки редукции овариального резерва наблюдались у 93 (17,5%) пациенток.
Сопутствующие показания к ЭКО отсутствовали у 394 (74%) пациенток. У остальных 138 (26%) больных имелись дополнительные показания к назначению ЭКО, связанные с наличием трубного фактора, – 70 (13,2%), мужского фактора – 47 (8,8%) или комбинации этих двух факторов бесплодия – 21 (4%).
При лечении бесплодия у пациенток с ЭКЯ в основном был использован терапевтический алгоритм №1 – у 427/532 (86,7%) больных, тогда как терапевтические алгоритмы №2 и №3 применялись значительно реже и примерно с одинаковой частотой (соответственно у 61/532 (11,4%) и 44/532 (8,3%) больных) (табл. 4). При этом кумулятивная ЧНБ оказалась наиболее высокой и статистически не различающейся (р=0,11) при использовании терапевтических алгоритмов №1 – 370/427 (86,7%) и №2 – 57/61 (93,4%). В группе, где применялся терапевтический алгоритм №3, кумулятивная ЧНБ достигла лишь 16/44 (36,4%), что было статистически меньше (р<0,001), чем в группах, использовавших в лечении терапевтические алгоритмы №1 и №2.

Обсуждение
Проведенное исследование продемонстрировало, что инфертильные пациентки с ЭКЯ представляют собой крайне неоднородную группу по проявлениям эндометриозного поражения яичников (с учетом критериев нашей классификации), возрасту, состоянию овариального резерва и наличию/отсутствию сопутствующих показаний к ЭКО. Тем не менее можно констатировать, что для данной группы пациенток характерно наличие относительно мелких ЭКЯ (у 427 (80,3%) больных), обнаруживаемых в единичном числе (у 345 (64,8%) больных), располагающихся в одном из двух яичников (у 319 (60%) больных) и по истории заболевания являющихся рецидивными (у 389 (73,1%) больных). Также для инфертильных женщин с ЭКЯ типичен «оптимальный» (<35 лет) репродуктивный возраст (у 347 (65,2%) больных), нормальное состояние овариального резерва (у 439 (82,5%) больных) и отсутствие сопутствующих показаний к ЭКО (у 394 (74%) больных).
Наша практика показывает, что для преодоления бесплодия у женщин с ЭКЯ наиболее востребованным оказывается терапевтический алгоритм №1, предусматривающий стартовое использование ЭКО и его повторное применение после удаления ЭКЯ у пациенток с сохраняющейся инфертильностью. Данный факт объясняется тем, что у большинства женщин диаметр кистозных образований не превышает 4 см, т.е. размеры обнаруживаемых ЭКЯ вполне позволяют не прибегать к их обязательному предварительному удалению. Здесь можно отметить, что, по современным представлениям, сохраняемые мелкие ЭКЯ (<4 см) не влияют на эффективность ЭКО и вообще не имеют очевидной связи с инфертильностью [14, 15]. Поэтому всех инфертильных женщин с таким проявлением яичникового эндометриоза следует рассматривать как пациенток с необъяснимым бесплодием, для преодоления которого рекомендуется ЭКО без какой-либо подготовительной хирургии. В тех случаях, когда клиническая ситуация позволяет использовать именно такой терапевтический алгоритм, кумулятивная ЧНБ может достигать очень высоких значений за счет многократных повторных попыток ЭКО и переносов эмбрионов в криопротоколах (в нашей работе удалось обеспечить кумулятивную ЧНБ у 370 (86,7%) пациенток). Сохраняющаяся инфертильность у отдельных пациенток при многократных повторных попытках ЭКО, выполнявшихся и после иссечения мелких ЭКЯ, по-видимому, объясняется «эмбриональным» фактором. Ухудшение качества эмбрионов можно связать с поздним репродуктивным возрастом, а уменьшение их получаемого количества – с возрастной редукцией овариального резерва, а также с уменьшением фолликулярного запаса из-за предпринятых в прошлом попыток хирургического лечения ЭКЯ (у пациенток с рецидивными ЭКЯ), возможными анэуплоидиями.
Терапевтический алгоритм №2 со стартовым хирургическим лечением ЭКЯ с целью восстановления естественной фертильности может быть применим в довольно ограниченном числе случаев (по нашим наблюдениям – не более чем у 61/ 532 (11,4%) всех пациенток с ЭКЯ). Это объясняется тем, что использование такого лечения противопоказано для пациенток старше 38 лет с признаками редукции овариального резерва и имеющих сопутствующие показания к ЭКО, связанные, например, с трубным или мужским факторами бесплодия. Кроме того, оперировать с расчетом на восстановление естественной фертильности, по нашему мнению, имеет смысл лишь крупные (>4 см) односторонние ЭКЯ. Это аргументируется тем, что мелкие ЭКЯ вряд ли вообще являются причиной бесплодия, и потому их хирургическое лечение с целью восстановления естественной фертильности не имеет теоретического обоснования [6, 7]. Заслуживает внимания, что кумулятивная ЧНБ при использовании терапевтического алгоритма №2 оказалась даже больше, чем при применении терапевтического алгоритма №1. Этот факт можно объяснить тем, что для использования терапевтического алгоритма №2 подбирались пациентки не старше 38 лет без признаков редукции овариального резерва. Также следует отметить, что хирургическое лечение ЭКЯ, используемое в терапевтическом алгоритме №2, никогда не влекло за собой существенного снижения овариального резерва, поскольку выполняемые манипуляции захватывали лишь один из двух яичников. Не приходится сомневаться, что именно эти обстоятельства и определили наилучшие результаты лечения бесплодия (по показателю кумулятивной ЧНБ) при применении у пациенток с ЭКЯ терапевтического алгоритма №2.
Терапевтический алгоритм с хирургическим лечением ЭКЯ с целью подготовки к ургентному ЭКО (вариант №3) также имеет весьма ограниченное применение (в нашей работе был использован только у 8,3% всех пациенток с ЭКЯ). Пациентки, нуждающиеся в применении именно такого алгоритма лечения бесплодия при ЭКЯ, характеризуются наиболее неблагоприятным репродуктивным прогнозом из-за своего возраста (≥39 лет) и состояния овариального резерва (исходное наличие признаков его редукции у части больных). У этих же женщин был увеличен риск хирургической менопаузы из-за необходимости удаления крупных кистозных образований, локализованных в обоих яичниках или в единственном сохраненном яичнике. По этой причине в данной группе пациенток с ЭКЯ, несмотря на многократные повторные попытки ЭКО и использование банка криоконсервированных эмбрионов, созданного до выполнения операции, кумулятивная ЧНБ оказалась заметно ниже, чем группах, где клиническая ситуация позволяла использовать терапевтические алгоритмы №1 или №2. Заслуживает внимания, что примерно у половины пациенток, получавших лечение с применением терапевтического алгоритма №3, после удаления ЭКЯ возникла необходимость использовать программу ЭКО с криоконсервированными эмбрионами (кумулированными до оперативного лечения) из-за отсутствия условий для проведения повторных стимуляций вследствие резко сниженного овариального резерва. Это наблюдение подтверждает мнение специалистов [5], указывающих на то, что создание банка криоконсервированных эмбрионов перед выполнением операций, сопровождаемых риском хирургической менопаузы, а также у женщин с ограниченным овариальным резервом представляется крайне важной задачей.
Заключение
При выборе оптимального алгоритма лечения бесплодия с применением ЭКО и хирургических методов у женщин с ЭКЯ необходимо учитывать не только возраст, состояние овариального резерва и наличие сопутствующих показаний к ЭКО, но и особенности обнаруженных кистозных образований, связанные с симптомами, их размерами, количеством, локализацией и появлением (впервые диагностированные или рецидивные).
Следует шире использовать технологии криоконсервации, поскольку запас криоконсервированных эмбрионов позволяет обеспечить повторные переносы эмбрионов без необходимости стимуляции яичников (что снижает общую стоимость программы), а также делает возможным продолжение лечения бесплодия в случаях развития хирургической менопаузы после удаления ЭКЯ.
Достижения вспомогательных репродуктивных технологий (ВРТ) за последние годы значительно превосходят достижения репродуктивной хирургии. Однако сегодня открытие огромного количества центров ЭКО, не обладающих возможностью проведения хирургических вмешательств при бесплодии, ориентированных только на использование ВРТ, привело к тому, что значение хирургического лечения этой формы бесплодия принижается, а многие исследования изначально ориентированы на признание главной роли ВРТ, что, по нашему мнению, ведет к потере качества хирургии. При адекватно и вовремя выполненной операции удается достигнуть спонтанной беременности в 30–70% случаев. Это значит, что 1–2 трети больных не нуждаются в проведении ЭКО.
Это не значит, что хирургия – безальтернативный способ лечения бесплодия. Необходимо особенно сокращать количество повторных (3-х, 4-х и т.д.) оперативных вмешательств при этой форме бесплодия, своевременно консультировать больных у репродуктолога, рекомендовать ВРТ. Как и во всей медицине должен быть золотой баланс между хирургией и ВРТ. Этого баланса можно достигнуть формированием мультидисциплинарной команды, «братскими» взаимоотношениями между хирургом и репродуктологом. Консилиум должен выработать план по достижению беременности, информировать пациентку о всех возможных путях преодоления бесплодия.



