Необходимость выявления предикторов компетентности гамет и эмбрионов диктуется базовой клинической стратегией лечения бесплодия – максимум эффективности с минимальным риском. В настоящее время уровень оснащенности лабораторий и центров репродуктологии позволяет применять для объективной оценки гамет и эмбрионов современные достижения в области молекулярной биологии.
Известно, что одним из ведущих факторов успешного проведения лечения бесплодия методом экстракорпорального оплодотворения и переноса эмбриона (ЭКО и ПЭ) является выбор эмбриона с высоким имплантационным потенциалом [1]. При этом качество эмбриона определяется состоянием гамет, в первую очередь, ооцита, для которого адекватное взаимодействие с окружающими клетками в процессе фолликулогенеза имеет большое значение. Двунаправленная коммуникация на межклеточном уровне в Граафовом пузырьке опосредована рядом регуляторных молекул-цитокинов, среди которых важную роль играют факторы роста (ФР), синтезируемые клетками-сателлитами ооцита [2–5].
Ростовые факторы представляют собой семейство секретируемых сигнальных молекул, которые могут индуцировать пролиферацию и дифференцировку клеток [6]. ФР обычно выступают в качестве инициаторов сигнального каскада в клетках путем паракринного, аутокринного (интра, юкстакринного, контактного) и эндокринного воздействия и классифицируются в соответствии со структурой и функцией. Среди ФР выделяют эпидермальные, сосудисто-эндотелиальные, колониестимулирующие, инсулиноподобные, ФР фибробластов, плаценты, нейрональные ФР и др. Все ФР находятся под влиянием эндокринных гормонов, включая половые стероиды и хорионический гонадотропин (ХГ), а также локальных паракринных факторов. Оогенез является стероид-опосредованным процессом, а семейство ФР осуществляет внутрифолликулярную регуляцию созревания ооцита, роста и дифференцировки гранулезных клеток [7–9]. Изменение биоактивности сателлитных клеток влияет на качество ооцита и дальнейшее развитие эмбриона [10–12].
Принимая во внимание, что разработка и внедрение персонифицированных и неинвазивных методов комплексной диагностики состояния ооцита и эмбриона при лечении бесплодия являются актуальными, целью настоящего исследования было определение зависимости профиля экспрессии матричных рибонуклеиновых кислот (мРНК) генов ФР в клетках фолликулярной жидкости (ФЖ) от исходов программы ЭКО при селективном переносе эмбрионов.
Материал и методы исследования
Исследование выполнялось в период с 2010 по 2012 гг. в отделении вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Проводился анализ профиля экспрессии мРНК генов ФР в клетках ФЖ при селективном переносе одного (elective single embryo transfer, eSET, n=30) или двух эмбрионов (double embryo transfer, DET, n=37) у 67 женщин, которые отвечали основным критериям включения в исследование: трубно-перитонеальный и/или мужской фактор бесплодия; возраст до 35 лет; нормальный или высокий овариальный резерв; не более двух неэффективных попыток ЭКО/интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) в анамнезе; отсутствие патологии эндометрия, миомы матки больших размеров, наружного генитального эндометриоза выше II стадии распространения, синдрома поликистозных яичников, тяжелых соматических заболеваний, представляющих угрозу течению беременности и родов; наличие не менее одного эмбриона, пригодного для переноса в полость матки; фертильной или субфертильной спермы супруга, информированного письменного согласия на участие в исследовании. Все супружеские пары были обследованы в соответствии с действующим законодательством, не имели противопоказаний для проведения ЭКО и ПЭ.
В программе ЭКО и ПЭ применялись три варианта стимуляции суперовуляции рекомбинантным ФСГ: протокол с антагонистами гонадотропин-рилизинг гормона (антГнРГ) в 54 циклах; «короткий» протокол с агонистами гонадотропин-рилизинг гормона (аГнРГ) в 20; «длинный» протокол с предварительной десенситизацией гипоталамо-гипофизарно-яичниковой системы с использованием препаратов аГнРГ в 32 циклах.
Гормональное обследование включало определение в сыворотке крови фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) гормонов, эстрадиола (Е2), антимюллерового гормона (АМГ) перед началом стимуляции и в день трансвагинальной пункции яичников (ТВП).

На эмбриологическом этапе ЭКО проводилась оценка качества ооцитов в соответствии с адаптированной по L.L. Veeck (2005) классификацией клиники Bourn Hall [13]. Переносу подлежали только эмбрионы «хорошего» качества [13, 14], то есть имеющие на 3-и сутки 6–8 или более бластомеров с правильной формой, отсутствием безъядерных фрагментов и/или наличием фрагментов цитоплазмы, занимающих не более 10% объема; на 5-е сутки – достигшие стадии бластоцисты, имеющие примерно 150–200 клеток, компактную внутреннюю клеточную массу и хорошо структурированную трофэктодерму (III и выше стадия по классификации D.K. Gardner, W.B. Schoolcraft, 1999) [15].
ФЖ аспирировали в индивидуальные сухие маркированные пробирки, с промывкой иглы после каждого фолликула. Учитывая, что клеточный состав ФЖ преимущественно (на 75%) представлен гранулезными клетками, в настоящей работе в качестве метода выделения клеток использовалось центрифугирование образцов ФЖ при 6000 об/мин в течение 10 минут с последующей отмывкой фосфатным буферным раствором. После центрифугирования в асептических условиях производилось ресуспендирование полученных клеток в 300 мкл 3мМ раствора гуанидинтиоционата для сохранения РНК, замораживание и хранение при температуре -80oС до начала исследования. Выделение РНК проводили методом фенольной депротеинизации с последующим осаждением РНК изопропанолом в присутствии соосадителя и отмывками промывочными растворами. Объем образцов после выделения составлял 50 мкл. Реакцию обратной транскрипции (ОТ) ставили в объеме 40 мкл (для реакции брали 33 мкл образца РНК) в течение 30 минут при температуре 40°С с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут. Для увеличения объема образца после ОТ и с целью предотвращения деградации ДНК копии (кДНК) разводили в 5 раз в ТЕ-буфере. Праймеры и зонды для полимеразной цепной реакции (ПЦР) были подобраны с учетом структуры генов таким образом, чтобы исключить отжиг на матрице геномной ДНК исследуемых и референсных генов. Реакции амплификации целевых и референсных генов ставили в разных пробирках в двух повторах. Для повышения чувствительности и специфичности ПЦР был применен «горячий старт» с применением парафина. Амплификацию осуществляли в режиме «реального времени» в объеме 35 мкл по следующей программе: 1 цикл – 80°С 30 сек, 94°С 1 мин; 50 циклов – 94°С 10 сек, 64°С 20 сек на приборе «ДТ-964» производства ООО «НПО ДНК-Технология». Измерение уровня флуоресценции проводили на каждом цикле при температуре 64ºС. Уровень экспрессии мРНК измеряли в относительных единицах, определяемых методом сравнения индикаторных циклов (∆∆Cq) с нормировкой на экспрессию референсных генов (ген гипоксантилфосфорибозилтрансферазы-1 (HPRT1), ген TATA-бокс-связывающего протеина (ТВР), ген глюкуронидазы бета (GUSB) и ген β-2 микроглобулина (B2М).
Был изучен уровень экспрессии следующих генов – представителей семейства ФР: амфирегулина (AREG); эпирегулина (EREG); антагониста костного морфогенетического протеина и сигнального пути TGF-β – гремлина-1 (GREM-1); гепарин-связывающего эпидермального фактора роста (HBEGF); инсулиноподобных факторов роста 1-го и 2-го типов (IGF-1, IGF-2); протеинов, связывающих инсулиноподобные факторы роста 1, 2, 3, 4 типов (IGFBP-1, IGFBP-2, IGFBP-3, IGFBP-4); лейкемия-ингибирующего фактора (LIF); рецептора лейкемия-ингибирующего фактора (LIFR); фактора некроза опухолей альфа (TNF-α).
Анализ результатов ОТ-ПЦР проводился в зависимости от исхода программы ЭКО. К I группе, составившей группу контроля, были отнесены образцы ФЖ женщин с благополучным результатом лечения бесплодия – рождением здорового ребенка (n=24). Среди II группы неуспешного завершения ЭКО и ПЭ было выделено три подгруппы. В IIa подгруппе производилась оценка экспрессии ФР при самопроизвольном прерывании беременности до 11 недель (n=13). Подгруппу IIb составили образы ФЖ пациенток с «биохимической» беременностью, не подтвержденной далее ультразвуковыми данными, при которой на 14-й день после ПЭ уровень β-субъединицы ХГ составлял не менее 30 мМЕ/мл, так называемые «преэмбрионические потери» (n=24). К IIс подгруппе были отнесены данные об экспрессии ФР в клетках ФЖ женщин с отрицательным результатом ЭКО, у которых уровень β-ХГ был менее 20 мМЕ/мл (n=43).
Для наглядности уровни экспрессии каждого гена были нормированы на медиану (Ме) уровня экспрессии соответствующего гена в I группе пациенток. Статистический анализ результатов проводился с использованием пакета прикладных программ SPSS v. 17. Статистически значимыми считали отличия при р<0,05, максимально значимыми при р<0,01.
Результаты исследования и их обсуждение
По клинико-анамнестическим данным было выявлено отсутствие статистически значимых различий между пациентками групп eSET и DET. Средний возраст пациенток составил 29,9±0,5 года, индекс массы тела 22,4±0,4 кг/м2.
Длительность бесплодия варьировала от 5,2 до 7,1 года, первичное бесплодие превалировало над вторичным в обеих группах. Среднее количество циклов ЭКО и ПЭ в анамнезе составило 1,2±0,1. Статистически значимых различий по частоте встречаемости соматических заболеваний между пациентками исследуемых групп выявлено не было. Анализ репродуктивной функции также показал отсутствие статистически значимых различий между пациентками.
Стимуляция суперовуляции проводилась препаратами рекомбинантного фолликулостимулирующего гормона по «короткому» или «длинному» протоколу с применением препаратов антагонистов (антГнРГ) и агонистов гонадотропин-рилизинг гормона (аГнРГ). Распределение протоколов стимуляции в исследуемых группах носило равномерный характер (р=0,095) и не различалось при оценке по тесту χ2 Пирсона (p=0,120). Протокол с антГнРГ применялся в половине циклов стимуляции в обеих группах (15 и 18 циклов для групп eSET и DET соответственно), принимая во внимание контингент отобранных для исследования пациенток, имеющих нормальный овариальный резерв, младший репродуктивный возраст, то есть входящих в группу риска по развитию синдрома гиперстимуляции яичников и наступлению многоплодной беременности. «Короткий» протокол с аГнРГ использовался в 20% циклов стимуляции суперовуляции (в 6 и 8 циклах для групп eSET и DET, соответственно). Одна треть циклов стимуляции проведена по «длинному» протоколу (9 и 11 случаев в группе eSET и DET соответственно). При анализе зависимости экспрессии мРНК обозначенных факторов от применяемой схемы стимуляции суперовуляции различий выявлено не было.
По длительности стимуляции, стартовым и суммарным дозам вводимых препаратов, толщине эндометрия в день введения триггера овуляции группы не различалась между собой. Триггером финального созревания ооцитов являлся препарат ХГ, доза которого составляла 8000–10000 МЕ, в зависимости от количества доминантных фолликулов. Через 35–36 часов после введения ХГ проводили трансвагинальную пункцию яичников (ТВП).
Представленные в табл. 1 данные по параметрам фолликуло-, оогенеза, раннего эмбриогенеза демонстрируют хороший ответ на стимуляцию суперовуляции в обеих группах. Большинство (80%) полученных ооцитов в обеих группах были зрелыми (находились на стадии мейоза II (MII)). Количество незрелых и дегенеративных ооцитов не различалось между группами.
Согласно полученным данным о стероидогенезе в процессе стимуляции суперовуляции, в группах не отмечено статистически значимых отличий по уровню гормонов. Так, для группы eSET до начала стимуляции уровни ЛГ (МЕ/л), ФСГ (МЕ/л), E2 (пмоль/л), АМГ (нг/мл) составили 5,5±0,4; 7,3±0,6; 96,3±25,5; 2,5±0,6; в день ТВП: 0,7±0,2; 7,7±1,4; 4819,0±323,8; 2,2±0,3 соответственно. Для группы DET до начала стимуляции уровни ЛГ (МЕ/л), ФСГ(МЕ/л), E2 (пмоль/л), АМГ (нг/мл) составили 5,5±0,8; 7,2±0,4; 123,2±27,9; 2,03±0,6; в день ТВП: 1,8±0,7; 7,8±0,9; 3725,3±218,5; 1,8±0,4 соответственно.
Оплодотворение проводилось методами стандартного ЭКО или с помощью ИКСИ (при наличии субфертильных отклонений спермограммы в день ТВП по критериям ВОЗ, 2010) в равной доле в группах (р=0,833). Проводилось индивидуальное культивирование эмбрионов.
В группе eSET осуществлялся перенос одной бластоцисты на 5-е сутки. В половине циклов в группе DET 20 (54,1%) одновременно были перенесены два эмбриона на 3-и сутки дробления. В связи с достаточным количеством эмбрионов «хорошего» качества 12 (32,4%) женщинам группы DET был осуществлен так называемый двойной перенос, то есть на 3-й и 5-й дни культивирования, 5 (13,5%) произведен одновременный перенос двух бластоцист. После ПЭ в полость матки производилась медикаментозная гормональная поддержка посттрансферного периода с применением одного из препаратов натурального прогестерона.
По частоте оплодотворения и дробления группы были сопоставимы. Однако частота формирования бластоцист в группе DET была в 2 раза ниже (27,5%), по сравнению с группой eSET (53,9%) (р=0,002), что отразилось на более низкой частоте криоконсервации оставшихся эмбрионов «хорошего» качества в группе DET (30,0%) по сравнению с eSET (62,8%) (р=0,003). В связи с извлечением из когорты дробящихся эмбрионов более одного эмбриона для переноса, количество эмбрионов, достигших стадии бластоцисты, а также эмбрионов «хорошего» качества, подвергшихся криоконсервации, в группе DET оказалось статистически значимо меньше, что снижает шансы наступления беременности в последующих циклах с переносом криоконсервированных эмбрионов в случае неэффективного данного цикла.
Анализ эффективности реализации программ ЭКО и ПЭ у исследуемых групп показал сопоставимую высокую частоту наступления беременности (40,0 и 37,8% для группы eSET и DET соответственно), более высокую частоту имплантации в группе eSET (40,0%) по сравнению с DET (22,9%, p=0,046), сравнительно одинаковый уровень ранних репродуктивных потерь при переносе одного и двух эмбрионов (25,0 и 28,6% соответственно).
В связи с полученными данными по реализации эмбриологического этапа, а также эффективности проведения программы ЭКО при переносе одного и двух эмбрионов представляется актуальным поиск новых неинвазивных подходов к установлению качественного ооцита и эмбриона по данным уровня экспрессии мРНК ФР в ФЖ с целью увеличения доли eSET. Была изучена связь экспрессии мРНК генов ФР в клетках 104 образцов ФЖ с исходами программы ЭКО при селективном переносе одного или двух эмбрионов. Данные об экспрессии генов ФР, полученные при аспирации ФЖ от каждого фолликула, анализировались индивидуально. При переносе двух эмбрионов во внимание принимался транскриптомный профиль каждого образца ФЖ, ассоциированного с перенесенным эмбрионом. В группе eSET с помощью ОТ-ПЦР обследовали 30 образцов ФЖ, в группе DET – 74 образца (табл. 2).
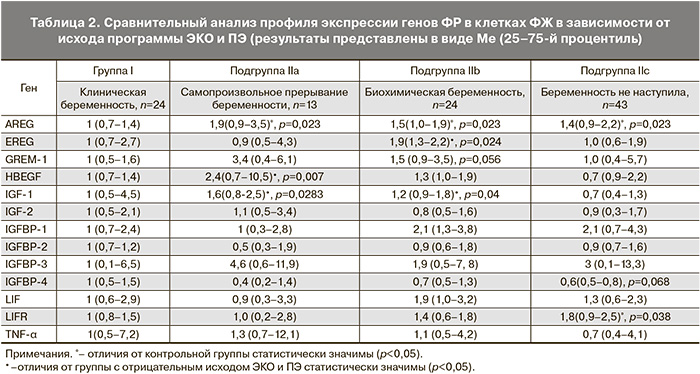
Наиболее значимые различия по уровню экспрессии мРНК в ФЖ в зависимости от исхода ЭКО наблюдались в группе эпидермальных ФР – AREG, EREG и HBEGF, опосредующих функционирование других ФР.
Отмечено статистически значимое повышение уровня экспрессии мРНК гена AREG в группах с неудачным исходом ЭКО и ПЭ (р=0,023), что косвенно может свидетельствовать о необходимости участия этого ФР в формировании ооцита. При этом, учитывая взаимодействие регуляторных ФР с эпидермальным ФР, вероятно, увеличение экспрессии мРНК AREG происходит в условиях, когда происходит активная стимуляция роста ооцита.
HBEGF гомологичен эпидермальному ФР (EGF), поскольку они воздействуют на клетку через одни и те же рецепторы и отвечают за внутрифолликулярные процессы роста и пролиферации. Отмеченное повышение в 2,4 раза (p=0,007) уровня экспрессии мРНК HBEGF в клетках ФЖ у пациенток с самопроизвольным прерыванием беременности в результате ЭКО и ПЭ может свидетельствовать об исходном нарушении локальных трофических механизмов при формировании ооцита, что может отразиться на развитии эмбриона.
Важную роль в развитии ткани играют ФР семейства соматомединов (IGF-1, IGF-2), опосредующие работу соматотропного гормона и отвечающие за процессы пролиферации. В нашем исследовании отмечено значимое повышение экспрессии мРНК IGF-1 в подгруппе IIa (в 1,6 раз, р=0,028) и IIb (в 1,2 раза, р=0,04) относительно подгруппы с отрицательным результатом. При анализе экспрессии мРНК IGF-2, IGFBP-2,
IGFBP-4 выявлено ее снижение в подгруппах с неудачным исходом ЭКО и ПЭ, однако эта тенденция не являлась статистически значимой. Указанное изменение экспрессии может характеризовать повышение потребности созревающего в неблагоприятных условиях ооцита в доставке энергоемких субстратов (глюкоза и др.) для обеспечения процессов метаболизма. Вышеуказанный сдвиг процессов, отражающийся в увеличении экспрессии мРНК некоторых ФР, свидетельствует в пользу регуляции процессов в фолликуле в сторону самосохранения и является предшественником событий изменения метаболизма эмбриона in vitro при отклонении развития от нормального, что укладывается в «теорию тихого эмбриона», выдвинутую группой ученых под руководством C.G. Baumann, H. Leese (2003) [16]. Ооциты, развивающиеся в окружении клеток, имеющих нормальный уровень экспрессии указанных факторов, чаще приводили к формированию эмбрионов, имеющих высокий потенциал к имплантации и дальнейшему развитию, а значит и благоприятному исходу программы ЭКО и ПЭ с рождением здорового ребенка.
Экспрессия LIF обнаруживается в эндометрии, эпителии маточных труб, брюшине и изменяется в зависимости от дня менструального цикла. Нами также показана экспрессия LIF клетками ФЖ, однако значимых различий в зависимости от исхода ЭКО и ПЭ между пациентками не выявлено. Отмечено статистически значимое повышение экспрессии мРНК LIFR – рецептора LIF в 1,8 раза при отрицательном исходе ЭКО и ПЭ (р=0,038), что может свидетельствовать в пользу того, что оогенез протекал в условиях внутрифолликулярного нарушения экспрессии LIF.
Повышение экспрессии мРНК гена GREM-1 – антагониста костного морфогенетического протеина BMP и сигнального пути TGF-β в гранулезных клетках подгруппы IIa в 3,4 раза и IIb в 1,5 раза не являлось статистически значимым.
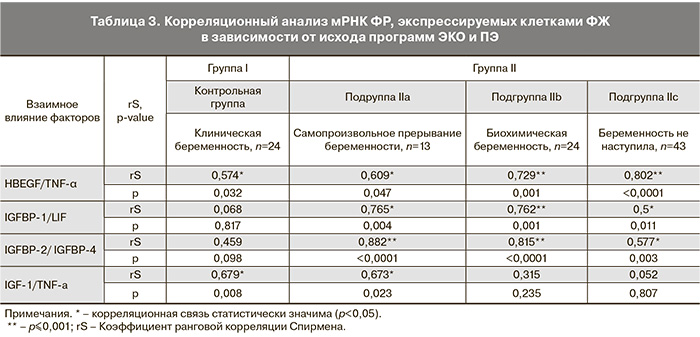
Данные анализа корреляционной зависимости экспрессии транскриптов изучаемых факторов представлены в табл. 3.
В подгруппах с неблагоприятным исходом ЭКО и ПЭ отмечена значимая положительная корреляция мРНК соматомедин-связывающих протеинов между собой (IGFBP-2/IGFBP-4) и с LIF, отражающая повышение метаболизма в клетках ФЖ.
Во всех подгруппах выявлена значимая корреляционная зависимость средней или умеренной силы между показателями экспрессии мРНК HBEGF и TNF-α. Активация апоптоза через TNF-α приводит к усилению репарационных процессов, поддерживаемых мощным действием ростовых факторов, в том числе HBEGF.
Резюмируя полученные данные, можно предположить, что клетки ФЖ участвуют в регуляции созревания ооцита посредством синтеза ФР, цитокинов с про- и антиапоптотической активностью, что согласуется с работами S. Assou (2008) и D. Wells (2010) [12, 17, 18].
Таким образом, имеющиеся статистически значимые различия в транскриптомном профиле генов ФР в клетках ФЖ в зависимости от исхода программы ЭКО свидетельствуют о том, что молекулярно-генетическое исследование образцов ФЖ, ассоциированных с перенесенным эмбрионом, является перспективным способом дополнительной неинвазивной оценки качества ооцита и способствует более объективному выбору эмбриона в программе ЭКО при селективном переносе эмбрионов.



