Качество окружающей среды играет важную роль в состоянии здоровья человека. По данным Всемирной организации здравоохранения, как минимум 25% всех заболеваний у взрослых связаны с влиянием вредных факторов окружающей среды. Однако существующие тренды – перенаселение, загрязнение воды, воздуха и почвы, глобализация, проблемы с утилизацией отходов, повышенный спрос на продукты питания и промышленные отходы – делают проблему влияния факторов окружающей среды на здоровье все более актуальной.
Тяжелые металлы характеризуются широким объемом использования в хозяйственной деятельности, способностью попадать в организм человека, проникать через гистогематические барьеры и накапливаться в различных тканях, а также длительным периодом выведения (например, для кадмия период выведения составляет от 15 до 40 лет).
Акт о природоохранных мерах CERCLA (англ. Comprehensive Environmental Response, Compensation, and Liability Act) представляет динамический список поллютантов, наиболее опасных для здоровья человека, и в данном списке тяжелые металлы занимают лидирующие позиции в течение нескольких десятилетий [1].
Негативное влияние тяжелых металлов на репродуктивное здоровье также является предметом внимания научного сообщества. Повышенная экспозиция тяжелых металлов связана с бесплодием, ранними репродуктивными потерями, преждевременными родами [2–4].
Восприимчивость организма к факторам внешней среды зависит от генетических особенностей: гены ферментов биотрансформации ксенобиотиков характеризуются значительным популяционным полиморфизмом, что, в свою очередь, приводит к изменению активности антиоксидантных ферментов [4, 5]. Поэтому изучение влияния тяжелых металлов на женскую фертильность в зависимости от генетических особенностей системы детоксикации является актуальным направлением научных исследований.
Цель данного исследования – проанализировать связь между уровнем тяжелых металлов (кадмий, ртуть, свинец) в крови, полиморфизмом генов системы биотрансформации ксенобиотиков и исходами программ вспомогательных репродуктивных технологий (ВРТ) у пациенток с бесплодием.
Материалы и методы
В одномоментное исследование было включено 300 супружеских пар, обратившихся для лечения бесплодия с помощью ВРТ в период с 2017 г. по 2018 г., с отсутствием противопоказаний к проведению ВРТ, подписанным информированным согласием на участие в исследовании. Критериями включения явились нормальный кариотип обоих супругов, отсутствие выраженной патозооспермии (100% тератозооспермия, абсолютная астенозооспермия, все виды азооспермии), возраст женщины от 18 до 39 лет включительно, индекс массы тела (ИМТ) женщины от 19 до 25 кг/м2 включительно. Критериями исключения явилось использование донорских гамет или суррогатного материнства, а также получение 3 и менее ооцитов в день трансвагинальной пункции яичников.
Все включенные в исследование супружеские пары были обследованы согласно приказу Минздрава России №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [3].
Овариальная стимуляция проводилась по протоколу с антагонистами гонадотропин-рилизинг-гормона, доза гонадотропинов была подобрана индивидуально. Триггер овуляции вводили при наличии в яичниках фолликулов диаметром 17 мм и более. В качестве триггера овуляции использован хорионический гонадотропин человека 8000–10 000 МЕ или агонист гонадотропин-рилизинг-гормона 0,2 мг. Поддержка лютеиновой фазы и посттрансферного периода у всех пациенток проведена по стандартному протоколу [6].
Забор венозной крови для проведения исследования осуществляли в день трансвагинальной пункции, после чего образцы подвергали криоконсервации при t=-70°С. Определение уровней ртути (Hg), кадмия (Cd) и свинца (Pb) осуществляли методом масс-спектрометрии с индуктивно-связанной плазмой, при этом лаборатория не имела доступа к клиническим характеристикам пациенток. Определение полиморфных локусов глутатион-S-трансферазы Т1 (GSTT1, делеция гена), глутатион-S-трансферазы M1 (GSTM1, делеция гена), глутатион-S-трансферазы Р1 (GSTP1, rs1695)), супероксиддисмутазы (SOD2, rs4880) цитохрома Р450 (CYP1A1, rs4646903, rs1048943, rs1799814), глутатионпероксидазы 1 (GPX1, rs1050450), эпоксидгидролазы 1 (EPH1, rs1051740), N-aцетилтрансферазы 2 (NAT2, rs1801280, rs179993, rs179930), сульфотрансферазы 1А1 (SULT1A1, rs9282861) производилось методом полимеразной цепной реакции в реальном времени с анализом кривых плавления с помощью коммерческих тест-систем (ООО «НПО ДНК-Технология», Россия).
Оплодотворение ооцитов осуществляли с помощью инсеминации ооцитов in vitro («классическое» ЭКО, далее ЭКО – метод оплодотворения), или интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Во время оплодотворения проводили морфологическую оценку ооцитов. Культивирование и перенос эмбриона проводили согласно принятым в клинической практике методикам.
В качестве исходов программ ВРТ оценивали: уровень фертилизации (<90% или ≥90%), уровень бластуляции (<30% или ≥30%), частоту наступления беременности (ЧНБ), частоту родов живым плодом и кумулятивную частоту родов.
Статистический анализ
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Количественные параметры представлены как медианы (интерквартильный размах). Качественные параметры представлены как абсолютные и относительные значения частоты (n, %). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, теста Краскела–Уоллиса/Манна–Уитни для сравнения количественных данных. Для оценки влияния уровня Hg/Pb в крови на исходы программ ВРТ в зависимости от полиморфизмов генов системы биотрансформации ксенобиотиков был применен регрессионный анализ (логистическая регрессия). Для оценки совместного влияния генотипа и Hg/Pb на исходы программ ВРТ были созданы сочетанные показатели Hg/Pb и генотипа. В качестве предикторов изучались факторы, выделенные в ходе проведения однофакторного анализа.
Различия между статистическими величинами считали статистически значимыми при уровне р<0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России.
Результаты
Пациентки, включенные в исследование, были среднего возраста, с нормальным ИМТ и овариальным резервом. Медиана возраста составила 31 год (29–34), ИМТ – 21,6 кг/м2 (20,4–23,5), антимюллерова гормона (АМГ) – 3,2 нг/мл (1,9–5,8). Распределение уровня тяжелых металлов в организме пациенток представлено в таблице 1.
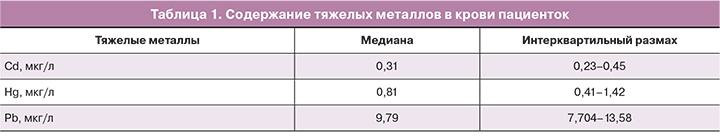
Были проанализированы клинико-анамнестические данные пациенток и их связь с уровнем тяжелых металлов в крови. Уровень Cd был значимо выше у курящих пациенток и у пациенток с избыточной массой тела. Уровень Hg был значимо выше у пациенток позднего репродуктивного возраста. Уровень Pb и Hg в крови был значимо ниже у пациенток с отсутствием аллеля Т гена CYP1A1 и у пациенток с наличием аллеля G гена GSTP1. Уровень Hg был также ниже при отсутствии делеции гена GSTT1. Уровень Cd в крови пациенток не был связан с полиморфизмами генов биотрансформации ксенобиотиков (табл. 2).

В различных квартильных подгруппах уровней Cd, Hg и Pb наблюдали сравнимую частоту клинических исходов ВРТ – ЧНБ, родов и кумулятивную частоту родов. Уровень Hg был погранично значимо выше у пациенток с низким уровнем фертилизации ооцитов (р=0,0769).
Проанализирована связь между концентрацией тяжелых металлов и полиморфизмом генов системы детоксикации, статистически значимые различия выявлены для 3 вариантов: делеция гена GSTT1, наличие аллеля G гена GSTP1, наличие аллеля Т гена CYP1A1 (табл. 2).
Пациентки с отсутствием аллеля Т гена CYP1A1 имели более низкую частоту родов (р=0,0270) и кумулятивную частоту родов (р=0,0249), которая у пациенток с генотипом Т/Т составила 51,6% (113/219 пациенток), у пациенток с генотипом Т/С – 38,1% (29/76 пациенток), у пациенток с генотипом С/С – 20% (1/5 пациенток).
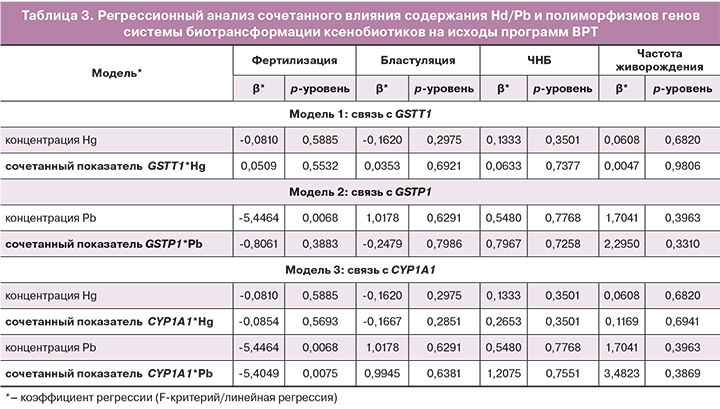
Данные по оценке сочетанного влияния концентрации Hg/Pb, делеции GSTТ1 и преобладания защитных аллелей в генах GSTP1 и CYP1A1 на ЧНБ представлены в таблице 3. Сочетанный показатель CYP1A1*Pb в крови значимо влиял на фертилизацию ооцитов.
Обсуждение
По данным нашего исследования, уровень Hg в крови увеличивался с возрастом пациентки, а уровень Cd был выше у курящих пациенток и у пациенток с избыточной массой тела.
Hg характеризуется небольшим относительно других тяжелых металлов периодом полувыведения (около 60–70 дней). Все люди подвергаются воздействию Hg, однако факторами повышенной экспозиции данного металла являются регулярное употребление контаминированных продуктов (рыба, моллюски) или контакт с парами Hg на производстве. Для уменьшения информационной ошибки в исследование были включены только пациентки, не имеющие профессиональных вредностей, поэтому повышение уровня Hg вследствие контакта с данным металлом на производстве может быть исключено. Наиболее вероятной причиной повышению уровня Hg у пациенток позднего репродуктивного возраста является накопление данного поллютанта с возрастом вследствие более длительной экспозиции.
Ассоциация между повышенным уровнем Cd и курением подтверждена многими исследовательскими группами [7, 8]. При активном и пассивном курении Cd попадает в организм ингаляционно с вдыхаемым дымом. Что касается ассоциации между Cd и ИМТ пациентки, такие корреляции не выявлены в аналогичных исследованиях. Возможным механизмом является изменение метаболизма Сd (кровь-паренхиматозные органы-кровь) в зависимости от метаболических особенностей пациентки.
Наиболее вероятным токсическим механизмом тяжелых металлов является индукция хронического окислительного стресса и нарушение функции митохондрий [9]. В ранее проведенных исследованиях показано влияние даже невысоких концентраций тяжелых металлов на фертильность [10]. Однако негативное воздействие тяжелых металлов на организм определяется также генетическими особенностями системы детоксикации [11, 12].
Глутатион-S-трансферазы (GST) – это семейство ферментов 2 фазы детоксикации, которые играют ключевую роль в защите клеток от экзогенных токсических веществ. Данное семейство белков катализирует конъюгацию восстановленного глутатиона с различными электрофильными и гидрофобными соединениями. Человеческие ферменты класса GST можно разделить на 5 основных классов: альфа, мю, пи, тета и дзета. Гены, кодирующие синтез данных ферментов, характеризуются значительным популяционным полиморфизмом. Альтернативный сплайсинг генов GSTT1 и GSTP1 может приводить к множеству вариантов транскриптов. Роль полиморфных вариантов генов GST изучалась многими научными группами; полиморфизмы данного гена увеличивают риск сердечно-сосудистых [13], онкологических [14] и иммунологических [15–17]заболеваний, а также влияют на фармакодинамику лекарственных средств [18].
Ген CYP1A1 кодирует фермент цитохром Р450 1А1, который относится к суперсемейству ферментов цитохрома Р450. Белки цитохрома Р450 представляют собой монооксигеназы, которые катализируют многие реакции, участвующие в метаболизме ксенобиотиков и лекарственных средств, синтезе холестерина, стероидов и других липидов. Данный белок располагается в эндоплазматическом ретикулуме, а его экспрессия индуцируется некоторыми полициклическими ароматическими углеводородами (ПАУ). Эндогенный субстрат данного белка на сегодняшний день неизвестен; однако известно, что в процессе трансформации ПАУ синтезируются канцерогенные соединения, поэтому полиморфные варианты данного гена увеличивают риск рака легкого у курильщиков [19]. Также существуют данные о связи данного гена с развитием других онкологических заболеваний [20, 21].
В нашем исследовании была выявлена связь между полиморфизмами генов системы детоксикации и уровнем тяжелых металлов в организме женщины, а также сочетанное влияние тяжелых металлов и полиморфных вариантов генов на низкую частоту фертилизации ооцитов. При анализе научной литературы нами не было найдено аналогичных данных, полученных у пациенток с бесплодием в циклах ВРТ.
Делеция гена GSTТ1 ассоциирована с повышением Hg в крови женщины. Отсутствие аллеля G в гене GSTP1 связано с повышением уровня Cd в крови женщины. Наличие аллеля Т в гене CYP1A1 ассоциировано с повышением уровня как Hg, так и Cd в крови женщины.
Сочетанное воздействие полиморфного варианта CYP1A1 и повышенного уровня Pb приводило к снижению частоты фертилизации ооцитов, но не влияло на частоту бластуляции эмбрионов и на клинические исходы ВРТ (ЧНБ, частота живорождения).
Оплодотворение ооцитов – это сложный каскад молекулярных событий, в результате которых происходит снятие блока II мейотического деления и возобновление мейоза, формирование зиготы с материнским и отцовским пронуклеусом. Цитоплазма ооцита реорганизуется, происходит активация генов, ответственных за пролиферацию и дифференцировку, а также распределение органелл по различным полюсам ооцита, что необходимо для равномерного распределения органелл среди бластомеров эмбриона. Наиболее вероятным патогенетическим механизмом влияния тяжелых металлов на процесс фертилизации ооцита является нарушение внутриклеточного метаболизма кальция или повреждения веретена деления, однако данный вопрос требует дальнейшего изучения и подтверждения.
Заключение
Полученные нами данные свидетельствуют о важной роли полиморфных вариантов генов системы детоксикации в накоплении тяжелых металлов в организме пациенток, а также в снижении частоты фертилизации ооцитов в циклах ВРТ.



