Одной из основных актуальных проблем современности во всех развитых странах является бесплодие. Несмотря на то что современная репродуктивная медицина с каждым годом помогает большинству бесплодных пар достичь наступления беременности, частота успешных программ экстракорпорального оплодотворения (ЭКО) находится на достаточно низком уровне [1].
Причинами ненаступления беременности являются как мужские, так и женские факторы. Основным фактором, влияющим на возможность получения эмбриона «хорошего» качества, способного к имплантации и формированию здорового плода, являются компетентные женские и мужские гаметы. В то время как получение спермы пациентов для визуального определения ее качества является простым в техническом плане методом диагностики, определение качества ооцитов возможно только при проведении трансвагинальной пункции фолликулов (ТВП) в рамках программ ЭКО. В связи с тем, что проведение программ ЭКО связано с приемом гормональных препаратов, потенциальными интраоперационными и послеоперационными осложнениями, развитием синдрома гиперстимуляции яичников, в последние годы ученые занимаются поиском биомаркеров качества ооцитов, а также способов улучшения их качества.
Яйцеклетки формируются из примордиальных половых клеток в антенатальный период и их качество зависит от координированного взаимодействия с клетками гранулезы в постнатальный период посредством аутокринных, паракринных и эндокринных факторов [2]. Поэтому молекулярный состав фолликулярной жидкости (ФЖ) является отражением качества оогенеза в антенатальный и постнатальный периоды как было продемонстрировано в обзорной статье Qasemi M. и Amidi F. об использовании представителей класса малых некодирующих РНК – микроРНК – ФЖ в качестве биомаркеров возможных нарушений фолликулогенеза и оогенеза при синдроме поликистозных яичников, синдроме истощения яичников и эндометриозе [3].
Проведенными ранее исследованиями продемонстрировано, что мио-инозитол в сочетании с фолиевой кислотой, омега-3 и витамин D оказывают непосредственное влияние на метаболомный, липидомный, протеомный, транскриптомный профили фолликулярной жидкости, изменения которых были выявлены у женщин с пониженной фертильностью [4, 5]. Мио-инозитол является важным компонентом фолликулярного микроокружения и играет определяющую роль как в ядерном, так и в цитоплазматическом развитии ооцитов. Были проведены исследования, в которых было показано, что высокое содержание мио-инозитола в ФЖ пациенток во время проведения программ ЭКО коррелировало с высоким качеством ооцитов, в то время как его снижение – с плохим качеством [6]. В связи с этим можно предположить, что добавление мио-инозитола в качестве подготовки к проведению программ ЭКО, а также при планировании самопроизвольной беременности сможет улучшить качество полученных ооцитов за счет уменьшения количества дегенерированных и незрелых ооцитов, при этом повышая качество полученных после оплодотворения эмбрионов.
В проведенных ранее исследованиях было доказано, что применение фолатов, а также омега-3 является важным аспектом для нормофизиологического развития плода. Недостаточность фолатов нарушает метилирование ДНК и приводит к функциональному дефициту омега-3 ПНЖК у беременной, а недостаточность омега-3 ПНЖК стимулирует нарушения обмена фолатов [7]. Дефицит фолатов также может приводить к нарушению процессов роста и развития клеток и, как следствие, к увеличению частоты пороков развития эмбриона [8]. В 2017 г. было опубликовано исследование, в котором показано, что применение миоинозитола в программах подготовки к ЭКО способно повысить шанс получения зрелых ооцитов за счет обеспечения полноценного мейоза, а также снизить гормональную нагрузку и повысить эффективность программы ЭКО [9]. В 2019 г. группа ученых изучала влияние назначения инозитола в сочетании с фолиевой кислотой в качестве прегравидарной подготовки на исходы программы ЭКО у пациенток со сниженным овариальным резервом. Было обнаружено, что у пациенток группы с прегравидарной подготовкой было получено большее количество зрелых ооцитов (5 (0–7) против 2 (0–5); p=0,049) и эмбрионов хорошего качества (42,2% против 30,1%; p=0,049), чем в группе без предварительного лечения, а также установлена большая частота наступления беременности на перенос эмбриона в полость матки (38,1% против 30,0%; p=0,041) [10].
Витамин D играет важную роль в правильном развитии и функционировании организма. Активация рецептора витамина D может прямо или опосредованно регулировать экспрессию очень большого числа генов [11]. В 2018 г. был опубликован систематический обзор, в котором было показано, что частота живорождения у женщин с недостаточным уровнем витамина D после проведения программы ЭКО была достоверно ниже, чем у женщин с достаточным уровнем витамина D (RR 0,74; 95% ДИ 0,58–0,90) [12]. Достоверный эффект от добавления витамина D пациенткам с диагностированным бесплодием еще недостаточно изучен, несмотря на то, что в некоторых исследованиях было показано увеличение частоты наступления клинической беременности, а также частоты живорождения у женщин с достаточным уровнем витамина D.
В связи с этим дальнейшие исследования эффективности применения вышеуказанных препаратов до вступления пациенток в программы ЭКО с целью улучшения результативности стимулированных циклов являются актуальными.
Материалы и методы
В отделение вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России обратились 52 супружеские пары с целью преодоления бесплодия. Среди данных супружеских пар были выделены 25 пар, где пациенткам был произведен селективный перенос 1 эмбриона в полость матки на 5-е сутки культивирования.
Супружеским парам, включенным в данное научное исследование, было проведено предварительное полное клинико-лабораторное обследование в соответствии с приказом Минздрава России №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Стимуляция овуляции у обследуемых женщин проводилась по стандартному протоколу со 2–3-го дня менструального цикла с использованием антагοниста гонадοтропин-рилизинг-гормοна (ант-ГнРГ) в комбинации с рекомбинантным фолликулостимулирующим гормоном (р-ФСГ). Для финального созревания ооцитов назначался хорионический гонадотропин человека (чХГ) в дозе 8000–10 000 МЕ/сут однократно внутримышечно в качестве триггера овуляции. Начиная со дня ТВП, производилась поддержка лютеиновой фазы цикла препаратами микронизированного прогестерона 300 мг/сутки интравагинально. Дозы вводимых препаратов, а также длительность стимулированного цикла статистически не отличались между исследуемыми пациентками (данные не приведены). Далее проводили ТВП с последующей морфологической оценкой зрелости полученных ооцитов. Производился раздельный сбор пула ФЖ из группы фолликулов правого и левого яичников, при этом кровь в полученной ФЖ отсутствовала. В день проведения ТВП супруги пациенток сдавали спермограмму с целью оценки качества спермы и выделения сперматозоидов, обладающих наибольшей оплодотворяющей способностью на основании их визуальной морфологической характеристики. Оплодотворение всех зрелых ооцитов осуществляли методом интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Через 16–18 ч после оплодотворения проводили визуальную оценку формирования зиготы. Качество полученных эмбрионов оценивали на 4–5-е сутки культивирования на основании морфологических критериев оценки развития эмбрионов Gardner.
Молекулярно-биологические методы исследования
Из собранных образцов ФЖ была выделена РНК колоночным способом с использованием набора miRNeasy Serum/Plasma Kit (Qiagen), проанализирована методом глубокого секвенирования с использованием набора по синтезу кДНК-библиотек NEBNext Multiplex Small RNA Library Prep Set for Illumina (Set11, New England Biolab, Germany) на платформе NextSeq 500 platform (Illumina, USA), проанализирована методом количественной ОТ-ПЦР в реальном времени с использованием наборов miScript II RT Kit (Qiagen, Hilden, Germany) и miScript SYBR Green PCR Kit (Qiagen, Hilden, Germany) по протоколам, подробно описанным в ранее опубликованных работах Тимофеевой А.В. и др. [13, 14].
Относительный уровень экспрессии кДНК оценивали по кратности изменения (КИ) методом ΔΔCt. M0s1 / M0s2 = 2-∆∆Ct, где M0s1 и M0s2 – исходные количества кДНК в образцах s1 и s2, ∆∆Сt=(Cts1-Ctnorm1)-(Cts2-Ctnorm2), Ct – значение цикла амплификации в точке пересечения кинетической кривой накопления продукта амплификации с линией порогового уровня флуоресценции, который определяется автоматически программным обеспечением амплификатора StepOnePlus; Cts1 и Cts2 – значения порогового цикла амплификации кДНК анализируемой hsa_piR_020497 в двух сравниваемых образцах s1 и s2; Ctnorm1 и Ctnorm2 – значения порогового цикла амплификации кДНК нормировочной эндогенной hsa_piR_016945 в двух сравниваемых образцах s1 и s2.
Статистический анализ
Для статистической обработки результатов использовали скрипты, написанные на языке R, и программу RStudio. Соответствие анализируемых параметров закону нормального распределения оценивали по значениям теста Шапиро–Уилка. Статистический анализ проводили с помощью теста Манна–Уитни, поскольку распределение признаков не соответствовало закону нормального распределения. Анализируемые данные представлены в виде медианы (Me) и интерквартильного интервала в формате Me (Q1;Q3). Величину порогового уровня значимости p принимали равной 0,05.
Результаты
Клинико-анамнестическая характеристика супружеских пар
При анализе клинико-лабораторных методов обследования 22 супружеских пар статистически значимых различий выявлено не было (данные не представлены). Средний возраст женщин, включенных в исследование, составил 31 год (23–35 лет). Средний возраст мужчин – 34 года (25–42 года). У 14 супружеских пар диагностировано вторичное бесплодие, в то время как у 8 пар в данном браке беременности в анамнезе отсутствовали. У 6 супружеских пар, включенных в исследование, отмечался сочетанный фактор бесплодия (диагностированный трубно-перитонеальный фактор в сочетании с мужским фактором). У 8 супружеских пар отмечался изолированный мужской фактор бесплодия, а у 6 супружеских пар – изолированный трубно-перитонеальный фактор. У 2 пациенток, включенных в исследование, в течение последнего года до проведения программы ЭКО проводилась ежемесячная фолликулометрия, по результатам которой выявлена хроническая ановуляция. В исследование были включены 7 женщин с наружным генитальным эндометриозом (НГЭ), из них у 2 пациенток была диагностирована эндометриоидная киста яичника малых размеров, не требующая оперативного вмешательства. Средняя продолжительность бесплодия у супружеских пар, включенных в исследование, составила 4 года (1–7 лет). У 8 супружеских пар в анамнезе были попытки ЭКО, при этом в 4 случаях – 2 и более неудачных попыток. У 14 пациенток данная попытка ЭКО – первая. Гормональный статус пациенток оценивался на 3-й день менструального цикла, предшествующего стимуляции, и соответствовал нормативным значениям для данной возрастной группы и фазы менструального цикла. Средние значения гормонов в сыворотке крови составили: ФСГ 5,5 МЕ/л; ЛГ 6,3 МЕ/л; АМГ 2,8 нг/мл. Остальные показатели гормонального статуса также были в пределах нормативных значений. У 14 пациенток в результате проведения программы ЭКО и переноса эмбриона в полость матки наступила беременность, при этом у 11 пациенток исход программы ЭКО был отрицательным. Среди них, у 3 супружеских пар с отрицательным исходом программы ЭКО отсутствовали криоконсервированные эмбрионы после проведенной программы, в связи с чем им была назначена прегравидарная подготовка, после которой была проведена повторная программа ЭКО. В таблице 1 приведена клинико-анамнестическая характеристика этих супружеских пар.
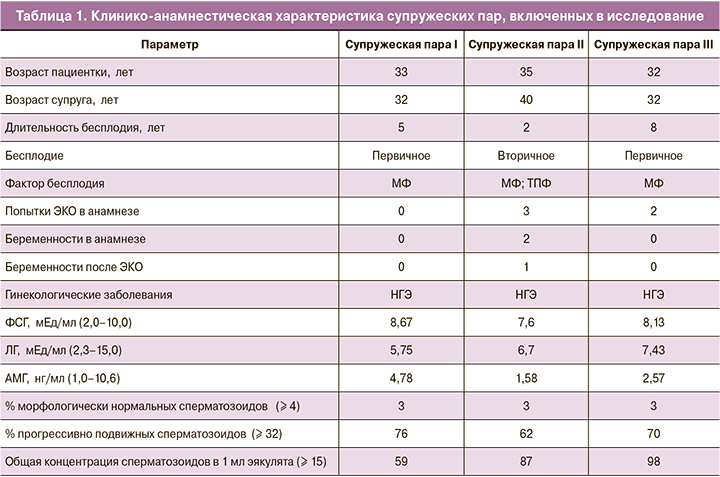
Результативность программы ВРТ до и после прегравидарной подготовки
При оценке морфологического качества полученных ооцитов у пациентки из супружеской пары I были обнаружены цитоплазматические аномалии (гранулярность цитоплазмы, наличие вакуолей в цитоплазме), что свидетельствует об их низком качестве, также у ооцитов отмечалась темная цитоплазма, с чем некоторые авторы связывают низкое качество эмбрионов [15]. Диффузная периферическая грануляция ассоциируется с неравномерным формированием пронуклеусов. Наличие нескольких вакуолей или одной вакуоли размером более 14 мкм в диаметре является негативным прогностическим признаком, так как частота оплодотворения таких ооцитов существенно снижается [16]. Кроме того, при наличии в ооците вакуолей увеличивалась частота биохимической беременности с последующим снижением частоты клинической беременности. В связи с отсутствием эмбриона удовлетворительного качества, пригодного к переносу в полость матки, этап переноса эмбриона был отменен.
Пациенткам из супружеских пар II и III и под УЗ-контролем был произведен селективный перенос в матку 1 эмбриона на 5-е сутки развития. У пациентки из супружеской пары III тест на беременность на 14-й день после переноса эмбриона в полость матки был отрицательным. У пациентки из супружеской пары II на сроке беременности 8 недель при проведении УЗ-исследования была диагностирована неразвивающаяся беременность, в связи с чем была выполнена вакуум-аспирация плодного яйца. При проведении цитогенетического исследования определен кариотип абортуса – 46XX.
Учитывая неудовлетворительные исходы программы ЭКО у данных пациенток, им было назначено лечение с целью улучшения качества полученных ооцитов, последующего повышения качества полученных после оплодотворения эмбрионов и, соответственно, исходов программы ЭКО. Пациенткам были назначены следующие препараты: «Ультра Д» в дозировке 25 мкг (1000 МЕ) по 1 таб. 2 раза/сут; омега-3 в дозировке 600 мг по 1 таб. 1 р/сут; «Иноферт» (мио-инозитол 1000 мг, фолиевая кислота 0,1 мг) по 1 пакетику 2 р/сут.
Пациентка из супружеской пары I обратилась в отделение с целью проведения повторной программы ЭКО после 3 месяцев приема препаратов, пациентка из супружеской пары II – после 7 месяцев, а пациентка из супружеской пары III – после 4 месяцев терапии. Стимуляция овуляции у обследуемых женщин проводилась по протоколу, аналогичному предыдущему стимулированному циклу. Через 35–36 ч после введения триггера овуляции производилась ТВП фолликулов с последующим эмбриологическим этапом, в который входили: оценка степени зрелости ооцитов, а также их морфологических характеристик; оценка показателей спермограммы в день ТВП с отбором сперматозоидов; оплодотворение ооцитов и дальнейшее культивирование полученных эмбрионов.
У супружеских пар I и II на 5-е сутки после проведения ТВП фолликулов в асептических условиях под УЗ-контролем был произведен селективный перенос 1 эмбриона в полость матки. У супружеской пары III, учитывая данные анамнеза бесплодия, а также желание супружеской пары, был произведен перенос 2 эмбрионов в полость матки на 4-е сутки после проведения ТВП. У пациентки из супружеской пары II тест на беременность был отрицательным через 14 дней после проведения переноса эмбриона в полость матки. У пациентки из супружеской пары III на сроке беременности 10 недель при проведении УЗ-исследования была диагностирована неразвивающаяся беременность, в связи с чем было произведено инструментальное удаление плодного яйца с последующим выскабливанием полости матки. При проведении цитогенетического исследования определен кариотип абортуса – 46XX. У пациентки из супружеской пары I исход данного цикла ЭКО завершился своевременными самопроизвольными родами здоровым плодом.
Подробная характеристика эмбриологического этапа трех пациенток, включенных в исследование, указана в таблице 2.
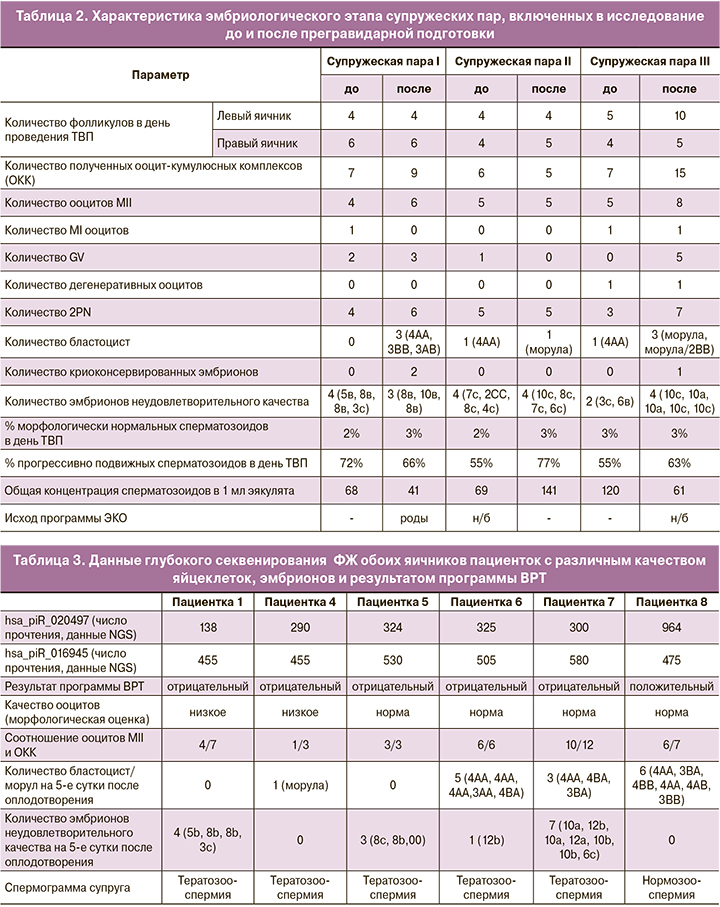
Изменение уровня экспрессии hsa_piR_020497 в ФЖ яичников пациенток до и после прегравидарной подготовки
Для идентификации малых некодирующих РНК, дифференцирующих образцы ФЖ пациенток с различным исходом программы ВРТ, было выполнено глубокое секвенирование РНК образцов 6 пациенток – пяти пациенток с отрицательными исходами программы ВРТ (пациентки 1, 4, 5, 6, 7) и с положительным исходом программы ВРТ (пациентка 8). У пациенток с отрицательными исходами программы ВРТ было выявлено (табл. 3) либо низкое морфологическое качество ооцитов в сочетании с низким соотношением MII/ОКК и отсутствием формирования бластоцист к 5-м суткам после оплодотворения яйцеклетки (пациентки 1 и 4), либо нормальная морфология ооцитов в сочетании с соотношением MII/ОКК, равным 1, и отсутствием формирования бластоцисты (пациентка 5), либо нормальная морфология ооцитов в сочетании с соотношением MII/ОКК, равным 0,8, и превалированием формирования эмбрионов неудовлетворительного качества над бластоцистами к 5-му дню после оплодотворения (пациентка 7), либо нормальные морфологические показатели яйцеклеток и полученных эмбрионов (пациентка 6). ФЖ яичников пациентки 8 была использована в качестве контрольной ввиду полученных у нее яйцеклеток отличного морфологического качества, соотношения MII/ОКК, равного 0,9, формирования бластоцист среднего, хорошего и отличного качества на основании морфологических критериев оценки развития эмбрионов Gardner при отсутствии формирования эмбрионов неудовлетворительного качества. У супругов пациенток 1, 4, 5, 6 и 7 была выявлена тератозооспермия, в связи с чем для оплодотворения яйцеклеток был выбран метод ИКСИ. У супруга пациентки 8 отмечалась нормозооспермия. Учитывая неудачные попытки ЭКО в анамнезе, а также желание супружеской пары, оплодотворение ооцитов было произведено методом ИКСИ.
Из 86 пивиРНК и 79 микроРНК, идентифицированных методом глубокого секвенирования во всех 6 образцах, мы выбрали пивиРНК hsa_piR_020497, дифференцирующую все 5 образцов ФЖ с отрицательным исходом программы ВРТ от контрольного образца, а в качестве референсной РНК для последующих исследований мы выбрали пивиРНК hsa_piR_016945 ввиду стабильного уровня экспрессии во всех анализируемых образцах (табл. 3).
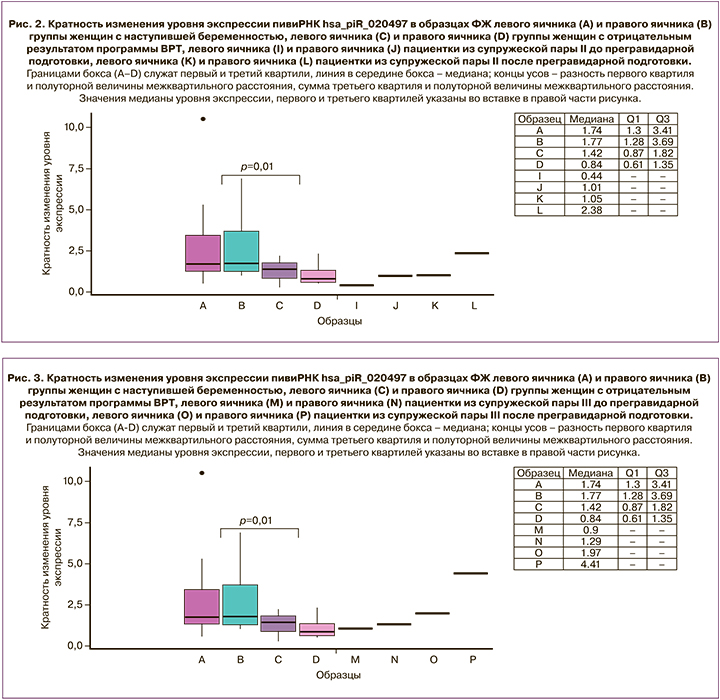
Для валидации выявленных отличий уровня экспрессии hsa_piR_020497 был использован метод количественной ОТ-ПЦР в реальном времени. Были проанализированы 44 образца ФЖ из левого и правого яичников 22 пациенток, из которых у 8 пациенток беременность не наступила, а у 14 пациенток был положительный исход программы ВРТ. Образцы ФЖ левого и правого яичников пациенток из супружеских пар I– III, описанных выше, до и после прегравидарной подготовки были сопоставлены с данной выборкой по уровню экспрессии hsa_piR_020497, и данные представлены на рисунке 1 для пациентки из супружеской пары I, на рисунке 2 – для пациентки из супружеской пары II, на рисунке 3 – для пациентки из супружеской пары III.
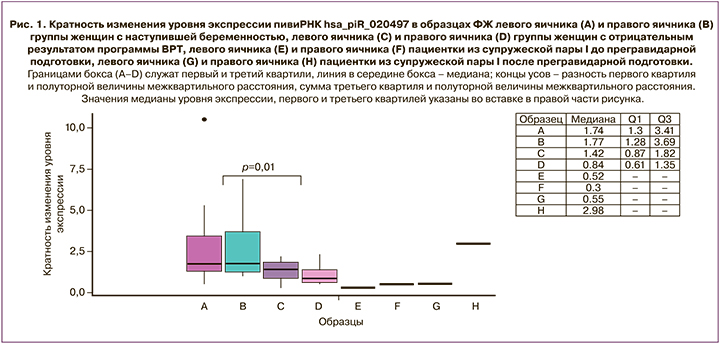
Методом Манна–Уитни выявлено статистически значимое различие (р=0,01) между группой женщин с наступившей беременностью и группой женщин с отсутствием беременности в виде более высокого уровня экспрессии hsa_piR_020497 в ФЖ левого и правого яичников группы пациенток с положительным результатом ВРТ (1,74 (1,3;3,41) и 1,77 (1,28;3,69) соответственно) относительно такового в ФЖ левого и правого яичников группы пациенток с отрицательным результатом ВРТ (1,42 (0,87;1,82) и 0,84 (0,61;1,35) соответственно).
Обращает на себя внимание повышение уровня экспрессии hsa_piR_020497 в ФЖ правого яичника пациентки из супружеской пары I после лечения (2,98 (2,98;2,98), рис. 1, Н) до значений уровня экспрессии hsa_piR_020497, характерных для левого и правого яичников группы пациенток с наступившей беременностью (1,74 (1,3;3,41), рис. 1, А и 1,77 (1,28;3,69), рис. 1, B соответственно), при сравнении с таковым в ФЖ левого и правого яичников данной пациентки до лечения (0,52 (0,52; 0,52), рис. 1, Е и 0,3 (0,3;0,3), рис. 1, F). Отсутствие изменений уровня экспрессии hsa_piR_020497 в ФЖ левого яичника после проведенного лечения (0,55 (0,55;0,55), рис. 1, G) может быть связано с наличием эндометриоидной кисты и возможного долгосрочного отрицательного влияния на фолликулогенез в данном яичнике. После проведенного лечения улучшилось качество полученных яйцеклеток, равно как и эмбриологические показатели (табл. 2), что привело к наступлению беременности и рождению доношенного ребенка.
У пациентки из супружеской пары II обнаружено увеличение уровня экспрессии hsa_piR_020497 в ФЖ обоих яичников после проведенного лечения (рис. 2, К vs I, L vs J) c достижением значения уровня экспрессии hsa_piR_020497 в правом яичнике (2,38 (2,38;2,38), рис. 2, L), характерного для левого и правого яичника группы пациенток с наступившей беременностью (1,74 (1,3;3,41), рис. 2, А и 1,77 (1,28;3,69), рис. 2, B соответственно). Однако беременность не наступила и после прегравидарного лечения, возможно, из-за наличия воспалительного процесса в малом тазу после позднего выкидыша дихориальной триамниотической тройней в анамнезе, осложненного преждевременной отслойкой нормально расположенной плаценты, развитием кровотечения, а впоследствии непроходимостью маточных труб.
У пациентки из супружеской пары III выявлено значительное увеличение уровня экспрессии hsa_piR_020497 в ФЖ обоих яичников после проведенного лечения (рис. 3, O vs M, P vs N) c достижением значений уровней экспрессии hsa_piR_020497 в левом яичнике (1,97 (1,97;1,97), рис. 3, О) и правом яичнике (4,41 (4,41;4,41), рис. 3, Р), характерных для левого и правого яичников группы пациенток с наступившей беременностью (1,74 (1,3;3,41), рис. 3, А и 1,77 (1,28;3,69), рис. 3, B соответственно). После проведенного лечения отмечалось увеличение количества ОКК и числа эмбрионов, пригодных для переноса, по сравнению с циклом ВРТ до лечения (табл. 2). После переноса двух эмбрионов на 4-е сутки после оплодотворения произошла имплантация одного из эмбрионов, но на 10-й неделе гестации была диагностирована неразвивающаяся беременность.
Функциональная значимость потенциальных генов-мишеней hsa_piR_020497
При анализе потенциальных генов-мишеней hsa_piR_020497, идентифицированных с использованием алгоритма, описанного в статье Тимофеевой А.В. и соавт. [14], выявлено их участие в таких биологических процессах, как регуляция метаболизма нуклеиновых кислот (PAX4 – транскрипционный фактор, содержащий парный бокс-домен 4; протоонкоген JUNB; NHLH1 – транскрипционный фактор, содержащий спираль-петлю-спираль 1), клеточный рост (белковая фосфатаза SSH1, регулирующая динамические изменения актиновых филаментов), транспорт веществ (пуринергический рецептор P2RX1, формирующий АТФ-регулируемые ионные каналы, обеспечивая быструю и избирательную проницаемость для катионов), метаболизм белков (TRIM10, являющийся членом E3 убиквитинлигазного комплекса), метаболические и энергетические процессы в клетке (NADSYN1 – синтетаза 1 никотинамидадениндинуклеотида, являющегося коферментом в окислительно-восстановительных реакциях, предшественником для некоторых клеточных сигнальных молекул и субстратом для посттрансляционных модификаций белков) (рис. 4).

При рассмотрении сигнальных путей, в которых участвуют белковые продукты генов-мишеней hsa_piR_020497, обращает на себя внимание участие JUNB, PLK3, SSH1 в основных сигнальных путях, отвечающих за формирование фолликула и созревание яйцеклетки, а именно: сигнальных путях, опосредованных рецептором к эпидермальному ростовому фактору (ErbB), митоген-активированной протеинкиназой (MAPK), трансформирующим ростовым фактором бета (TGFβ), инсулиноподобным ростовым фактором 1 (IGF1), а также фосфатидилинозитол-3-киназном пути, опосредованном действием Akt [17, 18]. Кроме того, участие белковых продуктов других генов-мишеней hsa_piR_020497, P2RX1 и NADSYN1 в регуляции концентрации цитозольного кальция и метаболизме витаминов и кофакторов соответственно предполагает взаимное участие мио-инозитола и hsa_piR_020497 в оогенезе. Известно, что мио-инозитол образуется из глюкозо-1-фосфат в реакции, катализируемой NAD, участвует в фосфоинозитидном сигнальном пути, регулирующем концентрацию внутриклеточного кальция, который играет важную роль в созревании ооцита, оплодотворении и эмбриональном развитии [19–21].
Обсуждение
Основной целью проведения программ ВРТ является предоставление супружеской паре с бесплодием персонализированного и оптимального лечения на основе их клинико-анамнестических характеристик с целью достижения положительного результата при минимизации риска отмены проведения программы ВРТ. Недостаточное количество, а также низкое качество извлеченных ооцитов во время пункции фолликулов и/или низкий уровень фертилизации после ИКСИ считаются главными причинами отрицательного результата при проведении программ ВРТ. Использование оральных контрацептивов или кортикостероидов для улучшения ответа яичников на стимуляцию зачастую не приводят к желаемому результату или показывают статистически незначимые улучшения [22–24].
В настоящем исследовании был оценен эффект комбинированного прегравидарного лечения в виде сочетанного назначения мио-инозитола, фолиевой кислоты, витамина D и омега-3 трем женщинам с безрезультатными попытками ЭКО. Эффективность лечения оценивали по морфологическим критериям полученных ооцитов и эмбрионов, а также уровню экспрессии пивиРНК hsa_piR_020497 в ФЖ, уровень которой статистически значимо был выше в группе пациенток с положительным результатом программы ВРТ в сравнении с группой пациенток, у которых беременность не наступила в результате проведения программы ВРТ.
При сравнительном анализе стимулированных циклов у пациенток, включенных в данное исследование, до и после проведения лечения различий в длительности стимуляции, а также суммарной дозе используемых гонадотропинов не было. При сравнительном анализе эмбриологических этапов у пациентки из супружеской пары I было установлено, что после проведенного лечения было получено большее количество ОКК, при этом процент зрелых MII ооцитов также был выше. Соотношение числа зигот на стадии 2PN и количество зрелых ооцитов, равно как и количество и качество полученных эмбрионов, было выше после лечения, что позволило произвести перенос лучшего эмбриона в полость матки с развитием физиологической беременности. Надо отметить, что до лечения все полученные эмбрионы были неудовлетворительного качества.
При анализе двух эмбриологических этапов пациентки из супружеской пары II до и после лечения значимых различий получено не было. При этом цикл ЭКО до лечения закончился наступлением клинической беременности, которая была прервана в связи остановкой в развитии плода на сроке 8 недель с последующей вакуум-аспирацией плода, а в цикле ЭКО после лечения имплантация эмбриона в полость матки не произошла.
У пациентки из супружеской пары III после проведенного лечения было получено большее количество ОКК, процент зрелых ооцитов на стадии MII и количество зигот 2PN также оказались выше. При морфологической оценке полученных эмбрионов было установлено, что количество эмбрионов, пригодных к переносу в полость матки или соответствующих условиям криоконсервации, было выше после проведенного лечения. Однако после переноса двух эмбрионов в полость матки беременность остановилась в развитии на 10-й неделе гестации.
Несмотря на различия в морфологических показателях ооцитов и полученных эмбрионов у трех пациенток после проведенного лечения мио-инозитолом в сочетании с фолиевой кислотой, омега-3 и витамином D, у всех пациенток было выявлено увеличение уровня экспрессии hsa_piR_020497 в ФЖ из одного или двух яичников до значений уровня экспрессии hsa_piR_020497, характерных для группы пациенток с наступившей беременностью. Поскольку белковые продукты генов-мишеней hsa_piR_020497 участвуют в основных сигнальных путях, отвечающих за формирование фолликула и созревание яйцеклетки, можно говорить о наличии эффекта проведенной терапии. Но для понимания причин бесплодия у супружеских пар необходимы дальнейшие исследования на многочисленной выборке с подбором дозировки данных или других препаратов и длительности их применения и оценкой их эффективности по молекулярно-биологическому профилю ФЖ.
Заключение
Данное исследование показывает актуальность проблемы плохого качества ооцитов у молодых пациенток, обратившихся с целью преодоления бесплодия путем проведения программы ЭКО. Низкое качество ооцитов является одним из основных факторов, влияющих на возможность получения эмбриона «хорошего» качества. Прегравидарная подготовка, которая была применена у данных пациенток, оказала положительное влияние на характеристики эмбриологического этапа. В связи с этим необходимо проведение дальнейших поисков препаратов, используемых в качестве предварительного лечения у женщин, проходящих лечение ЭКО/ИКСИ, с целью улучшения репродуктивных исходов.



