Коды по МКБ‑10
- N 87 Дисплазия шейки матки
- N 87.0 Слабовыраженная дисплазия шейки матки N 87.1 Умеренная дисплазия шейки матки
- N 87.2 Резко выраженная дисплазия шейки матки, не классифицированная в других рубриках N 87.9 Дисплазия шейки матки неуточненная
Папилломавирусная инфекция является одной из самых распространенных и социально значимых инфекций, передаваемых половым путем. В связи с ростом заболеваемости, значительной контагиозностью и высоким онкогенным потенциалом данного возбудителя проблема диагностики и лечения заболеваний, вызванных вирусом папилломы человека (ВПЧ), остается актуальной [1].
У большинства инфицированных женщин и мужчин ВПЧ элиминирует спонтанно. Персистирование ВПЧ более 2 лет у женщин может привести к развитию предрака шейки матки, который в отсутствие адекватной терапии может прогрессировать до рака шейки матки (РШМ). Около 90% случаев цервикальной интраэпителиальной неоплазии и 99% случаев РШМ ассоциировано с наличием ВПЧ [2, 3]. При поздней диагностике инвазивный РШМ имеет 100% уровень смертности. Однако предраковые стадии медленно развиваются и поддаются лечению.
Персистирование вируса, приводящее к инициированию канцерогенеза, обусловлено, с одной стороны, онкогенностью ВПЧ и его уклонением от надзора иммунной системы, а с другой стороны – ВПЧ способен вызывать иммуносупрессию.
Таким образом, эффективные терапевтические стратегии на этапе персистенции должны быть направлены на элиминацию ВПЧ и коррекцию ВПЧ‑опосредованной иммуносупрессии.
В 2019 г. было проведено исследование [4], в котором иммунотерапия предраковых кожных образований снизила на 75% риск развития плоскоклеточной карциномы. Было получено первое клиническое подтверждение концепции о том [5], что иммунотерапия предраковых состояний может быть профилактикой развития злокачественных новообразований в будущем. Результаты проделанной работы послужат достоверным обоснованием для рассмотрения предраковых патологических изменений в качестве терапевтических мишеней направленной иммунотерапии.
МКБ-10 – N 87.0 Слабовыраженная дисплазия шейки матки
Цервикальные интраэпителиальные неоплазии (CIN) – это группа заболеваний, характеризующихся нарушением созревания, дифференцировки и стратификации многослойного плоского эпителия.
Согласно последней классификации Всемирной организации здравоохранения (ВОЗ) [6], выделяют:
- плоскоклеточные интраэпителиальные поражения низкой степени – LSIL (low‑grade squamous intraepithelial lesions), которые включают койлоцитоз, CIN I и кондиломы шейки матки;
- плоскоклеточные поражения высокой степени тяжести – HSIL (high‑grade squamous intraepithelial lesions), которые включают CIN II (умеренная дисплазия), CIN III (тяжелая дисплазия и преинвазивный рак (CIS).
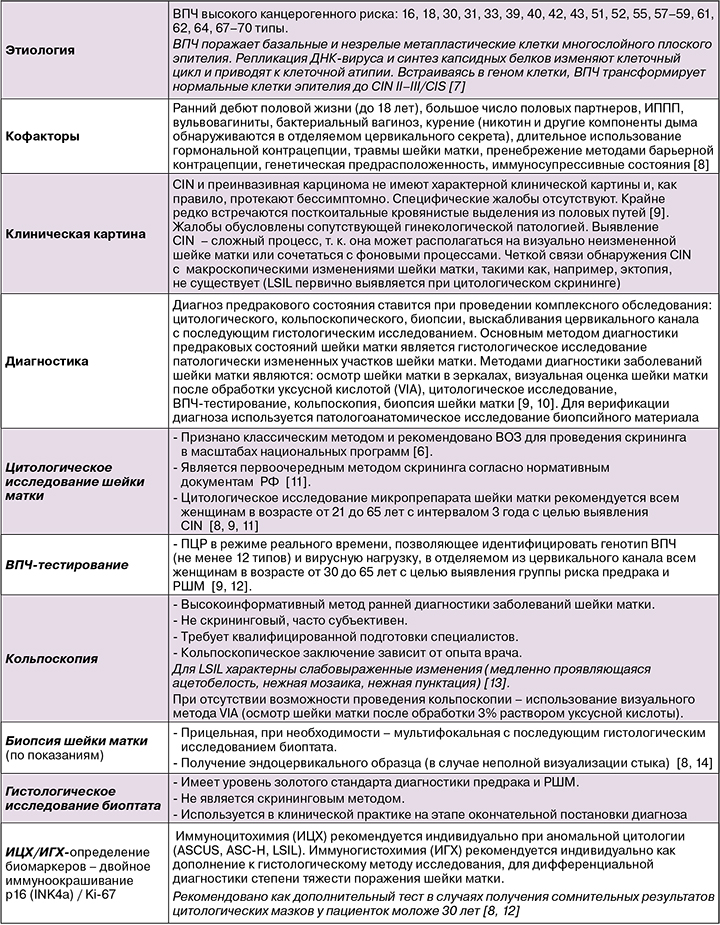
Материал для исследования
- Соскобы с шейки матки для цитологического исследования, определения ДНК‑ВПЧ, иммуноцитохимического исследования [7, 9].
- Биоптат шейки матки с последующим гистологическим исследованием (и иммуногистохимическим исследованием по показаниям).
Ведение женщин с LSIL
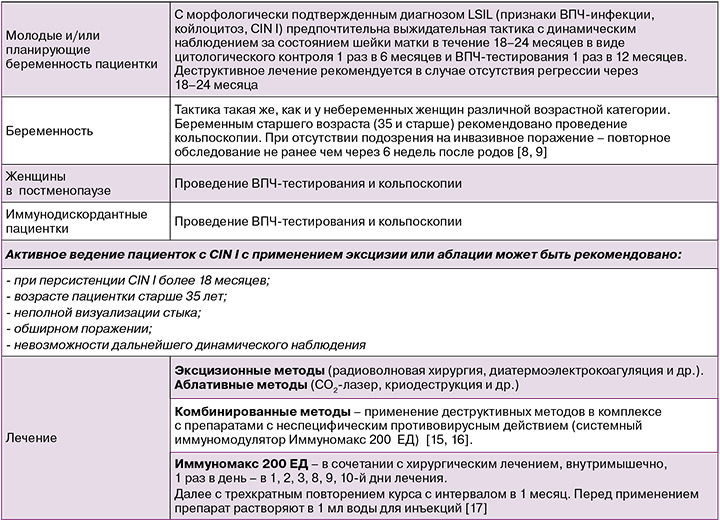
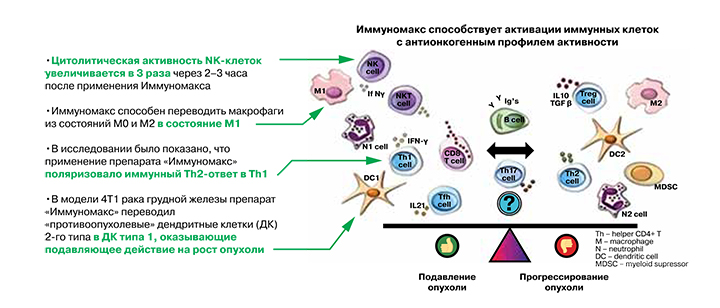
Иммуномакс – кислый пептидогликан растительного происхождения. По механизму действия является агонистом TLR‑3, TLR‑4, TLR‑7, TLR‑8 TLR‑9, RIG‑I (retinoic acid‑inducible gene 1) [18–23]. Попадая в организм человека, Иммуномакс распознается Toll‑подобными рецепторами (TLR) иммуноцитов как патоген‑ассоциированная молекулярная структура (PAMP), что приводит к активации клеточного иммунного ответа против ВПЧ [15].
Согласно зарубежным рекомендациям, наиболее перспективными классами препаратов для лечения папилломавирусной инфекции являются агонисты TLR: TLR‑4‑, TLR‑7‑, TLR‑8‑, TLR‑9‑агонисты [24]. Кроме того, Европейское общество медицинской онкологии (ESMO) в качестве перспективных классов иммунотерапевтических препаратов для лечения онкологических заболеваний препаратов рассматривает TLR3‑, TLR7/8‑, TLR9‑, RIG‑I‑, cGAS‑STING‑агонисты [25, 26]. Роль Иммуномакса в активации генов RIG-I очень важна, поскольку RIG, являясь продуктом гена человека DDX58, участвует в антивирусном ответе системы врожденного иммунитета организма путем распознавания вирусного антигена. RIG-I распознает 5'‑трифосфорилированные одноцепочечные РНК, двухцепочечные РНК и короткие фрагменты двухцепочечных РНК, участвует в запуске антивирусного клеточного ответа. TLR‑9 – внутриклеточный рецептор 9, экспрессируется в эндоплазматическом ретикулуме, эндосомах, мультивезикулярных телах и лизосомах, связывает неметилированные мотивы ДНК CpG, которые распространены в бактериальной и вирусной ДНК.
Анализ доказательной научной базы по клинико‑иммунологической эффективности препарата Иммуномакс позволяет уверенно говорить о его способности комплементарно блокировать элементы рЕ6‑ и рЕ7‑опосредованного канцерогенеза.

Одни и те же иммунные клетки под действием препарата могут проявлять двойственную активность в отношении опухоли: макрофаги типа М1, дендритные клетки 1‑го типа, нейтрофилы N1 оказывают противоопухолевое действие, а макрофаги М2, дендритные клетки 2‑го типа, нейтрофилы N2, наоборот, поддерживают канцерогенез [15]. Иммуномакс способствует активации клеток иммунной системы с антионкогенным профилем активности. Кроме того, Иммуномакс опосредует активацию NK‑клеток до CHAK – высокоцитолитических клеток, способствующих уничтожению опухолевых клеток [27]. Иммуномакс повышает экспрессию хемокина RANTES (CCL‑5), активирующего превращение NK‑клеток в CHAK [28].

Проведение вакцинации против ВПЧ не изменяет принципы скрининговой программы.
Это связано с тем, что доступные вакцины создают протекцию в отношении рака шейки матки, вызван- ного ВПЧ 16 и 18 типов, в то время как существуют и другие онкогенные типы ВПЧ. Более того, многие женщины инфицированы ВПЧ задолго до проведения вакцинации [31].



