Аномалии сократительной деятельности матки, по-прежнему, остаются актуальной и до конца нерешенной проблемой в современном акушерстве. Несмотря на определенные успехи в прогнозировании, профилактике и лечении, аномалии родовой деятельности все еще занимают существенное место в структуре акушерской патологии. Если 10 лет назад эта патология встречалась в 7–10% случаев, то в настоящее время она составляет, по данным разных авторов, от 12,2 до 20% от общего числа родов и не имеет тенден- ции к снижению [2–5].
Анализ литературных данных показал, что единого мнения о возможных механизмах регуляции сократительной деятельности матки нет. Нарушения сократительной активности матки представлены полярными процессами. Первый из них состоит в слишком ранней активации сокращений при преждевременных родах, а иногда и гипертонической активности в ходе срочных родов [5]. Второй – в снижении или отсутствии сократительной активности миометрия при слабости родовой деятельности в ходе срочных родов. Поскольку активация взаимодействия сократительных белков при сокращении миометрия осуществляется ионами кальция, то задача регуляции патологически измененной маточной активности казалось бы сводится к регуляции потоков внутриклеточного Са2+. Однако такой взгляд на регуляцию сократительной активности миометрия является очевидно упрощенным. Дело в том, что чувствительность контрактильных белков к кальцию, способность клеток матки к спонтанной сократительной активности существенно зависят от степени растяжения мышечного волокна [6]. Несмотря на отсутствие четкой организации саркомеров в матке, зависимость «длина-сила», вероятно, играет в миометрии не меньшую роль, чем в поперечно-полосатых мышцах: сердечной и скелетных [7]. Известно, что достижение некоторого внутреннего объема матки, соответствующего определенному растяжению волокон миометрия, существенно увеличивает как спонтанную активность, так и амплитуду сокращений [7]. Другим важным регулятором активности миометрия являются гормональные влияния, воздействие которых снимает «сократительный блок» в конце беременности и обеспечивает переход клеток матки из состояния пассивного растяжения в состояние автоматической сократительной активности [6].
Сложность и актуальность проблемы слабости родовой деятельности (СРД) обусловлена тем, что патология сократительной активности миоцита приводит к необходимости стимуляции родовой деятельности утеротоническими средствами, развитию гипотонических маточных кровотечений, повышению частоты родового травматизма, материнской и перинатальной заболеваемости и смертности [1–4, 11].
Недостаточная изученность патогенетических механизмов развития СРД чрезвычайно затрудняет возможность целенаправленного прогнозирования, а, следовательно, и профилактики этих осложнений родового акта. Настоящая работа посвящена изучению влияния степени растяжения на параметры спонтанной сократительной активности изолированных препаратов миометрия, иссеченных из стенки матки женщин вне родов, в условиях нормальных и патологических родов.
Материали методы исследования
Настоящее сравнительное проспективное когортное исследование по принципу «случай-контроль» проводилось на кафедре акушерства и гинекологии ФПК и ПП ГБОУ ВПО Уральская государственная медицинская академия Минздрава России на базе ФГБУ Уральский научно-исследовательский институт охраны материнства и младенчества Минздрава России и родильного дома городской клинической больницы № 14 (Екатеринбург). В исследование были включены 25 беременных в возрасте 21–30 лет (средний возраст 26,0+1,2 года). Всем женщинам проводили клиническое и лабораторно-инструментальное исследования в соответствии с имеющимися стандартами ведения беременных. Протокол исследования был утвержден локальным этическим комитетом НИИ охраны материнства и младенчества и все пациентки дали информированное согласие на участие в исследовании. Все беременные были родоразрешены путем операции кесарева сечения. В зависимости от времени родоразрешения (плановая либо экстренная операция), акушерской ситуации пациентки были разделены на следующие группы:
1 группа (n=9) – материал для исследования взят во время операции кесарева сечения в экстренном порядке, течение родов – без слабости родовой деятельности (СРД);
2 группа (n=9) – материал для исследования взят во время операции кесарева сечения в экстренном порядке, течение родов – со СРД;
3 группа (n=7) – материал для исследования взят во время плановой операции кесарева сечения.
Физиологическое течение родов и СРД верифицированы на основании клинической оценки характера родовой деятельности, данных наружной гистерограммы, партограммы, динамических физикальных осмотров.
Критерии включения: роженицы в первом периоде родов в сроке доношенной беременности (38–41 нед); первородящие со спонтанной и индуцированной родовой деятельностью; роженицы с физиологическим течением родов и со слабостью родовой деятельности. Показаниями к родоразрешению путем операции кесарева сечения явились: гипоксия плода; узкий таз; макросомия; СРД.
Критерии исключения: многоплодная беременность; тяжелые экстрагенитальные заболевания, осложнения беременности; патология плаценты – предлежание плаценты, преждевременная отслойка плаценты; недоношенная беременность; рубец на матке; инфекционные осложнения в родах (длительный безводный период, хорионамнионит). Для исключения возможного влияния вида обезболивания на сократительную активность препаратов матки были выбраны операции, которые проводили в условиях спинальной анестезии.
Образцы миометрия иссекали во время операции кесарева сечения в области нижнего сегмента матки, в средней трети разреза на матке, из верхнего лоскута, размером 20–30×5–6 мм. В последующем из биоптата выделяли препарат размером 10,0×1,5×1,5 мм. Регистрацию изометрических сокращений препаратов миометрия проводили в горизонтально расположенной ванночке физиологической установки при постоянной перфузии со скоростью потока 3 мл/мин раствором Кребса-Хенслейта (концентрация ионов Са2+ в растворе 2,0 мМ), насыщенным карбогеном (95% О2, 5% СО2) при рН=7,4 и температуре 36 оС. Для получения стабильной спонтанной сократительной активности в омывающий раствор был добавлен окситоцин в минимальной фоновой концентрации (10-9М) [7]. При помощи микроскопа измеряли длину препарата (L0) от завязки до завязки с точностью 0,01 мм. Относительно этой длины рассчитывали амплитуду ступенчатых изменений, которая выражалась в долях от начальной длины и позволяла нормализовать к длине степень растяжения. Измерение силы в изометрическом режиме проводили при помощи датчика C-03 (Россия). Датчик силы позволял регистрировать силу в диапазоне от 0 до 5000 мг и обладал резонансной частотой 700 Гц, сократительную активность оценивали по общепринятой методике как интеграл активности (суммарная площадь под активными маточными сокращениями) за 10 мин регистрации [8, 9]. Этот показатель учитывает как амплитуду, так и частотуспонтанных сокращений и определен как площадь (г×мин) под кривой сокращений. Также отдельно анализировали амплитуду активных сокращений, время достижения пика сокращений, время расслабления, форму сокращения. Измеряли период (с) между спонтанными сокращениями препаратов. После получения устойчивой сократительной активности полосок миометрия в течение 20 мин записывали сокращения и рассчитывали интеграл сократительной активности, который служил показателем фоновой активности. Затем осуществляли ступенчатое растяжение препаратов и вновь записывали сократительную активность по достижении стабильных сокращений на новом уровне.
Послеоперационный период протекал без осложнений у всех пациенток. Все дети родились доношенными, перинатальных потерь не было. У 2 (22%) новорожденных 1 группы и у 5 (55,6%) детей 2 группы наблюдалось нарушение периода адаптации в раннем неонатальном периоде (патологическая убыль массы тела, гипербилирубинемия). Родильницы с новорожденными выписаны домой на 6-е сут после оператив- ного родоразрешения.
Статистический анализ полученных данных и сравнение групп проводили при помощи пакетов Statistica и StatGraph. Вычисляли средние значения числовых показателей со стандартной ошибкой. Уровень значимости был выбран как p<0,05.
Результаты исследования
Влияние длины на частоту спонтанных сокращений На фоне сократительной активности в присутствии окситоцина ступенчатое увеличение длины препаратов миометрия женщин всех групп приводило к существенному уменьшению периода между сокращениями, что соответствовало увеличению частоты спонтанных сокращений. Это увеличение частоты было более выражено в 1 и 2 группах и меньше в 3 группе препаратов. В 1 группе период между спонтанными сокращениями уменьшился в 4,2±0,2 раза, во 2 группе такое уменьшение состави ло 3,5±0,4 (p<0,05). В 3 группе уменьшение периода между сокращениями было менее выражено 2,4±0,2
(p<0,01). Увеличение частоты спонтанной активности не происходило сразу же после растяжения, а требовалось примерно 20 мин для стабилизации частоты сокращений на новой длине.
Влияние длины на амплитуду сокращений
На рис. 1 представлены графики изменения активного (фазического) и тонического напряжений в препаратах миометрия женщин исследуемых групп. В препаратах женщин первой группы растяжение приводило к значительному увеличению фазических сокращений (активной силы), в то время как пассивная сила (включающая как пассивный, так и тонический компонент напряжения) возрастала в меньшей степени. В препаратах 2 группы по мере растяжения амплитуда активной силы увеличивается меньше, чем в препаратах 1 группы, а основной прирост общего напряжения у этих препаратов миометрия достигается за счет увеличения тонического компонента. Изменения сократительной активности при растяжении препаратов 3 группы находились между соответствующими эффектами в препаратах 1 и 2 групп.
Рисунок 1. Изменение фазического и тонического компонентов сократительного ответа препаратов миометрия от растяжения.
Как следствие этого изменение интеграла сократительной активности по мере растяжения хорошо выражено в препаратах 1 группы (рис. 2). В этой группе увеличение интеграла составило 2,0±0,2 раза.
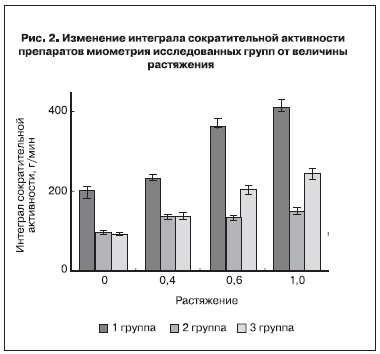
Следует отметить, что исходное значение интеграла сократимости в препаратах 1 группы было наибольшим (205±26 г/мин, p<0,01). Растяжение привело к значительному увеличению интеграла сократитель ной активности в этой группе до 404±29 г/мин. Во 2 и 3 группах исходное значение интеграла было существенно меньше (96±16 г/мин и 92±12 г/мин).
Интеграл сократимости в препаратах 2 группы при растяжении увеличивался меньше (в 1,6±0,1 раза, p<0,05), чем у препаратов 3 группы (2,5±0,3 раза). Конечное значение интеграла в препаратах 3 группы при максимальном растяжении было 246±24 г/мин.
Форма сокращения в препаратах миометрия
На рис. 3 приведена суперпозиция одиночных сокращений препарата миометрия женщин1 и 2 групп. Установлено, что ступенчатое увеличение длины препарата сопровождается значительным приростом амплитуды активных сокращений. В препаратах 2 группы увеличение амплитуды сокращений сопровождалось более выраженным изменением фазы расслабления. Если для миометрия 1 группы типичными (80%) сокращений были фазические сокращения с монофазным расслаблением, то для препаратов 2 группы типичными (75%) были сокращения, в которых фаза расслабления была деформирована и наблюдался своеобразный изгиб, отражающий изменение скорости расслабления. В 3 группе препаратов сокращения в основном были с монофазным расслаблением (80%).
Рисунок 3. Записи изометрических сокращений препаратов миометрия женщин первой (а) и второй (б) групп в режиме суперпозиции. Большие амплитуды соответствуют большей степени растяжения.
Таким образом, препараты от женщин 1 группы демонстрировали наибольшую сократимость и способность к ее увеличению при растяжении. Миометрий от женщин со слабостью родовой деятельности обладал наименьшей сократимостью и чувствительностью к растяжению. Препараты миометрия женщин вне родовой активности занимали промежуточное положение между препаратами этих двух групп.
Обсуждение
Во время беременности гладкомышечные клетки матки претерпевают значительные адаптационные изменения. Растяжение стенок матки, вызванное растущими плодом и плацентой, преобразуется в стремительное увеличение количества и объема клеточных элементов стенки матки, что в свою очередь уменьшает степень ее механического напряжения и не позволяет возникнуть перерастяжению стенки. Тем не менее степень растяжения стенки матки все же достаточна, чтобы экспрессировать гены, ответственные за синтез элементов, участвующих в инициации сократительной активности матки при родах (межклеточные контакты, рецепторы окситоцина и простагландинов) [15, 18]. Однако гормональный фон середины беременности, характеризующийся высокой концентрацией прогестерона, не позволяет этим элементам перейти в активное состояние, что обеспечивает спокойное растяжение стенки матки [8, 17]. Изменение гормонального фона накануне беременности (увеличение концентрации циркулирующих эстрогенов) влияет на ионную проницаемость нексусов миоцитов и позволяет отдельным клеткам миометрия синхронизировать свою электрическую активность, а, следовательно, и сокращения [16].
Недавние исследования показали, что в миометрии имеются аналоги механо-рецепторов кальциевых каналов – так называемые TRPC белки [14, 15]. Детальное исследование TRPC белков, показало, что они представлены несколькими изоформами, получившими порядковые номера от 1 до 6. Для экспрессии синтеза каждой из таких изоформ необходимо минимальное время постоянного механического растяжения клеток миометрия. Исследования позволили идентифицировать ряд белков и генов, связанных с механо-индукцией и механо-регуляцией сокращений гладких мышечных клеток миометрия [12, 18]. Было показано, что длительное тоническое растяжение миоцитов матки увеличивает поток ионов Са2+ через сарколемму (как через кальциевые каналы, так и посредством обменных механизмов), а также освобож дение Са2+ из внутриклеточных источников [13–15]. Более того, процессы внутриклеточного освобождения Са2+ хорошо скоординированы с механизмами секвестрации Са2+ из миоплазмы в саркоплазматический ретикулум, что выражается в быстром и эффективном расслаблении. Таким образом, изменения скорости расслабления или появление двухфазного расслабления могут свидетельствовать о замедлении процессов удаления кальция из миоплазмы. Мы наблюдали подобную форму расслабления примерно в 80% препаратов миометрия женщин 2 группы со слабостью родовой деятельности. Выраженность этого дефекта расслабления увеличивалась пропорционально степени растяжения препаратов, демонстрируя дискоординацию между процессами притока Са2+ к сократительным белкам и выведения этих ионов из области контрактильных элементов при расслаблении.
Эффективная сократительная деятельность матки предполагает не только быстрое нарастание напряжения, но и быстрое снижение его в фазу расслабления, что необходимо для восстановления маточно-плацентарного кровообращения и питания самой матки после схватки.
Полученные нами данные свидетельствуют о существенном влиянии степени растяжения препаратов миометрия на частоту и амплитуду сокращений. Особенно выраженным это влияние было в 1 группе препаратов, представленных миометрием от женщин в родах. Действительно, миометрий женщин этой группы находится в условиях полной гормональной стимуляции сократительной активности и работает в перфузионном растворе, содержащем окситоцин. Однако только изменение длины (растяжение) является тем триггером, который максимально стимулирует частоту, амплитуду сокращений и обеспечивает значительный прирост интеграла сократимости. Таким образом, только механо-чувствительные механизмы могут быть ответственны за подобную стиму-
ляцию сокращений. Более того, время активации и стабилизации сократительной активности после каж- дого растяжения (20 мин) указывает на то, что таким механо-чувствительным механизмом могут быть TRPC1 «стретч»-активируемые кальциевые каналы.
Исходя из данных литературы и наших наблюдений, можно предположить, что существует ряд механо-зависимых «включателей», модулирующих потоки Са2+ через мембрану и освобождение этих ионов из внутриклеточных пулов. Эти «включатели» обладают различными временами активации от нескольких минут до десятка часов. Все это необходимо для постепенной подготовки миометрия к интенсивной и скоординированной работе матки во время родов. Более того, эта работа начинает ся задолго до формального начала родов и первые признаки проявления ее можно наблюдать в ходе активации «тренировочных» схваток или сокращений Брэкстона-Хикса в 34–35 нед. На высоте таких схваток механическое напряжение матки существенно увеличивается, что в свою очередь постепен но включает краткосрочные механизмы подготовки матки к родам. В момент рождения ребенка все регуляторные механизмы, обеспечивающие стимуляцию сократительной активности матки (вклю чая гормональные) и долгосрочные механические механизмы активированы. Очевидно, что только краткосрочный механизм, имеющий время активации/инактивации минуты или десятки минут может достаточно быстро «выключить» интенсивные фазические родовые схватки. На эту роль вполне подходит механо-чувствительный протеин кальциевых каналов TRPC1. При этом более долгосрочный, такой как TRPC3, имеющий время активации/инактивации 14 ч и обеспечивающий поступление Са2+ в ходе длительного тонического сокращения, остается активированным. Время его инактивации обеспечивает поддержание тонуса матки в течение раннего послеродового периода и предохраняет матку от атонического кровотечения.
Миометрий способен развивать как фазические, так и тонические сокращения [10]. Обычно тоническое сокращение матки в родах является ненормальным состоянием и может быть вызвано или серией частых фазических сокращений, либо нарушением фазы расслабления [5]. Очевидно, что тоническое сокращение может существенно менять кровоток как в матке, так и в межворсинчатом пространстве, что способно привести к гипоксии плода. Однако после рождения ребенка, когда нужда в фазических сокращениях (схватках) исчезает, перед маткой возникает вторая важная задача – обеспечить эффективное пережатие сосудов, подводящих кровь с маточной стороны к плацентарной площадке и остановить физиологическое акушерское кровотечение. В течение этого времени происходит формирование тромбов в поврежденных сосудах. В этот момент преимущественным видом сократительной активности матки должно стать тоническое сокращение. Не случайно в течение первых суток внутренний объем матки за счет лохий поддерживается еще на достаточно высоком уровне. Благодаря этому не происходит инактивации долгосрочных TRPC рецепторов. В наших экспериментах в 1 группе препаратов от женщин с активной родовой деятельностью соотношение между активным (фазическим) компонентом и тоническим компонентом сократительной активности было в пользу активного компонента. В препаратах 2 группы увеличение степени растяжения вело к преимущественному приросту тонического компонента, что говорит о том, что у женщин со слабостью родовой деятельности механизмы, управляющие фазическими сокращениями, по-видимому, выключены или значительно инактивированы.
Заключение
Полученные нами данные позволяют лучше понять патогенез слабости родовой деятельности на фоне преждевременного излития околоплодных вод. В этом случае внутренний объем матки уменьшается, что может способствовать преждевременному «выключению» краткосрочных механизмов транспорта Са2+ в клетки миометрия. Представляется, что в случае искусственного увеличения внутреннего объема матки (например с помощью инфузии физиологического раствора) теоретически может восстановить сократительную активность без дополнительной стимуляции (окситоцином). Еще одним важным выводом этой работы может быть предположение о важности изучения сократительной активности матки не только во время родов, но и в послеродовом периоде, что также может дать ценную информацию о механизмах нарушения сократительной активности миометрия в родах.



