В современном мире женское и мужское бесплодие остается одной из важных и нерешенных проблем. В России частота бесплодия колеблется от 17,2 до 24,0% в зависимости от регионов [1]. Нарушение имплантации эмбриона в эндометрий –одна из возможных причин снижения результативности программ вспомогательных репродуктивных технологий (ВРТ). Известно, что для успешного наступления беременности необходимо одновременное присутствие двух факторов: морфологически и генетически полноценного эмбриона и эндометрия с высоким имплантационным потенциалом [2]. По статистике 1/3 неудачных протоколов напрямую коррелирует с качеством эмбрионов, в то время как 2/3 приходится на состояние эндометрия [3]. Как известно, основными регуляторами морфологических и функциональных изменений в эндометрии в течение менструального цикла являются гормоны: эстрогены и прогестерон. Половые стероиды оказывают свое воздействие путем связывания специфических рецепторов на поверхности функционального слоя, что способствует изменению свойств эндометрия [4].
Одной из основных причин нарушения механизмов имплантации является смещение «имплантационного окна» во времени, когда эндометрий максимально восприимчив (рецептивен) и готов к имплантации [5]. Восприимчивость и селективность эндометрия – два взаимодополняющих понятия, которые используются для описания эндометрия. Селективность является внутренней запрограммированной функцией эндометрия по распознаванию и отторжению эмбрионов с пониженным потенциалом развития [6]. Напротив, рецептивность эндометрия – это совокупность структурно-функциональных характеристик слизистой оболочки тела матки, обеспечивающих оптимальные условия для имплантации бластоцисты. У большинства женщин «имплантационное окно» охватывает 7–10-й день после пика лютеинизирующего гормона в секреторную фазу менструального цикла [7]. В последние годы активно обсуждается, что наилучшая рецептивность эндометрия может быть достигнута при переносе размороженного эмбриона по сравнению со стимулированным циклом [8]. Сегментация цикла позволяет проводить профилактику синдрома гиперстимуляции яичников и переносить эмбрионы в более физиологичную внутриматочную среду, без возможного отрицательного влияния гормональной стимуляции на рецептивность эндометрия. Существуют различные протоколы подготовки эндометрия к переносу эмбрионов, в том числе криоперенос в естественном цикле (ЕЦ) и на фоне циклической гормональной терапии (ЦГТ). Выбор протокола происходит по результатам клинико-анамнестических характеристик пациенток, гормонального профиля и ультразвукового исследования. На сегодняшний день во многих исследованиях обсуждается отсутствие различий в эффективности между протоколами подготовки эндометрия [9, 10].
В связи с этим целью данного исследования явился сравнительный анализ клинико-анамнестических характеристик у пациенток при переносе размороженных эмбрионов в ЕЦ и на фоне ЦГТ, а также оценка эффективности проведенных программ.
Материалы и методы
Были проанализированы и сопоставлены клинические данные 102 супружеских пар, обратившихся в отделение вспомогательных репродуктивных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Министерства здравоохранения Российской Федерации.
Всем пациентам было проведено полное клинико-лабораторное обследование в соответствии с Приказом Минздрава России от 31.07.2020 № 803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Всем пациенткам перед вступлением в программу ЭКО проводилась оценка уровня гормонального статуса: фолликулостимулирующий гормон (ФСГ), антимюллеров гормон (АМГ), лютеинизирующий гормон (ЛГ), уровень прогестерона в лютеиновую фазу менструального цикла, эстрадиол, тестостерон (Т), тиреотропный гормон (ТТГ), тироксин (Т4), дегидроэпиандростеронсульфат (ДГЭА-С), 17-гидроксипрогестерон (17-ОН), кортизол, пролактин (ПРЛ), а также ультразвуковое исследование (УЗИ) органов малого таза для подсчета количества антральных фолликулов (КАФ) на 2–3-й день менструального цикла. Пациенты, включенные в исследование, подписали добровольное информированное согласие для проведения программы ЭКО.
Протокол овариальной стимуляции
Ретроспективно были проанализированы протоколы овариальной стимуляции, в которых осуществлялась витрификация эмбрионов для последующего переноса в данном исследовании.
На 2–3-й день менструального цикла была начата стимуляция функции яичников по стандартному протоколу с антагонистом гонадотропин-рилизинг-гормона и менопаузального гонадотропина человека. При диаметре фолликулов 14–15 мм назначался препарат антагониста гонадотропин-рилизинг-гормона в дозе 0,25 мг/сут для предотвращения пика ЛГ. Для финального созревания ооцитов в качестве триггера овуляции при достижении фолликулами диаметра 18–19 мм назначался человеческий хорионический гонадотропин в дозе 10 000 МЕ. Через 36 ч после введения триггера овуляции были выполнены трансвагинальная пункция фолликулов (ТВП) с забором фолликулярной жидкости и оценка качества ооцитов. Параметры спермограммы оценивали в ходе предварительного обследования перед вступлением в программу ЭКО и в день проведения ТВП. Отбор сперматозоидов для интрацитоплазматической инъекции сперматозоида (ИКСИ) производился по морфологическим параметрам (стандартное ИКСИ). После проведения оплодотворения методом ИКСИ ооциты переносили в культуральную среду с целью дальнейшего культивирования. Через 14–16 ч после оплодотворения была произведена оценка формирования пронуклеусов. После оплодотворения на 3-и и 5-е сутки оценивали качество эмбрионов по классификации, принятой Стамбульским консенсусом. Перенос эмбрионов в матку с лучшей морфологической характеристикой осуществлялся под ультразвуковым контролем. Поддержка лютеиновой фазы и посттрансферного периода была произведена препаратами прогестерона. Оставшиеся после программы ЭКО/ЭКО+ИКСИ эмбрионы, пригодные для переноса в полость матки, были криоконсервированы.
После получения положительных, а также отрицательных результатов при проведении стимуляции данные супружеские пары обратились с целью переноса криоконсервированных эмбрионов.
При проведении переноса размороженных эмбрионов пациентки были разделены на 2 группы в зависимости от метода подготовки эндометрия: I группа – 42 пациентки в ЕЦ; II группа – 60 пациенток на фоне ЦГТ. Алгоритм выбора протокола подготовки эндометрия осуществлялся по следующим принципам. Перенос размороженного эмбриона в ЕЦ: регулярный менструальный цикл, овуляторный цикл, толщина эндометрия ≥8 мм в 1-ю или 2-ю фазу менструального цикла; в ЦГТ: нерегулярный менструальный цикл, стойкая ановуляция, толщина эндометрия ≤8 мм в 1-ю или 2-ю фазу цикла.
Протокол подготовки эндометрия к переносу размороженного эмбриона в ЕЦ
В группе пациенток в ЕЦ проводился ультразвуковой мониторинг роста доминантного фолликула и овуляции, после которой был назначен микронизированный прогестерон в дозировке 200 мг/сут с целью поддержания лютеиновой фазы менструального цикла и посттрансферного периода. День переноса соответствовал дню спонтанной овуляции + число дней культивирования эмбрионов.
Протокол подготовки эндометрия к переносу размороженного эмбриона на фоне ЦГТ
В циклах ЦГТ после ультразвуковой диагностики со 2–4-го дня менструального цикла был назначен препарат эстрадиола валерат в начальной дозировке 2 мг с постепенным увеличением согласно индивидуальным параметрам пациенток, а при достижении нормальной толщины и структуры эндометрия (>7 мм) на 14–15-й день менструального цикла осуществлялось введение гестагенов (микронизированного прогестерона 200 мг/сут или дидрогестерона в дозировке 10 мг/сут) также с постепенным увеличением согласно индивидуальным параметрам пациенток.
При благоприятных условиях у пациенток после получения информированного добровольного согласия осуществлялся перенос эмбрионов с помощью одноразовых гибких катетеров. Диагностика наступления беременности производилась путем определения положительного результата β-хорионического гонадотропина человека через 14 дней после переноса. Клиническая беременность наблюдалась на 21-й день после переноса эмбрионов при визуализации плодного яйца в полости матки.
Статистический анализ
Статистическая обработка данных выполнялась с помощью таблиц Microsoft Excel и программы RStudio. В связи с распределением признаков, отличающимся от нормального, их описывали в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3). Для количественных признаков сравнение несвязанных групп проводилось с использованием теста Манна–Уитни. Для сравнения категориальных данных статистический анализ проводили с помощью критерия χ2. Для анализа зависимости количественных признаков применяли ранговый коэффициент корреляции Спирмена. Статистически значимыми считались различия при p<0,05.
Результаты
На первом этапе нашего исследования для пациенток, вступивших в программу переноса криоконсервированных эмбрионов в ЕЦ и на фоне ЦГТ, был проведен клинико-анамнестический ретроспективный анализ данных, полученных, в том числе, в программе стимуляции овуляции (табл. 1). При анализе возрастных характеристик супружеских пар статистически значимых различий не было выявлено. Средний возраст женщин в группе ЕЦ составил 33 (23–42) года, а в группе ЦГТ – 34 (26–42) года. Средний возраст мужчин в группе ЕЦ –35 (26–54) лет, в группе ЦГТ – 37 (25–55) лет. В ходе сравнительного анализа двух групп не было выявлено статистически значимых различий по количеству ооцит-кумулюсных комплексов, полученных в день ТВП, числу зрелых ооцитов (МII), а также числу оплодотворенных ооцитов (зигот 2PN2PB). Анализ эякулята в день ТВП показал, что обе группы статистически значимо не отличались по параметрам спермограммы.
Параметры гормонального статуса пациенток до вступления в программу ЭКО соответствовали референсным значениям (табл. 2). Стоит отметить, что у пациенток в группе ЕЦ средний уровень прогестерона составил 38,9 нмоль/л, тогда как в группе ЦГТ – 33,5 нмоль/л (р=0,02). Сниженный средний уровень секреции прогестерона в группе ЦГТ может быть связан с недостаточностью лютеиновой фазы, которая поддерживалась гормональными препаратами, в отличие от ЕЦ, где у пациентов определялись самостоятельная овуляция и собственное желтое тело.
Нами была проанализирована частота наступления беременности (ЧНБ) у пациенток в протоколе стимуляции овуляции яичников. Среди пациенток группы ЕЦ (n=42) беременность наступила у 11/42 (ЧНБ=26,19%), среди пациенток группы ЦГТ (n=60) беременность наступила у 17/60 пациенток (ЧНБ=28,33%).
При последующем анализе групп пациенток в рамках проведения программы переноса криоконсервированных эмбрионов (табл. 3) были выявлены статистически значимые отличия групп ЕЦ и ЦГТ по толщине эндометрия в день переноса эмбрионов (р<0,001). По таким параметрам, как день менструального цикла в день переноса эмбрионов в полость матки, их количество, а также общее число эмбрионов, полученных в ходе стимуляции овуляции, статистически значимых различий групп ЕЦ и ЦГТ не было выявлено.
Нами была проанализирована ЧНБ у пациенток в криопротоколе. Среди пациенток группы ЕЦ (n=42) беременность наступила у 19/42 (ЧНБ = 40,48%), среди пациенток группы ЦГТ (n=60) – у 24/60 пациенток (ЧНБ=41,67%).
В программе переноса криоконсервированных эмбрионов на фоне ЦГТ был проведен корреляционный анализ количественных переменных с учетом статистической значимости каждой из них (табл. 4). Было выявлено, что толщина эндометрия в день переноса эмбрионов прямо коррелировала с уровнем прогестерона (р=0,004). Обнаружена статистически значимая отрицательная направленность корреляционных связей между возрастом пациенток и количеством зрелых ооцитов МII, количеством зигот 2PN2PB, уровнями АМГ и прогестерона, а также положительная корреляция между возрастом пациенток и количеством попыток ЭКО в анамнезе. Выявлена статистически значимая отрицательная направленность корреляционных связей между уровнем ФСГ и количеством зрелых ооцитов МII, числом 2PN2PB, числом полученных криоконсервированных эмбрионов, а также уровнем АМГ.
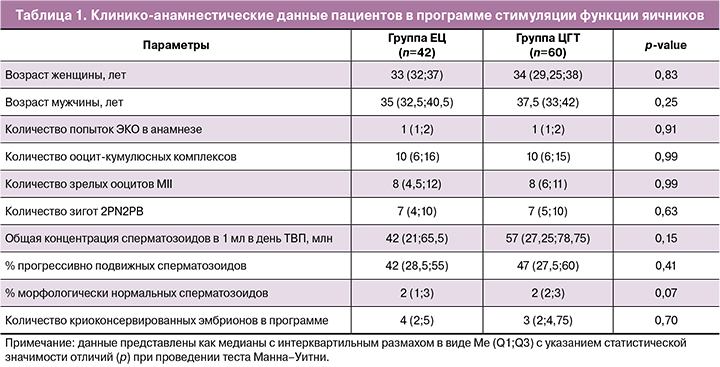
В ходе сравнения групп пациенток с наступлением беременности и женщин, у которых беременность не наступила, были найдены статистически значимые отличия: по уровню прогестерона (p<0,001), уровню тестостерона (p=0,02) и толщине эндометрия в день переноса эмбрионов (p<0,001). Значения медиан, а также 1-го и 3-го квартилей числовых значений исследуемых параметров представлены во вставке на рисунке 1. При этом у пациенток с положительным результатом наблюдались более высокие значения базового уровня прогестерона и толщины эндометрия, но сниженный уровень тестостерона относительно пациенток с отрицательным исходом программы криопереноса, о чем свидетельствуют данные, представленные на рисунке 1.
При проведении программы переноса криоконсервированных эмбрионов в ЕЦ для количественных клинико-анамнестических данных были получены коэффициенты корреляций и оценена статистическая значимость каждого из них (табл. 5). Возраст женщин, вступивших в программу криопереноса эмбрионов, имел статистически значимую положительную направленность с уровнем ФСГ, количеством попыток ЭКО в анамнезе, количеством зрелых ооцитов MII. Уровень АМГ имел статистически значимую прямую направленность с количеством полученных ооцит-кумулюсных комплексов, количеством зигот 2PN2PB, количеством криоконсервированных эмбрионов. Также выявлена прямая корреляционная связь дня начала подготовки эндометрия с выбором оптимального дня для переноса размороженного эмбриона (р=0,007).
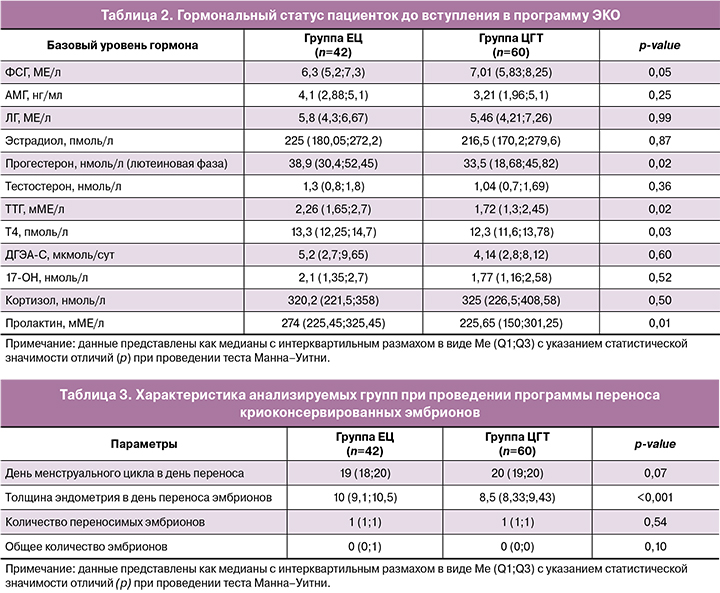
В группе ЕЦ были установлены статистически значимые отличия по уровню прогестерона между пациентками с наступившей беременностью и отрицательным результатом программы криопереноса (p<0,001). Значения медиан, а также 1-го и 3-го квартилей числовых значений исследуемых параметров представлены во вставке на рисунке 2. При этом у пациенток с положительным результатом наблюдались более высокие цифры базового уровня прогестерона относительно пациенток с отрицательным исходом программы криопереноса, о чем свидетельствуют данные, представленные на рисунке 2.
Обсуждение
Условием для наступления беременности является нормальное развитие эндометрия в фолликулярную и лютеиновую фазы менструального цикла под действием эстрогенов и прогестерона, а также синхронизации между бластоцистой хорошего качества и эпителием эндометрия нормальной толщины.
В нашем исследовании в группе ЕЦ и ЦГТ были установлены статистически значимые отличия по уровню прогестерона между пациентками с наступившей беременностью и отрицательным результатом (p<0,001). При этом в крупном ретроспективном исследовании Volovsky M. et al. [11] были проанализированы 2010 циклов с переносом размороженного эмбриона, в которых не было статистически значимых различий в частоте наступления беременности (20,82 против 40,98%; р=0,30) и рождаемости в целом (14,25 и 16,21%; р=0,23) у пациенток с пороговым уровнем прогестерона <10 нг/мл и >10 нг/мл, а также при уровне прогестерона 20 нг/мл. Напротив, в работе Labarta E. et al. [12] показано, что при уровне прогестерона <9,2 нг/мл в день переноса эмбрионов значительно снижена частота наступления беременности по сравнению с пациентками, у которых уровень прогестерона составил 9,2–11,7 нг/мл, 11,8–15,7 нг/мл: 32,7% против 52,8%; р=0,016; ОР (95% ДИ): 0,62 (0,41–0,94). В исследовании Tihomirova T. et al. [13] также показано, что низкий уровень прогестерона связан с отсутствием наступления беременности по сравнению с женщинами, у которых пороговый уровень прогестерона был выше 20,08 нг/мл±9,44 и 27,9 нг/мл±10,52 соответственно (p<0,034). Стоит отметить, что низкие уровни прогестерона, возможно, ассоциированы с более низкой частотой наступления беременности и живорождением в целом. Поэтому уровень прогестерона, измеренный в день переноса эмбрионов, может быть использован в качестве прогнозирования успеха в программах ВРТ.
В проведенном нами исследовании в группе ЦГТ выявлены статистически значимые отличия пациенток с наступившей беременностью по сравнению с пациентками, у которых беременность не наступила, по уровню тестостерона (p=0,02). Влияние уровня тестостерона на беременность показано в работе Mokhtar M. et al. [14]. Авторы продемонстрировали, что при введении экзогенного тестостерона в дозе 500 мкг/кг/сут в течение 3 дней происходит достаточное снижение экспрессии MECA-79 и пиноподий, которые присутствуют в период окна имплантации и ассоциированы с наибольшей концентрацией белковых маркеров рецептивности. Кроме того, Huang L. et al. [15] в своем исследовании доказали, что базовый уровень тестостерона <0,305 нг/мл оказывает неблагоприятное влияние на исходы беременности после ЭКО. Более того, при составлении индивидуального протокола стимуляции измерение уровня тестостерона также может стать полезным. Следовательно, колебания уровня тестостерона в сторону больших или меньших значений могут негативно влиять на рецептивность эндометрия и на имплантацию эмбрионов в целом.
В нашей работе были выявлены корреляционные связи в группе ЦГТ: возраст пациенток обратно коррелировал с уровнем АМГ (p=0,007; r=-0,36), количеством зрелых ооцитов МII (p=0,002; r=-0,4), количеством зигот 2PN2PB (p=0,008; r=-0,36), при этом прямо пропорционально коррелировал с количеством попыток ЭКО в анамнезе (p=0,001; r=0,43). Уровень ФСГ обратно коррелировал с уровнем АМГ (p=0,0002; r=-0,48), количеством зрелых ооцитов МII (p=0,0217; r=-0,31), количеством зигот 2PN2PB (p=0,05; r =-0,26), а также с числом полученных криоконсервированных эмбрионов (p=0,002; r=-0,4). Аналогично в группе ЕЦ: возраст женщин положительно коррелировал с уровнем ФСГ (p=0,002; r=0,47), количеством попыток ЭКО (p= 0,004; r=0,45), количеством зрелых ооцитов MII (p=0,003; r=0,45). Уровень АМГ напрямую коррелировал с количеством полученных ооцит-кумулюсных комплексов (p=0,01; r=0,41), количеством зигот 2PN2PB (p=0,002; r=0,36), количеством криоконсервированных эмбрионов (p=0,03; r=0,34). Уровни АМГ и ФСГ, а также возраст пациентов являются основными предикторами овариального резерва. В работе Scheffer J.A.B. et al. [16] были обнаружены значимые корреляции между уровнем АМГ и возрастом пациенток (r=-0,34; p<0,01), уровнем ФСГ в крови (r=-0,32; p<0,01), КАФ (r=0,81; p<0,00001), а также ЧНБ (p<0,05). Возраст пациенток коррелировал с ФСГ (r=0,46; p<0,01), КАФ (r=-0,34; p<0,00001) и ЧНБ (p<0,04). Аналогичные данные были представлены в исследовании Zhu J. et al. [17], где уровень АМГ отрицательно коррелировал с возрастом пациенток (r=-0,606; p<0,001), тем самым снижая качество полученных клеток и результативность программ ВРТ.
В связи с этим крайне важно проводить тщательное гормональное обследование пациентов перед вступлением в программу ЭКО. Несмотря на то что базовый уровень гормонов у всех пациентов перед вступлением в программу ЭКО в нашем исследовании находился в пределах референсных значений, было выявлено их влияние на параметры и результативность программ ВРТ.
Кроме того, в настоящем исследовании в группе ЦГТ были обнаружены статистически значимые отличия пациенток с наступившей беременностью от таковых с отрицательным результатом протокола по толщине эндометрия в день переноса эмбрионов (p<0,001). В 2021 г. Shalom-Paz E. et al. [18] провели крупное исследование, в котором в группе А были представлены пациенты с толщиной эндометрия ≤8 мм, в группе В – >8 мм. По сравнению с группой А в группе В были значительно более высокие показатели биохимической и клинической беременности (30,3 против 24,6%; р=0,046 и 24,0 против 18,6%; р=0,036 соответственно). Авторами было показано, что толщина эндометрия – единственный параметр, влияющий на вероятность наступления беременности с ОШ 1,54 (95% ДИ 1,07–2,22; p=0,019). Аналогичные данные были представлены в анализе Bu Z. et al. [19] при сравнении пациентов с толщиной эндометрия >7 мм и «тонким» эндометрием. По данным УЗИ частота клинической беременности была (56,21% против 47,13%; P=0,00 на фоне ЦГТ; 55,15% против 49,55%; P=0,00 в ЕЦ). Эти данные подчеркивают важность оценки толщины эндометрия в выборе криопротокола: в ЕЦ или на фоне ЦГТ.
Заключение
В нашем исследовании было выявлено, что группы ЕЦ и ЦГТ статистически значимо не отличались по частоте наступления беременности при переносе размороженного эмбриона. Кроме того, высокий исходный уровень прогестерона перед программой ЭКО ассоциирован с наступлением беременности как в ЕЦ, так и на фоне ЦГТ, что говорит о его возможном влиянии на результативность программ ВРТ и требует дальнейших исследований. Поэтому индивидуализация подхода в поддержке лютеиновой фазы в соответствии с уровнем сывороточного прогестерона при переносе размороженного эмбриона как в ЕЦ, так и на фоне ЦГТ может играть важную роль в повышении эффективности программ ВРТ.



