Образования яичников (ОЯ) – многочисленная, крайне гетерогенная группа, при этом около 2% из них представляют собой злокачественные или пограничные опухоли [1–3]. Рак яичников (РЯ) занимает седьмое место по распространенности среди онкологических заболеваний у женщин во всем мире и третье место после рака тела и шейки матки среди гинекологических злокачественных новообразований, с частотой 10–15 случаев на 100 000 женщин в мире [1]. При этом РЯ является лидирующим в структуре смертности от онкогинекологических заболеваний. Ежегодно во всем мире у 240 000 женщин диагностируется РЯ [2], а выживаемость составляет не более пяти лет у 45% пациенток [2].
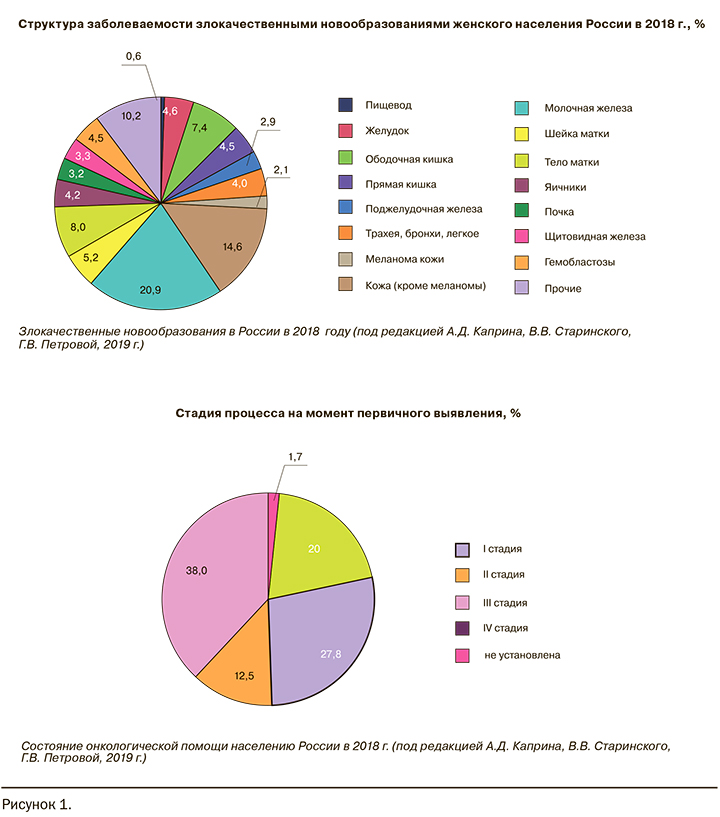
Среди женского населения России на 2018 г. РЯ составляет 4,2% случаев – 76,2 случаев на 100 000 женского населения. При этом летальность на первом году с момента установления диагноза составляла 26,2% на 2008 г. и 21,3% на 2018 г., причина которой – позднее обращение пациенток к специалисту (38% на III стадии заболевания) (рис. 1) [4, 5].
В последние десятилетия много усилий вложено в повышение качества предоперационной диагностики ОЯ путем разработки моделей стратификации рисков злокачественности и систем оценки полученных данных при помощи различных методов исследования и их сочетания, поскольку тактика дальнейшего ведения пациенток имеет принципиальные отличия [6].
В клинической практике существенную долю ОЯ (до 25% по различным данным) после ультразвукового исследования не удается полностью охарактеризовать [7]. Так, при использовании критериев Международной группы по анализу опухолей яичников (IOTA), до 22% ОЯ остаются неопределенными по степени злокачественности при ультразвуковом исследовании [6]. Большинство из них оказываются доброкачественными/опухолевидными: геморрагические и эндометриоидные кисты, цистаденомы, зрелые тератомы, лейомиомы матки и фибромы/текомы яичников [8].
На сегодняшний день магнитно-резонансная томография (МРТ) является золотым стандартом в уточняющей дифференциальной диагностике ОЯ [9]. МРТ позволяет точно охарактеризовать ОЯ и дифференцировать доброкачественные от злокачественных с высокой специфичностью. При этом диагностическая точность дифференциальной диагностики ОЯ при МРТ колеблется от 83% до 98% в зависимости от протокола исследования и алгоритма анализа полученных данных [10].
Показания к МРТ (ESUR, 2017 г. [6])
1. Образования сложной структуры с неопределенной степенью злокачественности по данным УЗИ.
Крупное образование в полости малого таза без четкой органопринадлежности.
2. Образование, прилегающее к матке, с неоднозначной органопринадлежностью.
3. Солидные ОЯ неоднородной структуры с полиморфным кровотоком по УЗИ.
Рекомендации по подготовке к исследованию (при выполнении МРТ в плановом порядке)
За 1–2 дня до исследования – легкая диета с исключением продуктов, усиливающих перистальтику кишечника и газообразование.
2–3 часа голодания до исследования.
За 15 минут до исследования – спазмолитические препараты (перорально) или непосредственно перед исследованием (внутримышечно).
Умеренное наполнение мочевого пузыря.
Протокол МР-исследования малого таза при ОЯ
Для первичной оценки анатомии органов малого таза выполняют Т2-взвешенные последовательности (В.П.) без подавления сигнала от жира:
- в сагиттальной плоскости между головками бедренных костей;
- в аксиальной плоскости от ворот почек до лобкового симфиза;
- в корональной плоскости (и/или с использованием подавления сигнала от жировой ткани (FS) в третьей плоскости);
- для оценки наличия крови/жирового компонента опухоли – Т1-В.П., а также с использованием подавления сигнала от жировой ткани (FS) в третьей плоскости.
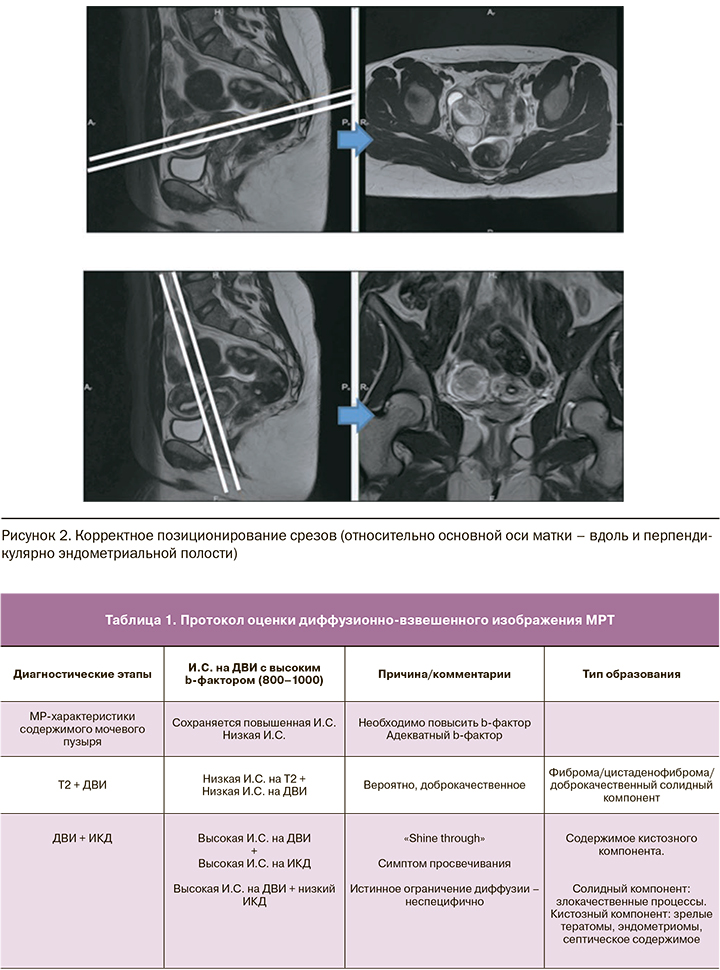
Принципиальным при исследовании таза является корректное позиционирование срезов (относительно основной оси матки – вдоль и перпендикулярно эндометриальной полости, рис. 2).
Диффузионно-взвешенные последовательности (ДВП)
В настоящее время в исследованиях убедительно показано, что ДВП играют важную роль в МР-визуализации ОЯ [11–14]. Для получения точных результатов необходимо достижение оптимального значения b-фактора с целью подавления высокой базовой интенсивности сигнала (И.С.) от свободной диффузии молекул воды, при этом сохраняя достаточное отношение сигнал/шум.
При исследовании таза для контроля b-фактора целесообразно использовать содержимое мочевого пузыря, поскольку оно имеет высокую И.С. при b=0 и уменьшается при увеличении b-фактора. Когда И.С. от мочевого пузыря полностью подавлена, достигается оптимальное значение b-фактора для анализа. Оптимальное значение b-фактора обычно составляет 800–1000 с/мм2, но иногда может быть увеличено до 1200 или 1400 с/мм2 [15].
Стоит отметить, что ДВИ не рекомендуется применять при диагностике зрелых тератом яичников и эндометриом (табл. 1). На практике подавляющее большинство из них имеют достоверные дифференциально-диагностические признаки на базовых T2-В.И. в сочетании с Т1-В.И. и Т1FS-В.И. (см. раздел «Алгоритм анализа МР-изображений») [7].
При этом ДВИ имеет высокую диагностическую ценность при оценке ОЯ без дермоидного/геморрагического содержимого, которые являются изолированно солидными, а также солидно-кистозных опухолей: диагностическая точность возрастает примерно на 15% при добавлении ДВИ к базовому протоколу МРТ [18]. Если солидный компонент ОЯ имеет низкую И.С. на Т2, при этом низкий МР-сигнал на ДВИ с высокими значениями, то высока вероятность доброкачественности данного образования безотносительно характера накопления контрастного препарата в структуре. Это играет особенно важную роль при необходимости дифференциальной диагностики во время беременности или наличии других противопоказаний к внутривенному контрастированию [14].
С другой стороны, при выявлении предоминантно солидного образования/солидного компонента с наличием выраженного истинного ограничения диффузии в структуре рекомендовано проведение динамического внутривенного контрастирования.
МРТ с динамическим внутривенным контрастным усилением (ДКУ)
Анализ накопления контрастного препарата основан на построении кривой «время-интенсивность сигнала» солидного компонента в ОЯ и неизмененной тканью миометрия с использованием классификации C.K. Kuhl et al. (2003): кривые разделены на три основных типа по характеру И.С. в различные фазы динамического контрастирования относительно кривой накопления в неизмененной зоне миометрия – при наличии матки (рис. 3).

Кривая I типа – это кривая, характеризующаяся постоянным ростом с низкой интенсивностью накопления контрастного препарата (КП) по сравнению с миометрием; II типа – кривая, характеризующаяся быстрым повышением И.С. с последующим формированием плато; III типа – кривая, характеризующаяся выраженным, быстрым достижением максимума (превосходящим или близким по интенсивности и амплитуде подъема МР-сигнала к миометрию), которая далее может быть вариабельной: характеризоваться быстрым снижением амплитуды И.С. в первые минуты/стабилизацией и формированием плато. МР с ДКУ должны быть получены в плоскости, которая включает в себя солидный компонент образования и миометрий, либо плоскость выбирается рентгенологом и выполняется двумерная Т1-В.И. или трехмерная последовательность T1-В.И. с последующей постпроцессинговой реформацией [7].
Если солидный компонент образования характеризуется быстрым, активным накоплением КП (III тип кривой), опухоли имеют высокую вероятность злокачественности. Тогда как образования с низкой амплитудой и интенсивностью его накопления относительно миометрия (I тип кривой) имеют низкий риск злокачественности [16–19].
При необходимости более детальной оценки и достаточном временном разрешении серий (205 с) на основе динамических кривых есть возможность проведения:
- полуколичественной оценки (период полуподъема И.С., максимальный наклон кривой, амплитуда накопления КП);
- количественной оценки перфузии солидного компонента опухоли (Ktrans; Kep; vе),
- при этом к настоящему моменту изолированное использование данных видов оценки не обладает достаточной воспроизводимостью на различных аппаратах ввиду специфик настройки и различных программ постпроцессинговой оценки и относится к перспективным направлениям для дальнейшей разработки.
Диагностический алгоритм оценки МР-изображений в дифференциальной диагностике образований яичников
С учетом визуализационных характеристик ОЯ разделяют на три группы.
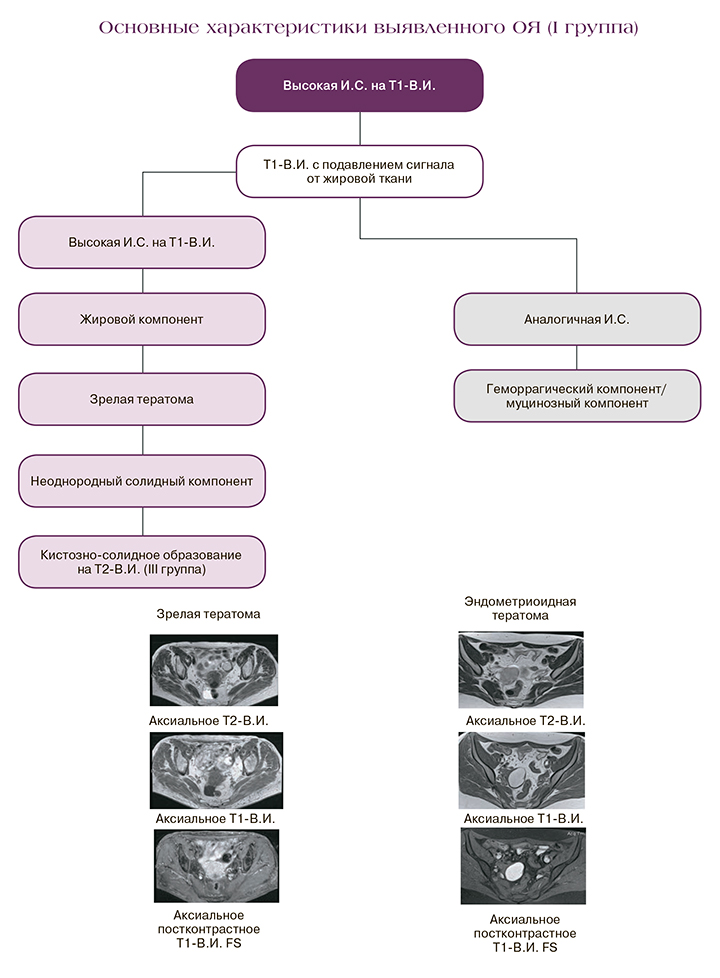
- Образования с высокой И.С. на Т1-взвешенных изображениях (Т1-В.И.).
- Солидные образования на Т2-В.И. с И.С., сходной со скелетными мышцами (образования с низкой И.С. на Т2-В.И.), или с И.С. выше мышечного (образования с промежуточной И.С. на Т2-В.И.), или солидные структуры с неоднородной И.С.
- Комплексные кистозно-солидные образования.
Образования с высокой интенсивностью сигнала на Т1-взвешенных изображениях
Образования, входящие в данную категорию, требуют визуализации на Т1-В.И. с подавлением МР-сигнала от жировой ткани (FS) с целью дифференциации жирового компонента от геморрагического. При этом последовательность Т1FS должна быть выполнена в аналогичной плоскости, что и последовательность T1-В.И., чтобы обеспечить корректное сравнение даже мелких компонентов.
Геморрагические образования могут иметь вариабельную И.С. на T2-В.И., при этом их отличием является высокая И.С. на Т1-В.И. (без снижения в режиме FS), за счет внеклеточного метгемоглобина [7].
При обнаружении солидного компонента в образовании с высокой И.С. на T1 требуется дополнительная оценка с целью дифференциации солидного компонента от пристеночных сгустков/тромбов (алгоритм аналогичен образованиям III группы) [11].
Поскольку зрелые кистозные тератомы крайне редко, но все-таки могут иметь локусы малигнизации, а также для дифференциальной диагностики с дисгерминомами необходимо исключить наличие гетерогенных солидных компонентов с промежуточной И.С./проанализировать состояние капсулы образования.
Требуется осторожность при использовании ДВИ и ДКУ для оценки образований с высокой И.С. на Т1-В.И. Обе последовательности могут дать ложноположительные результаты у доброкачественных кистозных тератом, поскольку эпидермальные компоненты тератомы ограничивают свободную диффузию, по интенсивности МР-сигнала сходны со злокачественными поражениями, а солидные компоненты доброкачественных тератом при ДКУ могут иметь кривые накопления КП II/III типов [20].
И.С. кистозного компонента геморрагических поражений (эндометриомы, геморрагические кисты) на ДВИ может варьировать в широких пределах и не иметь дополнительной диагностической ценности.
Таким образом, содержание жирового компонента или крови в образованиях с высокой И.С. на Т1 может быть легко и эффективно определено с использованием комбинации изображений T1-В.И., T2-В.И. и T1FS-В.И. Однако если у такого рода образований имеются солидные участки или у тератомы имеется объемный неоднородный солидный компонент, рекомендуется дальнейшая оценка с внутривенным введением гадолиний-содержащих КП [7].
Изолированно-солидные образования
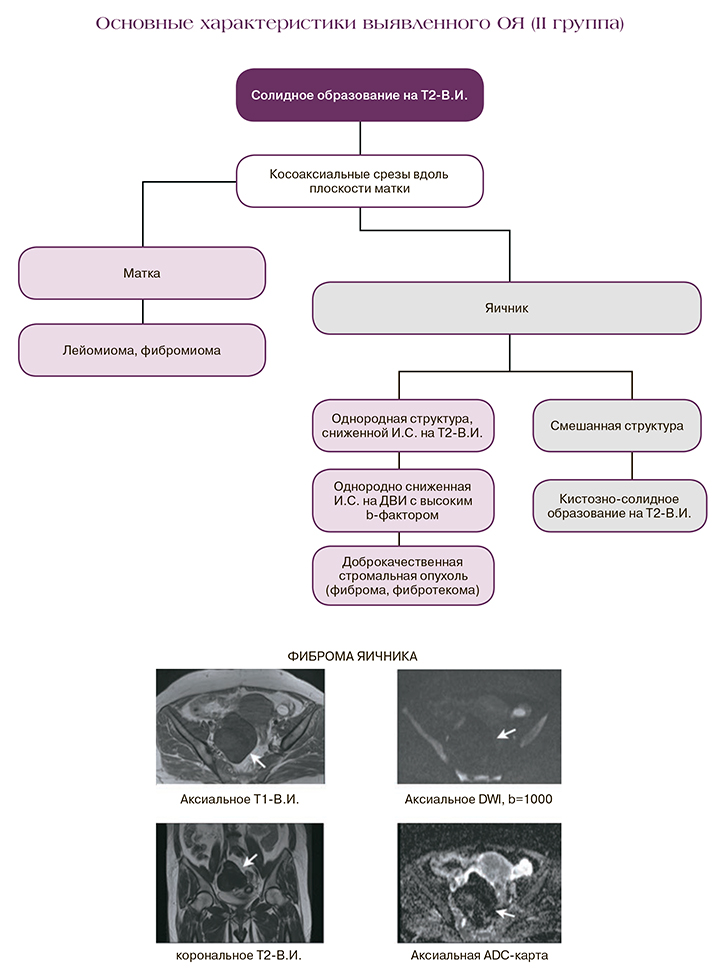
Изолированно-солидные ОЯ всегда вызывают опасения на этапе неинвазивной диагностики ввиду риска вторичного поражения. При этом на практике в подавляющем большинстве они являются доброкачественными фиброзно-мышечными образованиями, такими как опухоли стромальных групп, например, фиброма яичника или, при некорректной первоначальной оценке органопринадлежности, – лейомиома матки [8].
Для точной дифференциации на первом этапе исследования необходимо определить их анатомическое расположение, а именно – в яичниках или в матке. Так, стромальные опухоли яичника окружены компримированной тканью яичника («симптом клюва»), дифференцируются от матки, у пациенток в постменопаузе зачастую четко определяется только контралатеральный неизмененный яичник. При лейомиоме матки солидное образование окружено компримированной миометриальной тканью. Лейомиома матки также может иметь субсерозную локализацию на ножке, содержащей питающие сосуды. Визуализация ножки и сосудов становится возможной при использовании наклонной аксиальной плоскости T2-В.И. через максимальную точку контакта между ОЯ и маткой [7].
На МРТ ДКУ фибромы/текомы яичника обычно демонстрирует кривую I типа. МРТ ДКУ также актуально при дифференциации субсерозной лейомиомы матки от фибромы яичников за счет более детальной визуализации окружающей ткани яичника [13].
В настоящее время рекомендуется обязательное включение в протокол ДВИ: солидные образования, имеющие низкий сигнал на последовательностях ДВИ с высокими значениями b-фактора, могут рассматриваться как доброкачественные, и проведение ДКУ не требуется. При этом образования с промежуточной И.С. на Т2-В.И. или со сниженной И.С. на Т2-В.И., имеющие неоднородный/повышенный сигнал на ДВИ, нуждаются в дополнительной оценке с ДКУ (рассматриваются как ОЯ III группы) [7].
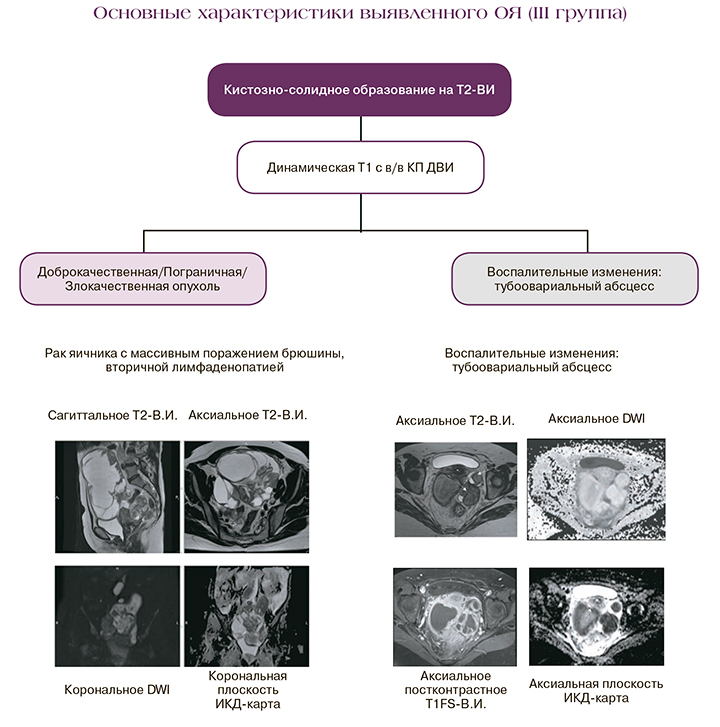
Комплексные кистозно-солидные образования
В случаях с высокой вероятностью злокачественности некоторых солидных, а также предоминантно кистозных образований с наличием солидных компонентов/папиллярных разрастаний, необходимо проведение внутривенного контрастирования. Получение постконтрастных изображений (как правило, на 30 с после введения) является наиболее широко доступным [7]. При этом в актуальном протоколе МРТ ДКУ рекомендовано к использованию для более детальной оценки кинетики накопления КП.
При оценке ДВП высокая интенсивность МР-сигнала при исследовании с b>800 с/мм2 с соответствующим низким сигналом на ИКД-картах, свидетельствующим о наличии истинного ограничения диффузии, характерна для злокачественных новообразований (ЗНО) яичников. При этом некоторые доброкачественные опухоли, а именно доброкачественные кистозные тератомы, эндометриоидные кисты, некоторые текомы, дегенеративные лейомиомы и опухоли Бреннера, могут иметь аналогичную И.С. сигнала на ДВИ, как и при ЗНО. Кроме того, количественная оценка ИКД имеет выраженные ограничения ввиду значительного перекреста значений.
При этом низкий сигнал ДВИ при использовании с высоким значением b-фактора является одним из важнейших критериев доброкачественности образования при неинвазивной визуализации [14].
Необходимо помнить, что воспалительные заболевания яичников, а именно тубоовариальные абсцессы, могут симулировать визуализационную структуру опухолей, при этом клиническая картина может быть стертой, особенно при применении антибиотикотерапии; имеют сложную структуру, активную реакцию брюшины на нативных изображениях и при контрастировании, симулирующую ковровые имплантационные поражения; при этом наиболее значимым дифференциально-диагностическим критерием будет являться И.С. от септического содержимого на ДВИ (b>800): неравномерное повышение и сниженная И.С. на ИКД-картах.
Критерии оценки ОЯ, которые необходимо отразить в протоколе исследования:
- размеры образования (три линейных, объем);
- односторонняя/двусторонняя локализация;
- характеристики структуры образования:
- характеристика жидкостного компонента (содержания жидкости/крови/жира);
- наличие солидного компонента/вегетаций/неравномерного утолщения стенок или внутренних перегородок образования;
- интенсивность сигнала солидного компонента на Т2-взвешенных изображениях;
- интенсивность сигнала солидного компонента на диффузионно-взвешенных изображениях с высоким фактором диффузии, значение ИКД;
- тип кривой накопления КП в солидном компоненте;
- наличие зон некроза/кровоизлияний в солидном компоненте;
- наличие МР-признаков инвазивного роста образования (распространение на соседние органы, поражение париетальной и висцеральной брюшины в зоне исследования, асцит, вторичное поражение лимфатических узлов).