Комбинированный скрининг I триместра беременности, определяющий риск наличия хромосомных аномалий плода, является одним из обязательных этапов дородового обследования как в Российской Федерации, так и в большинстве стран мира [1–3].
С помощью комплексного анализа демографических, антропометрических характеристик матери, ее общего и акушерского анамнеза, ультразвуковых маркеров и показателей биохимического скрининга (свободной β-субъединицы человеческого хорионического гонадотропина (β-ХГЧ) и ассоциированного с беременностью протеина А (РАРР-А)) [3, 4] возможно выявление 80–96% случаев трисомии 21 (синдром Дауна), 92% случаев трисомии 18 (синдром Эдвардса) и 100% случаев трисомии 13 (синдром Патау) [4]. По данным официального аудита, эффективность пренатального выявления трисомии 21 в Российской Федерации в 2017 г. составила 84% [5].
Однако у ряда пациенток инвазивная генетическая диагностика не подтверждает наличие хромосомной патологии у плода – уровень ложноположительных результатов (ЛПР) скрининговых алгоритмов, по данным источников литературы, составляет 2,5–5,0% [4].
Еще в прошлом тысячелетии было отмечено, что частота преждевременных родов, преэклампсии (ПЭ), случаев антенатальной гибели или рождения маловесного плода у пациенток с ЛПР скрининга была в 3,5 раза чаще, чем у беременных с нормальными результатами теста [6]. Исследования последних лет, проведенные в различных странах мира (Португалия, Индия, США, Иран), подтвердили полученные ранее результаты [7–10]. Однако метаанализ Pylypjuk и соавт. [11], включавший 68 515 пациенток и подтвердивший увеличение частоты ПЭ и антенатальной гибели плода после ЛПР скрининга, не выявил подобной связи в отношении рождения маловесных плодов и преждевременных родов.
Практически во всех публикациях была установлена строгая корреляция степени отклонения от нормативных биохимических показателей скрининга с дальнейшим осложненным течением беременности [7–10]. Хорошо известно, что снижение уровня PAPP-A и плацентарного фактора роста (PLGF) в I триместре беременности коррелирует с последующим развитием плацентарной дисфункции и связанным с ней недостаточным ростом плода [12, 13]. На настоящий момент в Российской Федерации исследование уровня PLGF внедряется в повседневную клиническую практику, в то время как определение уровня РАРР-А проводится каждой беременной в большинстве стран мира [3, 14, 15].
Рекомендации Королевского колледжа акушеров-гинекологов Великобритании (RCOG), посвященные диагностике и ведению случаев маловесных для гестационного возраста плодов, определили снижение уровня РАРР-А как «большой» фактор риска [16]. Вместе с тем метаанализ Zhong и соавт. [17], включавший 103 исследования (n=432 621), показал низкую прогностическую ценность любого изолированного биохимического маркера, рекомендуя использовать для формирования группы риска развития акушерских осложнений комбинированные алгоритмы, одним из которых является внедренный в систему раннего пренатального скрининга Российской Федерации алгоритм Фонда медицины плода (The Fetal Medicine Foundation, FMF, Великобритания), позволяющий проводить одновременный расчет рисков хромосомных аномалий и рождения маловесного для гестационного возраста плода [17, 18].
По данным официального аудита [5], в 2017 г. в нашей стране охват скринингом достиг 80% общего числа беременных: количество обследованных составило 1 126 662 пациентки, из них в группу риска хромосомных аномалий плода были отнесены 20 280 беременных (1,8% количества обследованных). Хромосомные аномалии и врожденные пороки развития плода были подтверждены в 5997 (29,57%) случаях [5]. Анализ дальнейшего течения беременности и ее исходов у пациенток с ЛПР скрининга до настоящего времени не проводился.
Целью данного исследования являлась оценка вероятности развития осложнений беременности у пациенток с ЛПР скрининга на хромосомные аномалии плода.
Материалы и методы
При предполагаемой частоте рождения маловесного для гестационного возраста плода, равной 5%, в группе контроля и увеличении частоты данных осложнений в группе с ЛПР скрининга в 3 раза, для значений альфа-риска 5% и бета-риска 20% (мощность исследования 80%) необходим объем выборки 52 человека.
В проспективном обсервационном когортном исследовании в амбулаторных условиях ООО «Центр медицины плода МЕДИКА» (Москва, РФ) в 2015–2017 гг. нами были безвыборочно обследованы 2500 пациенток в сроках беременности от 11+1 до 13+6 недель.
Критерии включения: одноплодная беременность, живой плод в полости матки на момент проведения исследования. Критерии исключения: многоплодная беременность, врожденные пороки развития и хромосомные аномалии плода. Информированное согласие на проведение исследования было получено у каждой пациентки.
Комбинированный скрининг проводили в полном соответствии с алгоритмом FMF [3, 4, 19]. Для каждой беременной врачом заполнялся опросник по данным общего, семейного и акушерского анамнеза, включая возраст беременной, расовую принадлежность, паритет (количество беременностей продолжительностью 24 недели и более), задержку роста плода (ЗРП) в анамнезе у повторнородящих, способ зачатия (естественное зачатие/стимуляция овуляции без экстракорпорального оплодотворения (ЭКО)/ЭКО с указанием даты и типа процедуры), курение, наличие сахарного диабета (СД) и его тип, системной красной волчанки, антифосфолипидного синдрома (АФС), семейного анамнеза ПЭ.
Измеряли текущий вес (в кг) и рост (в см) пациентки с расчетом индекса массы тела. Артериальное давление (АД) измеряли по международным правилам [17] автоматическим тонометром (OMRON Healthcare Europe B.V. Hoofddorp, The Netherlands). Определение уровня РАРР-А и β-ХГЧ в сыворотке беременных проводили на анализаторе DELFIA Xpress system (PerkinElmer Life and Analytical Sciences, USA).
Ультразвуковое исследование (УЗИ) проводили специалисты, сертифицированные FMF, на ультразвуковой системе Voluson E8 Expert (GE Healthcare, USA) с использованием 4D-внутриполостного мультичастотного датчика (5–13 MHz) и 4D-трансабдоминального конвексного мультичасточного датчика (2–8 MHz).
Срок беременности устанавливали по копчико-теменному размеру плода, проводили определение толщины воротникового пространства, частоты сердечных сокращений плода, оценку носовых костей плода, параметров кровотока через трикуспидальный клапан и в венозном протоке, выявление врожденных пороков развития. Пульсационный индекс (ПИ) в маточных артериях с обеих сторон определялся трансвагинальным доступом по правилам FMF [19]
Перевод абсолютных значений биохимических и биофизических показателей в значения, кратные медианам (МоМ), с учетом материнских характеристик проводили автоматическим программным комплексом Astraia Software Version 2.8 (Германия).
На основании полученных результатов производили расчет индивидуального риска хромосомных аномалий плода (синдромы Дауна, Эдвардса и Патау) с порогом отсечки ≤1:100 и риск рождения маловесного для гестационного возраста плода с порогом отсечки ≤1:150 [20]
При высоком риске хромосомных аномалий, увеличении толщины воротникового пространства более 99-го процентиля для срока беременности, выявлении врожденных пороков развития плода пациенткам проводили инвазивную генетическую диагностику.
Данные об исходах беременностей были получены из амбулаторных карт и в результате телефонного интервьюирования.
Основным изучаемым исходом была масса новорожденного менее 10-го процентиля значений для гестационного возраста [21] при преждевременных и своевременных родах.
Дополнительными изучаемыми исходами были: самопроизвольное прерывание беременности или гибель плода до 22 недель беременности, преждевременные роды (до 37 недель беременности), отслойка плаценты, госпитализация новорожденного в отделение реанимации и интенсивной терапии, перинатальная гибель, включающая антенатальную гибель плода после 22 недель беременности и гибель новорожденного до 28 дня жизни.
Статистический анализ проводили с помощью программного обеспечения MedCalc software (Mariakerke, Belgium) и XLSTAT of Microsoft Excel 2010 for Windows 10 (Microsoft Corporation, USA). Для оценки различий между группами по количественным переменным с нормальным распределением (возраст пациенток, индекс массы тела) применялся t-критерий Стьюдента для независимых выборок, при отклонении от нормального распределения количественных переменных (биофизические и биохимические показатели скрининга) использовали U-тест Манна–Уитни. Тест Колмогорова–Смирнова применяли для проверки формы распределения, точный критерий Фишера – для оценки различий между группами по качественным признакам.
Относительный риск (ОР) был рассчитан для оценки вероятности развития осложнений и неблагоприятных исходов беременности у пациенток с ЛПР хромосомных аномалий по результатам комбинированного скрининга в I триместре беременности в сравнении с пациентками группы низкого риска.
Критерием статистической значимости полученных результатов считали общепринятую в медицинской статистике величину р<0,05.
Результаты
Из настоящего исследования мы исключили 484 пациентки по причине отсутствия детальной информации о течении и исходах беременности (n=325), наличия у плода врожденных пороков развития и хромосомных аномалий (n=159). С учетом результатов комбинированного скрининга 2076 пациенток были разделены на группы исследования:
- 1-я группа (n=55): случаи с ЛПР хромосомных аномалий плода в сочетании с высоким (подгруппа 1a (n=32)) или низким (подгруппа 1b (n=23)) риском рождения маловесного плода;
- 2-я группа (n=1563): случаи с низким риском хромосомных аномалий и рождения маловесного плода (контрольная группа).
Случаи с низким риском хромосомных аномалий и высоким риском рождения маловесного плода (n=458) не вошли в дальнейший сравнительный анализ данного исследования.
При анализе клинико-эпидемиологических характеристик (табл. 1) только количество пациенток с АФС в подгруппе 1а статистически значимо превышало таковое в группе контроля (р=0,01). Также в подгруппе 1а обращал на себя внимание большой процент беременных с хронической артериальной гипертензией, системной красной волчанкой, никотиновой зависимостью и отягощенным акушерским анамнезом, однако статистически значимая разница с показателями других групп не была достигнута.
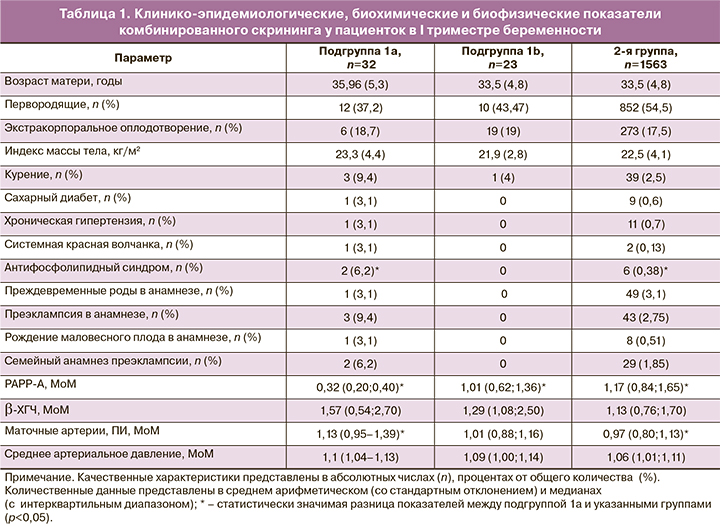
Среди показателей комбинированного скрининга у пациенток подгруппы 1а отмечались статистически значимое снижение уровня РАРР-А в сравнении с двумя другими группами (р<0,0001) и повышение резистентности кровотока в маточных артериях в сравнении с группой контроля (р=0,0003) (см. табл. 1).
Показатели подгруппы 1b и 2-й группы статистически не отличались.
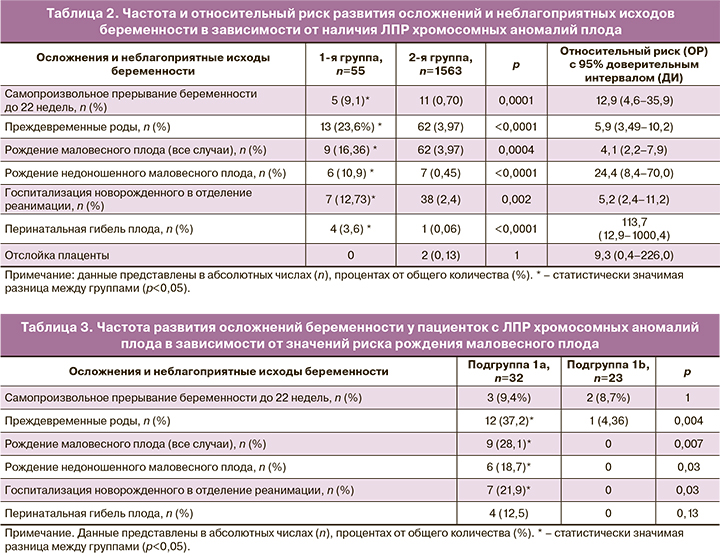
Анализ дальнейшего течения беременности выявил статистически значимое повышение частоты всех исследуемых осложнений и неблагоприятных исходов, за исключением отслойки плаценты, у пациенток с ЛПР скрининга (табл. 2).
При сравнении исходов беременности между пациентками 1а и 1b подгрупп (табл. 3) было выявлено, что все случаи рождения маловесного для гестационного возраста плода (9 случаев) и перинатальной гибели (4) были отмечены только в подгруппе 1а. Помимо этого, статистически значимые отличия были выявлены в частоте преждевременных родов, которая была многократно выше в подгруппе 1а, чем в подгруппе 1b. Количество самопроизвольных прерываний беременности или гибели плода до 22 недель беременности было практически одинаковым между группами.
Обсуждение
Результаты данного исследования, проведенного впервые в Российской Федерации, подтвердили данные зарубежных публикаций [6–11] о повышении частоты многочисленных осложнений у беременных с ЛПР комбинированного скрининга на хромосомные аномалии плода.
В нашем исследовании обращает на себя внимание более значительное увеличение риска (ОР 4,1) рождения маловесного плода, прежде всего в недоношенном сроке (ОР 24,4) у данной группы пациенток, в которой 46,2% (6/13 случаев) новорожденных при преждевременных родах имели массу менее 10-го процентиля. Для сравнения: в группе контроля этот показатель был равен 11,2% (7/62).
Высокая вероятность самопроизвольного прерывания беременности в сроки до 22 недель (ОР 12,9) может быть связана с наличием патологии плода, недоступной для выявления при УЗИ и кариотипировании в I триместре беременности, либо с развитием истмико-цервикальной недостаточности.
Детальный анализ исходов после 22 недель беременности продемонстрировал, что подавляющее большинство осложнений (преждевременные роды, рождение маловесного плода, перинатальная гибель) развивается у пациенток подгруппы 1а с сочетанием ЛПР хромосомных аномалий и рождения маловесного плода по данным комбинированного скрининга. У беременных данной подгруппы отмечаются большое количество преконцепционных факторов риска, статистически значимые отклонения биофизических и биохимических маркеров комбинированного скрининга: выраженное снижение РАРР-А (менее 0,4 МоМ), повышение показателей резистентности кровотока в маточных артериях, подтверждающие прогностическую значимость этих показателей.
Интересен тот факт, что исследование Baer и соавт. [9] аналогичным образом показало, что при сочетании рисков различных патологий у одного плода частота последующего развития осложнений беременности, включая перинатальную гибель, возрастает в десятки и сотни раз.
К сильным сторонам нашего исследования относятся его проспективный дизайн, безвыборочность, за счет чего общая частота осложнений беременности соответствовала популяционной [22], исследование скринингового алгоритма, имеющего общероссийское применение.
Слабыми сторонами исследования являются относительно небольшое количество пациенток с ЛПР скрининга, однако, достигшее необходимого расчетного объема выборки. Ретроспективный «post-hoc»-анализ определил статистическую силу исследования в отношении рождения маловесного плода в 90,4%. В данном исследовании не проводился анализ влияния высокого риска ПЭ и вероятности развития данного осложнения у пациенток с ЛПР скрининга, что должно явиться целью последующих изысканий.
Заключение
Исследование показало значительное увеличение вероятности развития осложнений и неблагоприятных исходов беременности при ЛПР комбинированного скрининга. После исключения хромосомных аномалий плода все вышеуказанные пациентки должны быть отнесены к группе высокого риска самопроизвольного прерывания беременности в сроки до 22 недель, и им необходимо рекомендовать проведение дополнительного УЗИ в 16 недель для оценки анатомии плода и состояния шейки матки.
Основным предиктором развития осложнений после 22 недель беременности будет наличие высокого риска рождения маловесного плода по результатам комбинированного скрининга, в алгоритме которого учитываются материнские факторы, повышение показателей резистентности кровотока в маточных артериях и выраженное снижение уровня РАРР-А.
Для пациенток должен быть разработан индивидуальный план лечебно-профилактических мероприятий и дополнительного контроля за состоянием плода до момента родоразрешения.
При неблагоприятном исходе беременности целесообразно проведение детального патологоанатомического исследования плода и постмортального хромосомного микроматричного анализа, результаты которых могут оказать существенную помощь в консультировании пациентки при подготовке к последующей беременности.



