Первое известное описание синдрома резистентных яичников (СРЯ) сделано в 1969 г. пионером овариальной стимуляции гонадотропинами Джоржианой Джонс. Этот синдром также известен по имени пациентки этого доктора как синдром Сэвидж (Сэвидж-синдром) [1].
Основная характеристика СРЯ – резистентность антральных фолликулов как к эндогенным, так и экзогенным гонадотропинам у пациенток с нормальным женским фенотипом и кариотипом. Отсутствие селекции доминантного фолликула, обусловленное резистентностью фолликулов к гонадотропинам, приводит к снижению секреции эстрадиола и ингибина Б и, как следствие, к гипергонадотропному гипогонадизму. СРЯ характеризуется как гипергонадотропное состояние. Это состояние развивается на фоне наличия сверхвысокого, нормального или даже сниженного количества антральных фолликулов, нормального количества примордиальных фолликулов в яичнике и различных значений антимюллерова гормона (АМГ) [1–3].
Наличие гипергонадотропного гипогонадизма на фоне различного числа антральных фолликулов и показателей АМГ при СРЯ указывает на его гетерогенность. Гетерогенность проявляется и в характеристике менструального цикла. Пациентки с СРЯ, как правило, имеют первичную аменорею. Однако ряд авторов в своих публикациях отмечают наличие вторичной аменореи и полностью не исключают присутствия регулярных менструаций [3]. Кроме того, гетерогенность может быть в размере или стадии остановки развития антральных фолликулов. Это могут быть как малые антральные фолликулы диаметром 2–3 мм, так и фолликулы диаметром 5–9 мм. Гетерогенность по овариальному резерву, косвенно оцениваемая по АМГ, важна для прогноза лечения в совокупности с возрастом пациентки. В то же время пока не ясно, какая подгруппа имеет лучший прогноз лечения данного заболевания, поскольку количество рожденных детей при помощи дозревания ооцитов в пробирке (in vitro maturation (IVM)) у пациенток с СРЯ в мире в целом не превышает и 10.
Этиология синдрома чаще остается невыясненной [4]. Причиной могут быть инактивирующие полиморфизмы генов гонадотропиновых рецепторов [2, 5, 6] или пострецепторных гормональных сигнальных путей [4, 7–9]. Имеются также данные о том, что этиология данного гетерогенного состояния может быть обусловлена иммунологическими нарушениями, связанными с наличием антител к эндогенным и перекрестно-реактивным экзогенным гонадотропинам [7, 10]. Последнее актуально для случаев вторичной аменореи у женщин, имеющих беременности и детей, и для случаев, совпадающих с системными аутоиммунными реакциями.
В третью группу хронической ановуляции ВОЗ (гипергонадотропной ановуляции) входят формы преждевременной недостаточности яичников, которые сопровождаются олигоменореей или аменореей, повышением уровней гонадотропинов и снижением концентрации эстрадиола в сыворотке крови [11, 12]. Условно СРЯ по признаку гипергонадотропности попадает в третью группу классификации ВОЗ. Высокие уровни гонадотропинов, характерные для менопаузального периода, ановуляция и аменорея наблюдаются как при СРЯ, так и у пациенток с преждевременным истощением яичников (ПИЯ). До 2013 г., так же, как и при первичной овариальной недостаточности, тактика преодоления бесплодия у пациенток с СРЯ заключалась в использовании донорских ооцитов. После 2013 г. можно говорить о революционном решении применения метода IVM при СРЯ, который дал возможность пациенткам с данной патологией иметь генетически своего ребенка [13]. Подходы к дальнейшей тактике преодоления бесплодия при этих состояниях с 2013 г. могут принципиально отличаться. Изменение тактики для пациенток диктует возможность их разграничения и дополнения классификации ВОЗ.
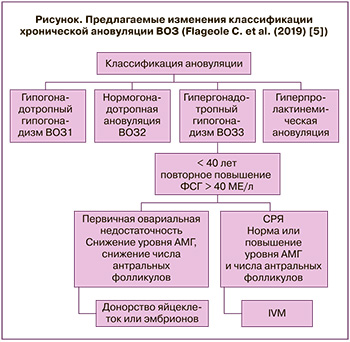 По мнению Flageole C., главное отличие СРЯ от ПИЯ состоит в наличии нормального овариального резерва при СРЯ, в то время как при ПИЯ он снижен или отсутствует [5]. Различие овариального резерва и возможность применения IVM у пациенток с СРЯ позволили Flageole C. в 2019 г. предложить дополнение к классификации третьей группы ановуляторного бесплодия ВОЗ (рисунок).
По мнению Flageole C., главное отличие СРЯ от ПИЯ состоит в наличии нормального овариального резерва при СРЯ, в то время как при ПИЯ он снижен или отсутствует [5]. Различие овариального резерва и возможность применения IVM у пациенток с СРЯ позволили Flageole C. в 2019 г. предложить дополнение к классификации третьей группы ановуляторного бесплодия ВОЗ (рисунок).
С нашей точки зрения, главное отличие ПИЯ от СРЯ заключается именно в отсутствии реакции антрального фолликула на эндогенные или экзогенные гонадотропины, а не в различии овариального резерва. У женщин с СРЯ количество антральных фолликулов и уровень относительно коррелирующего с ним АМГ могут быть разными при признании гетерогенности всей группы синдрома. Собственный опыт и будущие наблюдения могут показать, что немногочисленная группа пациенток с наличием 1–3 антральных фолликулов, не реагирующих на фолликулостимулирующий гормон (ФСГ) (редкий вариант СРЯ), будет отличаться от большой группы пациенток с низким овариальным резервом, в тот или иной момент отвечающих на обычно избыточную гонадотропную стимуляцию при появлении чувствительного антрального фолликула.
Для пациенток с СРЯ вероятность рождения ребенка после стимуляции гонадотропинами в обычной половой жизни или в стандартном ЭКО исключена, так как антральные фолликулы пациенток не реагируют на эндогенный и экзогенный ФСГ. Донорство ооцитов оставалось единственной возможностью преодоления бесплодия. Получение незрелых ооцитов из антральных фолликулов может быть решением проблемы у пациенток, для которых дозревание фолликула in vivo невозможно. Неоспоримым преимуществом IVM являются получение и использование собственных ооцитов.
IVM – один из методов вспомогательных репродуктивных технологий. Он заключается в созревании in vitro незрелых ооцит-кумулюсных комплексов (ОКК), полученных из антральных фолликулов яичника [14]. Впервые Edwards описал способность незрелых ооцитов самостоятельно достигать метафазы II (MII) in vitro после извлечения из фолликулярной среды животных, в том числе и человека [15]. Изначально под IVM подразумевалось получение незрелых ооцитов из нестимулированных яичников. Однако в дальнейшем в циклах IVM стали применять гонадотропиновый прайминг и использование триггера (хорионического гонадотропина (ХГЧ) или агониста гонадотропин-рилизинг-гормона (аГнРГ)) [16, 17]. Дискуссии о необходимости применения гонадотропинов и триггера финального созревания фолликулов при IVM продолжаются [14, 17]. Это связано с тем, что применение ХГЧ или аГнРГ может приводить к получению зрелых клеток, особенно у фолликулов диаметром 8–12 мм [18]. Триггер ставит под сомнение биологическую основу этой процедуры и незначительно отличается от стандартной стимуляции в ЭКО. De Vos M. et al. резюмировали, что IVM может включать в себя классическое получение незрелых фолликулов без гонадотропинового прайминга или с ним для роста фолликулов, но исключает циклы, где, помимо ФСГ-прайминга, применяется использование триггера с целью финального созревания ооцитов in vivo [14].
Гонадотропная стимуляция не может исключать редкого, но возможного спонтанного пика ЛГ. Кроме того, преимущество чуть менее продолжительного введения ФСГ-препаратов теряется и, скорее, дискредитируется меньшей итоговой эффективностью в наступлении беременностей при проведении IVM, если сравнивать с аналогичным показателем при стандартном ЭКО. Иными словами, уже назначив препараты гонадотропинов, логичнее и оправданнее провести полную овариальную стимуляцию и получить максимальную результативность ЭКО, учитывая, что избежать синдрома гиперстимуляции яичников сегодня не представляется проблемой, заменив триггер. С нашей точки зрения, если IVM рассматривать как самостоятельную процедуру в практическом плане, то ее следует проводить без единого препарата и в любой день менструального цикла. Тем более что использование гонадотропинов перед IVM при резистентности яичников, возможно, лишено логики изначально.
В литературе описаны единичные случаи рождения детей при использовании IVM у пациенток с СРЯ (таблица). В 2013 г. Grynberg M. et al. впервые опубликовали данные о рождении ребенка при использовании IVM у женщины 29 лет с первичной аменореей и СРЯ [13]. Пациентка имела нормальный женский кариотип, мутации в ФСГ- и ЛГ-рецепторах отсутствовали. Базальный уровень ФСГ равнялся 40,3 мМЕ/мл, ЛГ – 35,7 мМЕ/мл, уровень эстрадиола был менее 15 пг/мл, АМГ – 4,5 нг/мл, число антральных фолликулов (ЧАФ) – 23 по данным ультразвукового исследования малого таза. Пациентке была проведена пробная овариальная стимуляция рекомбинантным ФСГ (рФСГ) 300 МЕ/день с ожидаемым отсутствием эффекта. Авторы использовали вагинальную форму 17b-эстрадиола в дозировке 2 мг/день в течение 14 дней для подготовки эндометрия. При достижении толщины эндометрия 8 мм был введен ХГЧ 10 000 МЕ; через 35–36 ч была проведена трансвагинальная пункция фолликулов с использованием иглы 19 GN диаметра и аспирационным давлением 7,5 кПА. Получено 15 ооцитов стадии GV, после IVM культивирования 12 ооцитов достигли зрелости (MII). На 2-й день после проведения ИКСИ 3 лучших эмбриона перенесли в полость матки. Поддержка лютеиновой фазы проводилась микронизированным прогестероном 600 мг/день (с 3-го дня после введения ХГЧ). Результатом программы стало рождение здорового ребенка массой 3400 г.
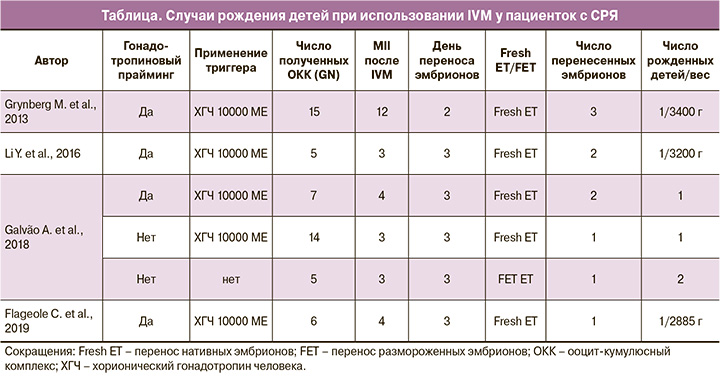
Через 3 года Li Y. et al. сообщили еще об одном удачном случае рождения здорового ребенка при помощи IVM у 33-летней женщины с вторичным бесплодием, перенесенным сальпингоофоритом туберкулезной этиологии и СРЯ [19]. У пациентки кариотип 46ХХ, отсутствовали мутации в гене рецепторов ФСГ. Уровень ФСГ – 42 МЕ/л, ЛГ – 39 МЕ/л, эстрадиол – 260 пмоль/л, АМГ – 12,3 нг/мл и ЧАФ – 25. После 15 дней приема комбинированных оральных контрацептивов пациентке ввели 1,25 мг агониста ГнРГ (Трипторелин) и на 1-й день начали овариальную стимуляцию рФСГ в дозировке 100 МЕ/сут с добавлением менотропинов 75 МЕ/день с последующим увеличением дозировки рФСГ до 300 МЕ/день. В связи с отсутствием ответа на стимуляцию был начат прием эстрадиола валерата 4 мг/сут в течение 7 дней с последующим введением ХГЧ 10 000 МЕ при достижении толщины эндометрия 8 мм. Спустя 36 ч при трансвагинальной пункции яичников было получено 5 незрелых ооцитов. Пункция проводилась иглой 17 GN с аспирационным давлением 10,7 кПА. Три ооцита достигли стадии MII и были оплодотворены при помощи ИКСИ спустя 24 ч при инкубировании в среде IVM. Введение прогестерона было инициировано с момента оплодотворения ооцитов. В полость матки были перенесены 2 эмбриона лучшего качества на 3-й день. Итогом стало рождение здорового мальчика массой 3200 г.
В 2018 г. Galvão A. et al. опубликовали результаты использования IVM, в том числе у женщин с СРЯ [3]. Всего в работе сообщалось о проведении IVM у 9 пациенток с СРЯ. У 2 из них имелся регулярный менструальный цикл, у 3 – олигоменорея и только у 4 – аменорея. Авторы утверждают, что у всех пациенток, включая женщин с регулярным 28-дневным менструальным циклом, имеется СРЯ. Открытым остается вопрос, каким образом при резистентности к ФСГ у 2 женщин имелся регулярный менструальный цикл? Ознакомление со статьей оставляет вопрос, все ли включенные пациентки имеют действительно СРЯ? Авторы сообщают о рождении ребенка в однополой паре с проведением IVM у донора с СРЯ, но реципиентом являлась здоровая женщина. Galvão A. et al. сообщают о рождении здоровых детей у двух пациенток с СРЯ при использовании IVM. Одной пациентке было проведено 7 циклов IVM, из которых один закончился родами. Женщине 36 лет с СРЯ, вторичной аменореей, ЧАФ 40, уровнем АМГ 2,11 мкг/л, ФСГ 8 МЕ/л был проведен прайминг менотропинами 150 МЕ/сут в течение 5 дней с дальнейшим введением рХГЧ 10 000 МЕ. При трансвагинальной пункции было получено 7 ОКК. В результате IVM из 7 ооцитов 4 достигли стадии МII, и 2 трехдневных эмбриона были перенесены в свежем цикле с рождением 1 здорового ребенка. Авторы провели определение базального сывороточного ФСГ в 7 циклах IVM у данной пациентки с результатами: 6,5; 8,6; 9,0; 5,2; 12,0; 12,6 и 7,9 МЕ/л. Можем ли мы отнести данную пациентку в группу с гипергонадотропным гипогонадизмом и подпадает ли данная пациентка под определение СГЯ? Статья, кроме всего, исходит от группы, поднимающей вопрос о целесообразности триггера в IVM, и объяснить применение ими же триггера, да и гонадотропной стимуляции при невосприимчивости (резистентности) яичников, затруднительно. Второй пациентке проведено 6 циклов IVM с рождением 3 детей. Пациентке 23 лет с вторичной аменореей, ЧАФ 50, АМГ 2,88 мкг/л и ФСГ 60 МЕ/л в первом протоколе IVM применяли подготовку эндометрия с использованием 17β-эстрадиола и введением 10 000 МЕ ХГЧ при достижении определенной толщины эндометрия. При трансвагинальной пункции было получено 14 ОКК. На момент трансвагинальной пункции уровень эстрадиола в крови составил 63 нг/л. В результате IVM 3 из 14 ооцитов достигли стадии МII, и 1 трехдневный эмбрион был перенесен в свежем цикле с успешными родами. В следующем цикле IVM проводилась самостоятельно без применения каких-либо препаратов. При трансвагинальной пункции получено 5 ооцитов, 3 MII и на 3-й день было заморожено 2 эмбриона. В результате криопереноса 1 эмбриона произошли преждевременные роды двойней на 31-й неделе.
В 2019 г. Flageole C. et al. [5] в J. Assist. Reprod. Genet. опубликовали данные о рождении ребенка у матери с СРЯ при помощи IVM. Женщина с первичным бесплодием, уровнем ФСГ 55 МЕ/л, ЛГ 33 МЕ/л, АМГ 3,24 нг/мл, ЧАФ на 5-й день 19, с рядом фолликулов диаметром до 18 мм. При генетическом анализе полиморфизма генов рецепторов ФСГ было обнаружено 2 гетерозиготных варианта гена рецептора ФСГ. В течение 16 дней пациентке проводили введение менотропинов, начиная с дозировки 300 МЕ с увеличением до 600 МЕ. В связи с отсутствием реакции яичников на овариальную стимуляцию (диаметр фолликулов менее 10 мм) с 17-го дня одновременно с отменой приема гонадотропинов начали прием перорального эстрадиола в дозировке 4 мг/день. При достижении толщины эндометрия 8 мм введена инъекция ХГЧ 10 000 МЕ с проведением трансвагинальной пункции через 36 ч. Терапию прогестероном начали со дня оплодотворения ооцитов. При трансвагинальной пункции было получено 6 ОКК; после проведения IVM 3 ооцита достигли стадии MII, еще 1 ооцит достиг стадии MII при дополнительном культивировании 3 оставшихся незрелых ооцитов. В полость матки был перенесен 1 эмбрион лучшего качества на 3-и сутки, остальные эмбрионы остановились в развитии на 4-е сутки после оплодотворения. На 14-й день после переноса эмбриона уровень ХГЧ составил 247 Ед/л. Итогом всего стало рождение здорового мальчика через естественные родовые пути массой 2885 г.
В большинстве случаев при IVM авторы применяли введение хорионического гонадотропина человека (ХГЧ) и гонадотропинов. Гонадотропиновый прайминг используется в IVM для подготовки эндометрия и роста фолликулов до 12–13 мм [18]. Остается не вполне понятным использование ФСГ у женщин с резистентностью к гонадотропинам. У женщин с СРЯ в яичниках лоцируются малые антральные фолликулы с отсутствием экспрессии ЛГ-рецепторов. В связи с этим также непонимание вызывает применение триггера финального созревания ооцитов (ХГЧ) у женщин с СРЯ в приведенных работах.
В настоящее время имеются данные о рождении нескольких тысяч детей при помощи IVM при различных клинических ситуациях, чаще связанных с синдромом поликистозных яичников. Технология IVM применяется во многих клиниках, ее клинические и биологические аспекты хорошо изучены [20].
Заключение
IVM можно рассматривать как эффективный метод преодоления бесплодия у пациенток с гипергонадотропной недостаточностью яичников, нормальным овариальным резервом и резистентностью к гонадотропинам. Приведенные в статье случаи рождения здоровых детей говорят о том, что полученные при IVM ооциты и эмбрионы у пациенток с СРЯ способны к мейотическому и митотическому делению, оплодотворению и в конечном итоге к рождению здорового ребенка. Метод IVM необходимо рекомендовать при ситуации с резистентностью яичников. Наш опыт и данные международных публикаций позволяют предполагать отсутствие необходимости предварительной гонадотропной стимуляции и триггера перед проведением процедуры IVM. Необходимо накопление опыта при проведении IVM у данной группы пациенток.



