Репродуктивным возрастом женщины называется период, в течение которого она способна к вынашиванию и рождению ребенка, в котором отдельно выделяется поздний репродуктивный возраст (ПРВ). За последние годы доля первородящих женщин ПРВ значительно возросла. На сегодняшний день средний возраст рождения первого ребенка для женщин на 3,5 года больше, чем три десятилетия назад [1].
Пациентки ПРВ имеют ряд особенностей, усложняющих реализацию репродуктивной функции, по сравнению с пациентками раннего репродуктивного возраста. У женщин старше 35 лет происходит постепенное снижение овариального резерва. После 40 лет скорость атрезии фолликулов увеличивается вдвое [2, 3]. И даже при сохранном овариальном резерве у пациенток старше 35 лет увеличивается риск анеуплоидии ооцитов и, как следствие, эмбрионов, что также снижает вероятность наступления беременности. Кроме того, женщины ПРВ имеют более высокую соматическую и гинекологическую заболеваемость [4]. Все это снижает шансы наступления как спонтанной беременности, так и беременности, полученной в результате вспомогательных репродуктивных технологий (ВРТ).
Некоторые исследователи считают, что возраст женщины старше 40 лет является однозначным показанием для лечения бесплодия с помощью ВРТ [5]. Однако в группе пациенток ПРВ эффективность программ ВРТ не превышает 10%, а вероятность наступления беременности снижается на 4,7% из расчета на каждый год жизни женщины старше 30 лет [6].
Преимплантационный генетический скрининг (ПГС) является методом, предотвращающим перенос эмбрионов с аномальным числом хромосом (анеуплодии и числовое нарушение кариотипа) [7].
Благодаря этому методу диагностики возможно производить отбор генетически полноценных эмбрионов, что, в свою очередь, ведет к увеличению частоты наступления беременности, уменьшению репродуктивных потерь и снижению риска рождения детей с генетическими нарушениями.
В качестве методов исследования для ПГС в настоящее время используют флуоресцентную гибридизацию in situ (FISH, от англ. – fluorescent in situ hybridization) и метод сравнительной геномной гибридизации (англ. аCGH – array comparative genomic hybridization). Каждый из этих методов имеет ряд преимуществ и недостатков [8, 9]. При этом, в настоящее время окончательно не определена роль ПГС у пациенток позднего репродуктивного возраста.
Целью исследования было изучение эффективности программ ВРТ при применении ПГС у пациенток позднего репродуктивного возраста.
Материал и методы исследования
В проспективное когортное исследование были включены 160 супружеских пар, обратившихся для лечения бесплодия с помощью ВРТ в период с 2015 г. по 2017 г., с отсутствием противопоказаний к проведению экстракорпорального оплодотворения (ЭКО), и подписанным информированным согласием на участие в исследовании. Возраст пациенток был в диапазоне от 23 до 47 лет. Критериями включения явились нормальный кариотип обоих супругов, фертильная/субфертильная сперма супруга, индекс массы тела пациенток от 19 кг/м2 до 29,9 кг/м2, отсутствие привычного невынашивания беременности в анамнезе (>2 потерь беременности в сроке до 22 недель гестации), проведение интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ), селективный перенос одного эмбриона. Критериями исключения явилось использование донорских гамет или суррогатного материнства, наличие противопоказаний к проведению ЭКО.
Пациенты были стратифицированы на две группы: группу 1 составили 87 пациенток, которым была проведена программа ЭКО без ПГС. Группу 2 составили 73 пациентки, которым была проведена программа ЭКО с ПГС, из них группа 2а – 31 пациентка с ПГС методом аCGH, группа 2б – 42 пациентки с ПГС методом FISH.
Все включенные в исследование супружеские пары были обследованы согласно приказу Минздрава России № 107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [10].
Стимуляция функции яичников проводилась по протоколу с антагонистами гонадотропин рилизинг-гормона препаратами рекомбинантного фолликулостимулирующего гормона, комбинированного препарата рекомбинантного фолликулостимулирующего и лютеинизирующего гормона, или человеческого менопаузального гонадотропина. Доза препарата подбиралась индивидуально в зависимости от возраста пациентки, уровня антимюллерова гормона и числа антральных фолликулов по данным ультразвукового исследования (УЗИ). После проведения УЗИ производилась коррекция дозы препаратов гонадотропинов.
Триггер овуляции вводился при достижении лидирующими фолликулами диаметра 17 мм. В качестве триггера овуляции использовался человеческий хорионический гонадотропин (ХГЧ) в дозе 8000–10 000 МЕ, а при риске развития синдрома гиперстимуляции яичников – агонист гонадотропин рилизинг-гормона в дозе 0,2 мг, или сочетание агониста гонадотропин рилизинг-гормона с низкими дозами ХГЧ (1500 МЕ).
Трансвагинальная пункция яичников осуществлялась через 36 часов после введения триггера овуляции. Все зрелые ооциты подвергались оплодотворению методом ИКСИ. Морфологическую оценку эмбрионов проводили на 3-е и 5-е сутки после трансвагинальной пункции яичников согласно классификации Gardner и соавт. [11].
Все бластоцисты хорошего качества подвергались криоконсервации на 5-е сутки культивирования, во всех случаях перенос эмбрионов осуществлялся в криоциклах. Подготовка эндометрия для переноса криоконсервированных эмбрионов проводилась с использованием заместительной гормональной терапии под ультразвуковым контролем (эстрадиола валерата в дозе 8 мг/сутки с 4–5-го дня менструального цикла, микронизированного прогестерона 400–600 мг/сутки с 15–16-го дня менструального цикла). Перенос эмбрионов производили на 20–21-й день цикла, размораживание эмбрионов осуществляли согласно принятым в клинической практике протоколам.
Через 14 дней после переноса эмбриона в полость матки определялась концентрация β-субъединицы ХГЧ в сыворотке крови пациентки. Тест на беременность считался положительным, если уровень β-субъединицы ХГЧ составлял более 20 МЕ/л. Через 21 день после переноса эмбриона проводилась диагностика клинической беременности при визуализации плодного яйца в полости матки.
ПГС методом аCGH осуществляли путем биопсии клеток трофэктодермы бластоцисты на 5–6-й день культивирования эмбрионов с использованием оборудования фирмы Agilent (США). Полногеномная амплификация ДНК исследуемых бластомеров проводилась с помощью набора PicoPlex SingleCell WGA Kit (Rubicon Genomics, США). Интерпретация полученных результатов проводилась с помощью программного продукта Agilent CytoGenomics.
ПГС методом FISH состоял из 3-х этапов: биопсии одного бластомера на 3-е сутки, фиксации исследуемых клеток на предметном стекле, а затем молекулярно-цитогенетической диагностики единичных клеток. Гибридизация для определения 5 исследуемых хромосом (13, 18, 21, X, Y) с использованием зондов фирмы ABBOT (Vysis) проводилась в соответствии с протоколом, рекомендуемым фирмой-производителем [12].
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста или теста Манна–Уитни для сравнения средних величин. Мерой ассоциации для сравнения бинарных данных было отношение шансов (ОШ) с доверительным интервалом 95% (95% ДИ). Метод логистической регрессии с расчетом площади под кривой (AUC – от англ. – Area Under the Curve) использовался при расчете скорректированного ОШ (ОШкор) для контроля множественных конфаундеров. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Исследование было одобрено комиссией по этике ФГБУ НМИЦ АГП им. акад. В.И. Кулакова Минздрава России.
Результаты исследования
У пациенток группы 1 по сравнению с группой 2 чаще отмечали миома матки и меньшее число беременностей за счет меньшего числа самопроизвольных выкидышей, которые были учтены в качестве конфаундеров, влияющих на исход беременности. Не выявляли значимой разницы в возрасте, индексе массы тела пациенток, менструальной функции, а также соматической заболеваемости. Частота назначения различных гонадотропинов, дозы вводимых гонадотропинов и частота назначения различных триггеров овуляции была сопоставимой в обеих группах пациенток (таблица).
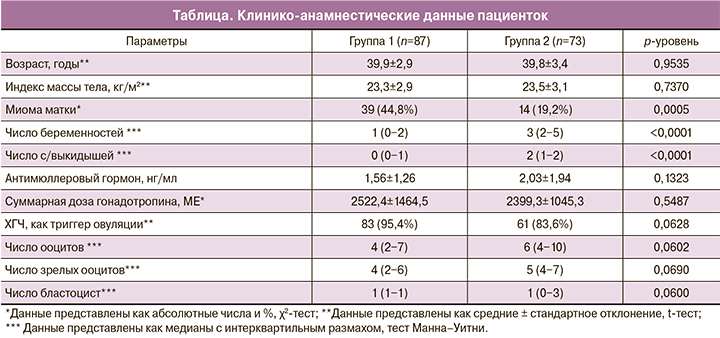
У пациенток ПРВ без ПГС по сравнению с пациентками ПРВ с ПГС отмечали значимо меньшая частота беременностей и живорождений. Клиническая беременность наступила у 20 из 87 пациенток в группе 1 (22,9%) и у 28 из 73 пациенток в группе 2 (38,4%) (р=0,0346). Роды произошли у 18 пациенток (20,7%) в группе 1 и у 25 пациенток (34,2%) в группе 2 (р=0,0440) (рис. 1).
 Далее проводили многофакторный анализ оценки шансов наступления беременности и живорождения в программах ВРТ у пациенток групп 1 и 2. Для этого проанализировали влияние выявленных потенциальных конфаундеров на вероятность наступления беременности и живорождения. Ни один из потенциальных конфаундеров не оказывал влияния на исход программ ВРТ при сравнении данных групп пациенток. ОШ наступления беременности в программе ЭКО у пациенток ПРВ, прошедших ПГС, по сравнению с пациентками ПРВ, не прошедших ПГС, составило 2,1 (95% ДИ=1,04; 4,2), ОШ живорождения составила 2,0 (95% ДИ=0,98; 4,1).
Далее проводили многофакторный анализ оценки шансов наступления беременности и живорождения в программах ВРТ у пациенток групп 1 и 2. Для этого проанализировали влияние выявленных потенциальных конфаундеров на вероятность наступления беременности и живорождения. Ни один из потенциальных конфаундеров не оказывал влияния на исход программ ВРТ при сравнении данных групп пациенток. ОШ наступления беременности в программе ЭКО у пациенток ПРВ, прошедших ПГС, по сравнению с пациентками ПРВ, не прошедших ПГС, составило 2,1 (95% ДИ=1,04; 4,2), ОШ живорождения составила 2,0 (95% ДИ=0,98; 4,1).
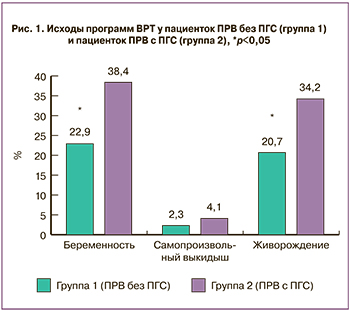
У пациенток, которым проводили ПГС на 5-е сутки, было зарегистрировано значимо больше клинических беременностей (15 случаев, 48,4%) по сравнению с пациентками, которым проводили ПГС на 3-и сутки (13 случаев, 30,9%), или не проводили ПГС (20 случаев, 22,9%) (р=0,0030). ОШ наступления беременности при применении ПГС методом аCGH на 5-е сутки в группе пациенток ПРВ составила 3,1 (95% ДИ 1,2; 8,1). Живорождение было зарегистрировано у 14 пациенток (45,2%) группы 2а, 11 пациенток (26,2%) группы 2б и 18 пациенток группы 1 (20,7%) (р=0,0310). ОШ живорождения при применении ПГС методом аCGH на 5-е сутки у пациенток ПРВ составила 3,1 (95% ДИ 1,3; 7,6) (рис. 2).
Для поиска порогового возраста максимальной эффективности ЭКО с ПГС проводили стратификационный анализ эффективности ЭКО с ПГС у пациенток различных возрастных групп. Выявили, что у пациенток 40 лет и старше шансы наступления беременности и живорождения снижались в 2,6 раз при проведении ПГС (ОШ=2,6; 95% ДИ=1,05;6,4) (рис. 3).
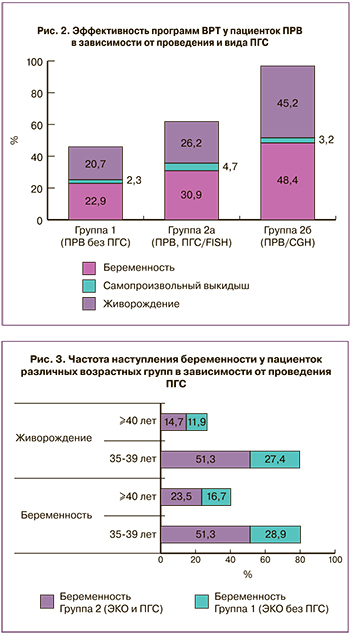 Таким образом, оптимальным для проведения ПГС был возраст от 36 до 39 лет. По-видимому, неэффективность ЭКО с ПГС у пациенток старше 40 лет была связана, во-первых, с малым числом полученных эмбрионов и отменой переноса эмбриона после ПГС по причине выявления анеуплоидии, а, во-вторых, с маточным фактором бесплодия вследствие многочисленных выскабливаний полости матки после неудачных беременностей. Действительно, у пациенток ПРВ 40 лет и старше отмечали значимо большее число беременностей за счет искусственных абортов по сравнению с пациентками 36−39 лет (2 (1−4) и 1 (0-3) для общего числа беременностей (р=0,0348), и 2 (0−3) и 1 (0−2) для общего числа самопроизвольных выкидышей и искусственных абортов в анамнезе (р=0,0071) для групп старше и младше 40 лет соответственно). Из 73 пациенток группы 2 (с ПГС) 34 пациентки были в возрасте 40 лет и старше, а 39 пациенток были в возрасте 36–39 лет. У пациенток старше 40 лет отмена переноса эмбриона по причине выявления анеуплоидии всех эмбрионов была зарегистрирована у 16 из 34 пациенток (47,0%), а у пациенток 36–39 лет – лишь у 8 из 39 пациенток (20,5%) (р=0,0180).
Таким образом, оптимальным для проведения ПГС был возраст от 36 до 39 лет. По-видимому, неэффективность ЭКО с ПГС у пациенток старше 40 лет была связана, во-первых, с малым числом полученных эмбрионов и отменой переноса эмбриона после ПГС по причине выявления анеуплоидии, а, во-вторых, с маточным фактором бесплодия вследствие многочисленных выскабливаний полости матки после неудачных беременностей. Действительно, у пациенток ПРВ 40 лет и старше отмечали значимо большее число беременностей за счет искусственных абортов по сравнению с пациентками 36−39 лет (2 (1−4) и 1 (0-3) для общего числа беременностей (р=0,0348), и 2 (0−3) и 1 (0−2) для общего числа самопроизвольных выкидышей и искусственных абортов в анамнезе (р=0,0071) для групп старше и младше 40 лет соответственно). Из 73 пациенток группы 2 (с ПГС) 34 пациентки были в возрасте 40 лет и старше, а 39 пациенток были в возрасте 36–39 лет. У пациенток старше 40 лет отмена переноса эмбриона по причине выявления анеуплоидии всех эмбрионов была зарегистрирована у 16 из 34 пациенток (47,0%), а у пациенток 36–39 лет – лишь у 8 из 39 пациенток (20,5%) (р=0,0180).
Обсуждение
В проведенном исследовании установили, что проведение ПГС у пациенток ПРВ увеличивает шансы беременности и живорождения в 2 раза по сравнению с его отсутствием. Известно, что доля ооцитов и, соответственно, эмбрионов с различными видами анеуплоидии прогрессивно увеличивается с возрастом и может достигать 100% у женщин старше 45 лет [13]. Исследование полярных тел методом аCGH у зигот пациенток ПРВ показало, что доля зигот с анеуплоидиями составила 65,5% [14]. При этом более высокий уровень анеуплоидий, достигающий 72%, был зарегистрирован у женщин ПРВ старше 40 лет [15]. Известно, что 95% случаев трисомии 21 хромосомы, приводящей к развитию синдрома Дауна, вызваны ошибками материнского мейоза [16], также как и синдрома Патау (трисомия 13), который в 67% случаях является следствием материнских ошибок мейоза первого деления, или синдрома Эдвардса (трисомия 18), который чаще всего возникает при ошибках материнского мейоза второго деления [17].
Именно из-за высокого риска развития анеуплоидии эмбрионов у пациенток ПРВ применяется ПГС. Благодаря этому методу существует возможность производить отбор генетически полноценных эмбрионов, что, в свою очередь, приводит к увеличению частоты наступления беременности, уменьшению репродуктивных потерь и снижению риска рождения детей с генетическими нарушениями.
На настоящий момент данные о влиянии ПГС на эффективность программ ЭКО противоречивы. Наши данные не согласуются с данными Hardarson и соавт. (2008), которые получили доказатьства в пользу отсутствия увеличения частоты наступления беременности у женщин ПРВ при проведении ПГС [18], и данными Mersereau и соавт. (2008), которые не выявили клинико-экономическую эффективность ПГС у женщин 38–40 и старше 40 лет [19]. При этом наши данные согласуются с данными Hsiao-Ling Lee и соавт. (2014), которые выявили, что частота живорождения на каждый перенесенный эмбрион после криоконсервации с использованием ПГС у женщин ПРВ была выше (45,5%), чем у женщин, которым проводили перенос после криоконсервации без ПГС (19,0%), или проводили ЭКО в естественном цикле без ПГС (15,8%) [20], и данными Yang и соавт. и Scott и соавт., которые доказали эффективность ПГС в результате проведенного рандомизированного клинического исследования [21].
Во-вторых, в ходе проведенного исследования был выявлен пороговый возраст эффективности ЭКО с ПГС, который составил 40 лет. Мы объясняем снижение эффективности ЭКО с ПГС в 2,6 раза у пациенток 40 лет и старше малым числом полученных эмбрионов и отменой переноса эмбриона после ПГС вследствие выявленной анеуплоидии, а также маточным фактором бесплодия вследствие многочисленных выскабливаний полости матки после неудачных беременностей. Наши данные не согласуются с данными, полученными A.C. Cobo и соавт. (2010) [22]. У пациенток 38–39 лет без применения ПГС был отмечен более высокий процент наступления беременности, по сравнению с этой же возрастной группой с ПГС. При этом у пациенток 41–44 лет в группе с ПГС наблюдался больший процент наступления беременности, чем среди тех, кому ПГС не проводился. А некоторые авторы в своих исследованиях показали, что вероятность имплантации эуплоидных эмбрионов после ПГС не зависит от возраста матери [23].
Полученные различия в эффективности ПГС у женщин разных возрастных подгрупп можно объяснить несколькими факторами. Мы проводили ПГС как методом aCGH, так и методом FISH. При этом оценка эффективности ЭКО с ПГС проводилась суммарно. При исследовании различных методов ПГС для улучшения результатов программ ВРТ было выявлено, что ПГС методом aCGH на 5-е сутки в группе пациенток ПРВ, в отличие от ПГС методом FISH, увеличивал шансы наступления беременности и живорождения в 3,1 раза. Это связано с тем, что, с одной стороны, при биопсии бластомера на 3-й день культивирования и исследовании методом FISH может быть недооценено общее количество нормальных эмбрионов. Полиморфизмы, кросс гибридизация, расщепления сигналов могут быть выявлены при исследовании методом FISH в ядрах хорошего качества, что может привести за собой ошибочный диагноз в ядрах не очень хорошего качества. В исследовании Colls и соавт. было проанализировано более 30 000 эмбрионов. Однако у 7,5% исследуемых клеток, взятых от данных эмбрионов, не удалось выявить точный диагноз для одной или более из 9 анализируемых хромосом (X, Y, 13, 15, 16, 17, 18, 21 и 22), что не позволило отнести эмбрионы к нормальным. Из-за отсутствия точного диагноза данные эмбрионы рассматривались как неинформативные [24]. В другом исследовании Magli и соавт. (2010) процент анеуплоидий для 1 и 4 хромосом (обычно не включаемых в панель исследования методом FISH) был сравним с исследуемыми 15, 16, 21 и 22 хромосомами, что могло быть причиной неудачи ЭКО [25]. Есть вероятность того, что процент нетестируемых методом FISH хромосом может быть выше в подгруппе пациенток старше 40 лет.
Заключение
Таким образом, в ходе проведенного исследования было выявлено, что у пациенток ПРВ в возрасте 36–39 лет ЭКО/ПГС является методом, позволяющим повысить вероятность наступления беременности и живорождения с помощью отбора эуплоидных эмбрионов. Однако требуются дальнейшие исследования для оценки эффективности данной методики у пациенток старше 40 лет для определения целесообразности назначения ПГС в данной возрастной группе женщин.



