Риск-менеджмент в медицине применяют, чтобы снизить количество различных неблагоприятных последствий. Это касается не только рисков, связанных с оказанием медицинской помощи, но и финансовых, организационных, правовых и многих других. Этими же принципами должны руководствоваться производители медицинских изделий при их разработке (Решение ЕЭК №27 от 12 февраля 2016 г.). В международных стандартах ISO 9001:2015, есть понятие «риск-ориентированное мышление» (англ. risk-based thinking). Это подразумевает, прежде всего, идентификацию, описание и количественную оценку риска. В настоящей статье проводится оценка эффективности применения скрининговых панелей для выявления генетических маркеров с помощью риск-ориентированного анализа.
На территории Российской Федерации существует ряд аутосомно-рецессивных болезней с достаточно высокой частотой заболеваемости, для которых известны генетические маркеры. Особенностью аутосомно-рецессивного типа наследования является то, что заболевание возникает, когда ребенок получает от обоих родителей дефектный вариант ключевого для данного заболевания гена. При этом, чаще всего, оба родителя являются здоровыми гетерозиготными носителями данного генетического дефекта и вероятность рождения больного ребенка у них составляет 25%. Своевременное выявление таких пар позволяет предложить будущим родителям различные репродуктивные стратегии для получения здорового потомства, поэтому преконцепционный генетический скрининг на гетерозиготное носительство маркеров аутосомно-рецессивных наследственных заболеваний является эффективным инструментом первичной профилактики.
Сегодня одной из основных причин ограничений для широкого внедрения преконцепционного генетического скрининга является высокая стоимость исследования. Существенного снижения затрат можно достигнуть, если ограничиться поиском только наиболее часто встречающихся мутаций, характерных для обследуемой популяции. Очевидно, что чем меньше суммарная распространенность редких мутаций, не входящих в скрининговую панель, тем выше эффективность скрининга. Для целей генетического консультирования крайне важна оценка т.н. остаточного риска, т.е. риска того, что пациент после получения отрицательного результата исследования на носительство все еще может являться носителем. Остаточный риск определяется, как полная частота носительства всех патологических вариантов в исследуемой популяции – частота встречаемости маркеров, включенных в панель [1]. Остаточный риск зависит от распространенности исследуемого заболевания в популяции, что, в свою очередь, во многом определяется этническими особенностями. С другой стороны, для многих редких заболеваний не все генетические дефекты могут быть известны, и величина остаточного риска также может меняться с течением времени. Таким образом, этот метод оценки скрининговой панели эффективен в этнически однородной популяции, где распространенность генетических маркеров хорошо известна [2], однако для гетерогенных или малоизученных популяций оценить эффективность скрининговой панели достаточно сложно, т.к. распространенность тех или иных генетических вариантов неизвестна или определена с большой погрешностью.
Альтернативным методом оценки диагностической эффективности скрининга может быть риск-ориентированный подход, подразумевающий количественную оценку остаточного риска. Основы риск-ориентируемого управления отображены в семействе стандартов ISO 31000, которые были разработаны Международной организацией по стандартизации. В данных стандартах дано понятие остаточного риска. Остаточный риск – это риск наступления события, оставшийся после осуществления мероприятий по контролю над рисками [3]. В случае диагностических панелей под мероприятиями мы понимаем проведение скрининга с использованием соответствующей панели.
Общая формула для расчета остаточного риска:
Остаточный риск = Первичный риск - Влияние мероприятий по контролю над рисками.
В случае генетического скрининга первичный риск соответствует вероятности рождения больного ребенка с исследуемым заболеванием в данной популяции, а под мероприятиями мы понимаем проведение скрининга с использованием соответствующей панели. Если принять допущение, что выявление носительства позволяет полностью исключить риск рождения больного ребенка (что достаточно близко к действительности), то остаточный риск будет связан с наличием у обследованных партнеров генетических маркеров, ассоциированных с заболеванием и не выявляемых диагностической панелью. Тогда, исходя из п.3.6.1.6 ISO Guide 73:2009 правомочно использовать термин «уязвимость»* применительно к диагностической панели [3].
Модельное заболевание
Для исследования была выбрана панель для скрининга муковисцидоза в российской популяции. На территории России муковисцидоз в среднем встречается с частотой 1:10000 [4]. Данный показатель может варьировать в зависимости от региона; так в Чувашской Республике частота составляет 4,143 на 10 тыс., а в Кабардино-Балкарии – 0,462 на 10 тыс. [5]. Это системное наследственное заболевание, в основе которого лежат мутации в гене трансмембранного регулятора (CFTR) [6], что приводит к поражению экзокринных желез и характеризуется тяжелыми нарушениями функций органов дыхания, желудочно-кишечного тракта, поджелудочной железы, а также бесплодием у мужчин. Выявление мутаций в гене CFTR у потенциальных родителей позволяет с помощью вспомогательных репродуктивных технологий предотвратить рождение больного ребенка. Данная практика широко распространена в ряде западных стран. К примеру, в США исследование на носительство мутаций гена CFTR предлагается всем лицам репродуктивного возраста, вне зависимости от семейного анамнеза. Эта стратегия скрининга носителей была рекомендована Американским колледжем медицинской генетики и геномики (ACMG) [7] и Американским колледжем акушеров и гинекологов (ACOG) [8]. В свою очередь, европейское общество по муковисцидозу оставляет решение о создании скрининга на носительство на усмотрение отдельных стран [9]. Тест на носительство муковисцидоза предлагается населению в Израиле [10], в некоторых частях Австралии [11] и в Италии [12]. Было установлено, что скрининг носителей на муковисцидоз связан со снижением годовой заболеваемости в Великобритании, Соединенных Штатах и Италии [12–14].
Начиная с 2006 г. в России в рамках реализации национального проекта «Здоровье» проводят неонатальный скрининг для выявления тяжелых наследственных заболеваний, в число которых, помимо муковисцидоза, также входят фенилкетонурия, гипотиреоз, галактоземия и адреногенитальный синдром [15].
Протокол скрининга на муковисцидоз в Российской Федерации включает 4 этапа последовательных диагностических исследований: тест на содержание иммунореактивного трипсина (ИРТ) в крови, повторный тест на ИРТ, потовый тест на содержание ионов хлора (назначается при превышении пороговых значений ИРТ) и ДНК-диагностику [16]. В настоящее время только первые 3 этапа являются обязательными, ДНК-диагностика чаще выполняется при получении неоднозначного результата исследования или невозможности проведения потовой пробы. Тем не менее, определение класса мутаций является одним из факторов, определяющих тяжесть течения заболевания, [17] а подтверждение генотипа позволяет рекомендовать пациентам прицельную фармакогенетическую терапию [17, 18].
Согласно регламенту неонатального скрининга в Российской Федерации, молекулярно-генетическая диагностика при муковисцидозе проводится в несколько этапов. В первую очередь, осуществляется поиск частых мутаций с использованием специфических диагностических панелей, включающих наиболее частые мутации [16, 17, 19]. В случае, если частые мутации не были идентифицированы, проводится секвенирование гена [17, 20].
На данный момент в Российской Федерации не существует программ скрининга на носительство наиболее распространенных мутаций, ассоциированных с муковисцидозом, хотя на рынке имеются различные диагностические панели. Однако, насколько применение этих панелей может снизить риск рождения больного ребенка, не оценивалось. Поэтому целью данного исследования было: установить эффективность скрининговой панели на носительство мутаций в гене CFTR в Российской Федерации с помощью риск-ориентированного подхода.
Материалы и методы
Для экспериментального установления частоты носительства мутаций было проведено генотипирование 1000 здоровых доноров крови, проживающих на территории Российской Федерации. Кровь для исследования была получена в рамках научного исследования «Установление особенностей распределения клинически-значимых генетических маркеров на уровне отдельных нуклеотидов в российской популяции» (2012–2014 гг.), выполняемого на базе ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН и ФГБУ ГНЦ Институт иммунологии ФМБА России. Протокол Этического комитета ФГБУ ГНЦ Институт иммунологии ФМБА России № 8 от 5 сентября 2012 г. Все участники подписали информированное согласие на участие в исследовании. Вся информация для настоящего исследования была деперсонализирована.
Выделение ДНК проводили из 0,1 мл периферической крови при помощи набора реагентов «ПРОБА-ГС-ГЕНЕТИКА» компании «ДНК-Технология» (Москва). Полученные образцы ДНК сразу использовали для генотипирования, либо хранили при -20°С. Определение замен одиночных нуклеотидов проводили методом полимеразной цепной реакции в режиме реального времени (Real Time PCR) с анализом кривых плавления с использованием комплектов реагентов «Генетика наследственных заболеваний. Муковисцидоз Скрин», «Генетика наследственных заболеваний. Муковисцидоз – редкие мутации». Указанные комплекты реагентов позволяют суммарно выявлять 24 мутации в гене CFTR, ассоциированные с развитием муковисцидоза.
Согласно литературным данным, частота встречаемости мутации F508del составляет 51,67%, dele2,3(21kb) – 5,68%, E92K – 2,43%, 3849+10kbC>T – 2,1%, 2143delT – 1,9%, W1282X – 1,82%, 2184insA – 1,8%, N1303K – 1,35%, G542X – 1,18%, L138ins – 1,07%, 1677delTA – 0,95%, 394delTT – 0,82%, R334W – 0,8%, 3821delT – 0,45%, S1196X – 0,33%, 2789+5G>A – 0,33%, 3944delGT – 0,29%, R553X – 0,18%, 621+1G>T – 0,16%, R117H – 0,06%, 604insA – 0,06%, 2183AA>G – 0,04%, K598ins – 0,02%, 3667insTCAA – 0,01%. Суммарная частота мутаций в панели (информативность) составляет 75,5% [5, 21].
В качестве подтверждающего метода проводили выборочное автоматическое секвенирование ДНК по Сэнгеру с применением автоматического секвенатора ABI PRISM 310 Genetic Analyzer (Applied Biosystems, США), использовали реактивы и рекомендации производителя.
Результаты
Во всех случаях были получены идентичные результаты генотипирования при исследовании методом Real Time PCR и методом секвенирования.
Традиционно для скрининговых панелей на носительство рассчитывается доля невыявляемых с помощью панели, мутаций среди всех мутаций, ассоциированных с заболеванием:
V=q-qi (1),
где V – распространенность неопределяемых мутаций; q – распространенность всех мутаций (патологического аллеля); qi – распространенность в популяции мутаций, определяемых панелью.
По сути V является количественной характеристикой уязвимости данной панели. Из закона Харди–Вайнберга
p2+2pq+q2 = 1 (2),
где р – распространенность нормального аллеля.
Соответственно, для аутосомно-рецессивного заболевания с высокой пенетрантностью распространенность заболевания (Р) будет соответствовать популяционной частоте гомозиготных индивидуумов:
P = q2 (3),
где Р – распространенность заболевания.
Исходя из (1)
Р = (V+qi)2 (4).
Распространенность гетерозиготного носительства маркеров заболевания в популяции из (2) и (1) рассчитывается как
H = 2p(V+qi) (5),
где Н – распространенность гетерозиготного носительства маркеров заболевания в популяции.
Исходя из особенностей наследования аутосомно-рецессивных заболеваний (если не рассматривать мутации de novo, что происходит крайне редко) в абсолютном большинстве больной ребенок рождается у пары, где оба партнера являются гетерозиготными носителями генетических маркеров заболевания. Поскольку для большинства редких генетических заболеваний отсутствует ассортативность при формировании пар, вероятность встречи двух гетерозиготных носителей в популяции является сочетанной вероятностью двух независимых событий. Согласно теории вероятности, вероятность одновременного возникновения двух независимых событий составляет произведение их вероятностей. Следовательно, вероятность того, что оба партнера будут гетерозиготными носителями, составляет
Х = H2 = 4p2(V+qi)2 (6),
где Х – вероятность того, что оба партнера в случайной паре будут гетерозиготными носителями маркеров заболевания.
Распространенность заболевания (P) будет зависеть от вероятности встречи двух гетерозиготных носителей (Х) и вероятности рождения больного ребенка в такой паре. Из 2-го закона Менделя вероятность рождения больного ребенка у двух гетерозиготных носителей составляет 0,25, соответственно
P = 0,25X = 0,25H2 = p2(V+qi)2 (7).
Если пациент обследован, и исключены известные мутации, то qi=0, а вероятность гетерозиготного носительства (Hn) будет определяться только вероятностью носительства неизвестных мутаций:
Hn = 2p(V) (8).
Вероятность встречи двух носителей неизвестных мутаций (Хnn) в этом случае составляет
Хnn = Hn2 = 4(pV)2 = 4p2V2 (9),
а вероятность рождения больного ребенка
Pnn = 0,25Xnn = p2V2 (10).
Если обследован только один партнер (и у него исключены известные мутации), вероятность того, что он гетерозиготный носитель маркера заболевания (Hn) будет зависеть от распространенности неопределяемых маркеров (8), а для второго партнера – всех маркеров, т.к. генетический статус второго партнера неизвестен. Для такой пары вероятность того, что оба партнера являются гетерозиготными носителями заболевания (Xn) составит произведение соответствующих вероятностей:
Хn = H×Hn=2p(V+qi)×2p(V) = 4p2V(V+qi) (11),
а вероятность рождения больного ребенка
Pn = 0,25×Xn= p2V(V+qi) (12).
Если при скрининге или на основании анализа родословной установлено гетерозиготное носительство патологического аллеля у одного из партнеров (вероятность носительства составляет 1), то при неизвестном статусе второго партнера риск рождения больного ребенка
Pm = 0,25×1×H = 0,25×2p(V+qi) (13).
А при исключении носительства известных мутаций у второго партнера
Pmn = 0,25×1×2p(V) (14).
В случае выявления гетерозиготного носительства маркеров заболевания у обоих партнеров вероятность рождения больного ребенка (Pmm) составляет 0,25 согласно 2-му закону Менделя.
Указанные формулы расчета остаточного риска рождения больного ребенка (10, 12–14) удобны для популяционных исследований, т.к. распространенность заболевания для большинства популяций известна с высокой точностью [5, 8], а использование дополнительных методов диагностики для выявления мутаций, не входящих в панель, не требуется.
Согласно результатам генотипирования по 24 частым мутациям 1000 здоровых доноров, было выявлено 29 носителей мутаций в гене CFTR. Суммарная распространенность определяемых мутаций составила 2,9%, что является достаточно высоким показателем, по сравнению с ожидаемыми показателями и данными других исследователей [4, 21]. Носительство мутации F508del было обнаружено в 15 случаях, R117H – в 4, N1303K – в 3, 3849+10kbC>T – в 3, dele2,3(21kb) – в 1, E92K – в 1, L138ins – в 1, K598ins – в 1.
Поскольку исследование проводили с использованием выборочных данных, проекция результатов на генеральную совокупность должна содержать элемент неточности выборочной оценки. Доверительный интервал (ДИ) представляет собой меру точности оцениваемого параметра. Таким образом, истинное значение распространенности мутаций, определяемых панелью, будет лежать в диапазоне от qimin до qimax.
Чаще всего для расчета доверительного интервала доли признака используется метод Вальда, однако его применение связано с существенными ограничениями. Метод не рекомендуется при малых объемах выборок, а также в случаях, когда частота встречаемости признака стремится к 0 или 1 (менее 25% или более 75%), при доле равной 0 или 1 расчет по этому методу вообще невозможен [22]. Более универсален метод Уилсона, который позволяет оценить доверительные интервалы для очень малых и очень больших частот и применим для выборок малого объема. В нашем случае ДИ (qimin–qimax) – распространенность выявляемых носителей в популяции, рассчитанная по методу Уилсона, составляет 2,0–4,1%.
Поскольку уязвимость панели тем больше, чем меньше мутаций она выявляет (1), то с позиции менеджмента рисков мы должны рассматривать наихудший сценарий, т.е. нижнюю границу ДИ частоты выявленных носителей (qimin), соответствующую максимальной уязвимости. Тогда уязвимость предложенной панели с 95% вероятностью составит не более, чем 100-(2,0/2,9)=31%. Полученная оценка достаточна близка к величине уязвимости, теоретически рассчитанной исходя из распространенности включенных мутаций (24,5%).
Следует заметить, что границы 95% ДИ не являются симметричными, и асимметрия тем больше, чем ближе к краю шкалы располагается оцениваемое значение доли. В нашем случае погрешность верхней оценки частоты выявленных носителей (соответствующая минимальной уязвимости) гораздо больше, чем погрешность нижней оценки (соответствующая максимальной уязвимости), поэтому уязвимость панели, рассчитанная по верхней оценке (qimax), получится меньше 0, что невозможно исходя из физического смысла данной величины. Таким образом, предложенный метод оценки уязвимости скрининговой панели может быть использован для оценки только верхней границы ДИ уязвимости, что достаточно для менеджмента рисков и может быть использовано для сравнительных исследований дизайна «не хуже чем».
Согласно полученным данным частоты носительства (29/1000=0,029) и информативности панели (0,755), остаточный риск носительства после прохождения скрининга будет равен 0,029×(1-0,755)= 0,007105 ≈ 1/140, а рассчитанный с помощью риск ориентированного подхода с поправкой на неопределенность – не более 0,029×0,31 ≈ 1/112.
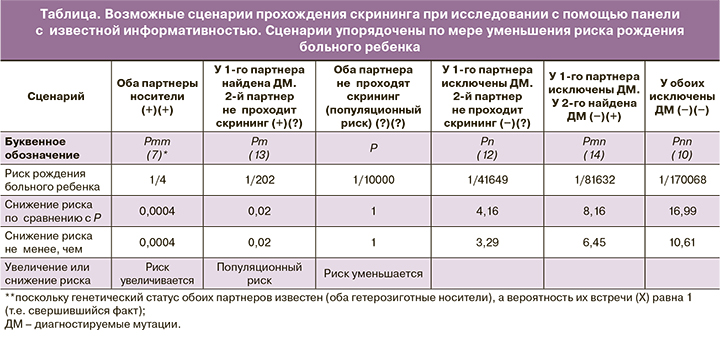
Кроме того, благодаря выведенным выше формулам, можно рассчитать риск рождения больного ребенка при всех возможных сценариях прохождения скрининга партнерами (таблица).
Заключение
В ходе исследования было обнаружено 29 носителей мутаций из 1000 здоровых индивидов по 24 частым мутациям в гене CFTR. Суммарная частота мутаций в используемой панели (информативность), по литературным данным, составила 75,5%. При использовании указанной панели в случае исключения носительства мутаций в гене CFTR у обоих партнеров можно снизить риск рождения больного ребенка в 17 раз, по сравнению с общепопуляционным риском, и риск рождения больного ребенка в данном случае будет составлять всего 1/170068.
Использование риск-ориентированного подхода позволило оценить, что уязвимость используемой панели с 95% вероятностью составляет не более, чем 31%, что достаточно близко к теоретически рассчитанной уязвимости панели, рассчитанной исходя из распространенности включенных мутаций. Подобный подход к оценке эффективности скрининговых панелей может быть использован в любой смешанной популяции, для которой известна заболеваемость, что актуально, в том числе и для Российской популяции.
Оценка уязвимости скрининговой панели является важной составляющей анализа эффективности затрат на проведение скрининга (Cost Effective Approach), что позволит обосновать целесообразность генетического скрининга различных аутосомно-рецессивных заболеваний.



