Известно, что для достижения беременности необходимо сочетание двух факторов: наличия эуплоидного эмбриона хорошего качества и рецептивного эндометрия с высоким потенциалом имплантации эмбриона [1]. Наследственная и приобретенная тромбофилия могут быть причиной привычного выкидыша и других осложнений беременности, таких как преэклампсия, задержка роста плода и мертворождение [2, 3, 4]. Возможным механизмом развития осложнений беременности при наличии тромбофилии является тромбоз сосудов плаценты, эндотелиопатия и воспаление, которые могут вызвать нарушение кровоснабжения и функции плаценты [5]. По аналогичному пути может нарушаться ранняя имплантация эмбриона и плацентация в программах вспомогательных репродуктивных технологий (ВРТ). Ряд исследований подтверждает влияние тромбофилии на исход программ ВРТ [6, 7, 8], тогда как в других исследованиях данная взаимосвязь не была доказана [9]. Влияние персистенции антифосфолипидных антител (АФА) на исходы программ ВРТ также является недоказанным. Ряд исследований отрицает роль АФА в снижении частоты наступления беременности (ЧНБ) в программах ВРТ [10]F. В других исследованиях были получены результаты, свидетельствующие о связи персистенции АФА и ЧНБ [11, 12], при этом особое внимание авторы обращают на так называемые некритериальные АФА. Причинами снижения ЧНБ на фоне персистенции АФА в программах ВРТ могут быть эндотелиопатия и тромбоз сосудов микроциркуляции в месте инвазии трофобласта по аналогии с патогенезом развития больших акушерских синдромов, а также непосредственное воздействие АФА на клетки трофобласта. Так, АФА могут вытеснять защитный слой аннексина V на поверхности трофобласта, что приводит к нарушению его структурной целостности, инициировать апоптоз в клетках трофобласта, нарушать пролиферацию, инвазивность, экспрессию молекул адгезии и секрецию хорионического гонадотропина (ХГ), вызывать развитие провоспалительной реакции: выработку провоспалительных цитокинов и активацию системы комплемента, что приводит к торможению роста трофобласта [5, 13]. Поэтому комплексное исследование системы гемостаза у пациенток с персистенцией АФА является актуальным. Дебаты по поводу роли тромбофилии в эффективности программ ВРТ усиливаются благодаря появляющимся данным о влиянии тромбопрофилактики на повышение ЧНБ у пациенток с повторными неудачами программ ВРТ в анамнезе [14, 15, 16].
Целью исследования было выявление связи между ЧНБ в программах ВРТ и персистенцией АФА.
Материалы и методы
В ретроспективное исследование случай-контроль было отобрано 97 супружеских пар, обратившихся для лечения бесплодия с помощью ВРТ в период с 2016 г. по 2018 г., с отсутствием противопоказаний к проведению программ ВРТ и подписанным информированным согласием на участие в исследовании. Пары были стратифицированы на группы в отношении 1:2 в зависимости от наступления беременности в данной программе овариальной стимуляции и переноса эмбриона (ПЭ). Пары случай-контроль подбирались на основании уравновешивания по 2 признакам: врачу акушеру-гинекологу и врачу-эмбриологу, выполнявшим данную программу. Были сформированы 2 группы пациенток: группа 1 – 30 пациенток с наступившей беременностью и группа 2 – 67 пациенток, у которых беременность не наступила.
Критериями включения явились: нормальный кариотип обоих супругов, возраст пациенток от 18 до 40 лет, индекс массы тела (ИМТ) от 18 до 29,9 кг/м2. Критериями исключения явились: наличие противопоказаний к ВРТ, выраженная патоспермия у партнера, использование донорских гамет или суррогатного материнства, снижение овариального резерва, «бедный» ответ на овариальную стимуляцию, отсутствие бластоцист для переноса в полость матки в данном протоколе овариальной стимуляции, а также развитие осложнений ВРТ в изучаемом цикле.
Перед включением в программу ВРТ все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению» [17]. Овариальная стимуляция проводилась с применением препаратов рекомбинантного фолликулостимулирующего гормона (рФСГ) или комбинированного препарата ФСГ и лютеинизирующего гормона (ЛГ) и назначением антагонистов гонадотропин-рилизинг-гормона. Триггер овуляции ХГ в дозе 8000–10 000 МЕ вводился при наличии лидирующих фолликулов диаметром 18 мм и более. Трансвагинальная пункция яичников (ТВП) осуществлялась через 36 ч после введения триггера овуляции.
Оплодотворение ооцитов осуществлялось методом экстракорпорального оплодотворения (ЭКО) или, по показаниям, интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Морфологическую оценку эмбрионов проводили на 5-е сутки после ТВП согласно классификации Gardner et al. [1].
ПЭ в полость матки осуществлялся на 5-е сутки после ТВП в нативном цикле. В полость матки переносили одну бластоцисту хорошего или отличного качества. Ведение посттрансферного периода осуществлялось по единому протоколу.
Беременность подтверждали при подъеме уровня сывороточного β-ХГ и визуализации плодного яйца в полости матки при ультразвуковом исследовании через 21 день после ПЭ.
В сыворотке (плазме) крови определяли антитела классов M и G к кардиолипину (КЛ) и β2-гликопротеину-I (β2-ГП-1), отнесенные к критериям АФС, принятым в настоящее время [18], а также некритериальные антитела к аннексину V, фосфатидилсерину (ФС) и фосфатидилэтаноламину (ФЭ). Определение проводили с помощью иммуноферментного анализа с использованием наборов фирм ORGENTEC Diagnostika GmbH и IBL International GmbH (Германия) дважды: до овариальной стимуляции и через 8–12 недель.
Волчаночный антикоагулянт (ВА) в плазме крови определяли на автоматическом коагулометре SYSMEX CA-1500 (Япония) с использованием реагентов Siemens Healthcare Diagnostics Products GmbH (Германия) дважды: до овариальной стимуляции и через 8–12 недель после стимуляции.
Комплексное исследование системы гемостаза проводилось трижды: до овариальной стимуляции, в день ТВП и в день ПЭ с помощью теста тромбодинамики (ТД). ТД оценивали на диагностической лабораторной системе «Регистратор тромбодинамики Т-2» (ООО «Гемакор», Россия). Оцениваемые параметры ТД: начальная скорость образования сгустка (Vi, мкм/мин), скорость роста сгустка (V, мкм/мин), размер фибринового сгустка через 30 минут (Cs, мкм), формирование спонтанного сгустка в объеме плазмы крови, не контактирующем с активирующей поверхностью вставки (T).
Статистический анализ
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста или теста Манна–Уитни для сравнения средних величин. Мерой ассоциации для сравнения бинарных данных было скорректированное по конфаундерам отношение шансов (ОШкор), рассчитанное с помощью метода логистической регрессии. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты и обсуждение
При анализе клинико-лабораторных и эмбриологических параметров пациентов было выявлено, что пары, у которых беременность наступила, были младше, и им чаще назначали препараты рФСГ для овариальной стимуляции. Остальные параметры не отличались значимо между группами (табл. 1). Данные факторы были учтены при проведении многофакторного анализа по оценке влияния АФА на эффективность программ ВРТ.
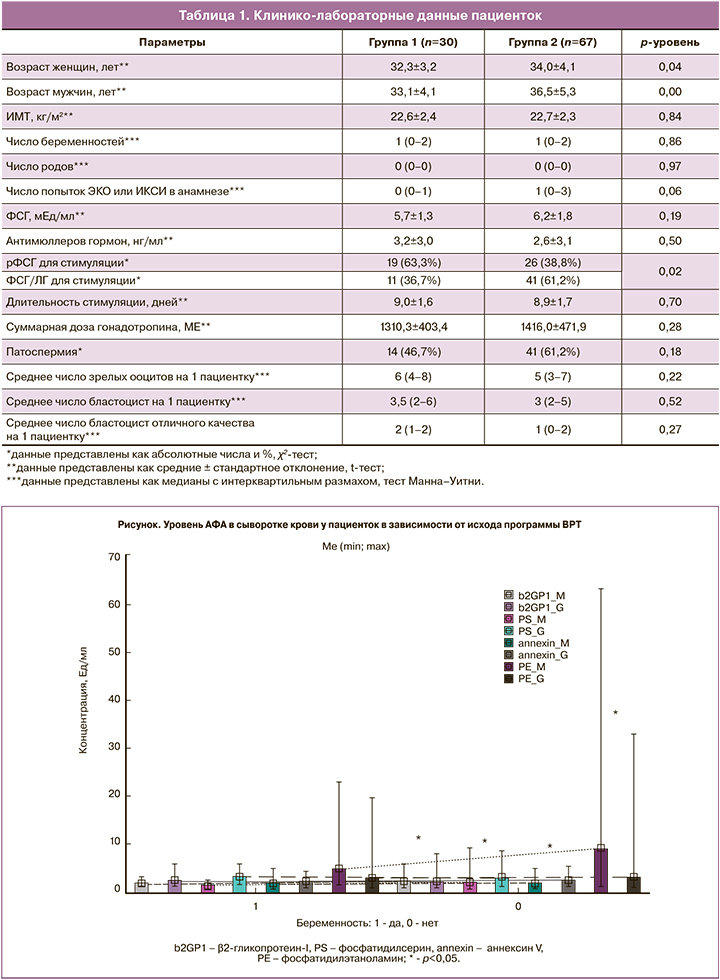
При исследовании уровня АФА было выявлено, что у пациенток группы 2 чаще отмечалось значимое повышение уровня критериальных (к β2-ГП-1) и некритериальных антител класса М (к ФС, ФЭ и аннексину V) (рисунок). В нашем исследовании мы сделали допущение о приравнивании наличия не только критериальных, но и некритериальных АФА к тромбофилии, учитывая, что при акушерском антифосфолипидном синдроме критериальные антитела часто остаются в пределах нормативных значений.
У 18 пациенток уровень АФА выше референсных значений был выявлен дважды с интервалом в 8–12 недель: у 2 пациенток группы 1 (6,7%) и у 16 пациенток группы 2 (23,9%) (р=0,04). При этом отмечалась персистенция некритериальных антител – к ФС, ФЭ и аннексину V с конверсией IgM на IgG.
При проведении многофакторного анализа по влиянию персистенции АФА на ЧНБ в программах ВРТ с учетом возраста пациентов, типа гонадотропина для овариальной стимуляции в качестве конфаундеров ОШкор составил 4,34 (95% ДИ 1,04–20,22). То есть при персистенции АФА шансы наступления беременности в программах ВРТ снижались в 4,34 раза.
При комплексной оценке системы гемостаза с помощью теста ТД в зависимости от наступления беременности не было выявлено значимой разницы. Однако при проведении корреляционного анализа между уровнем АФА и параметрами ТД были выявлены следующие значимые корреляционные связи большой силы (табл. 2).
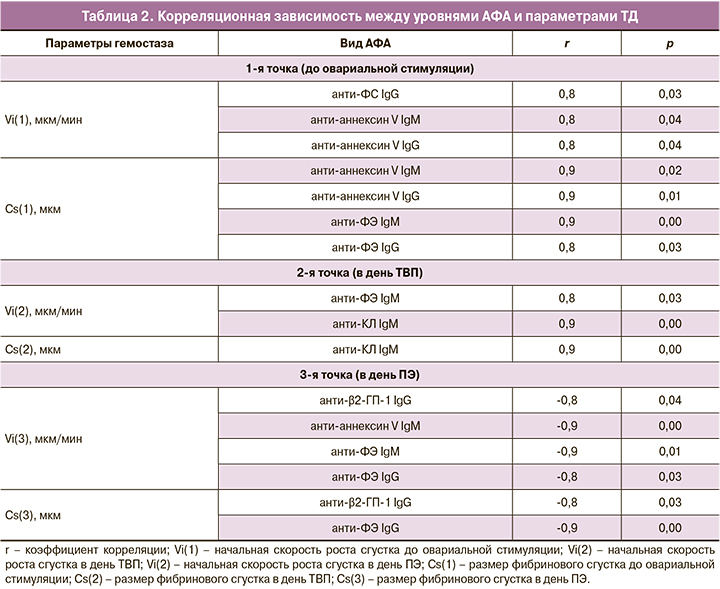
Было отмечено, что до овариальной стимуляции и в день ТВП отмечались положительные корреляционные связи между уровнем АФА, начальной скоростью роста сгустка (Vi) и размером фибринового сгустка (Cs). То есть, чем выше был уровень АФА, тем больше были скорость образования и размер сгустка, что свидетельствует о связи уровня АФА и развития гиперкоагуляционного состояния. Интересно, что в день ПЭ были выявлены уже не положительные, а отрицательные корреляционные связи уровня АФА с начальной скоростью роста сгустка (Vi) и размером фибринового сгустка (Cs), что свидетельствует о связи уровня АФА и развития гипокоагуляционного состояния ко дню ПЭ. При этом корреляционные связи были отмечены в основном у некритериальных антител к аннексину V, ФЭ, ФС.
При оценке факта формирования спонтанного сгустка в плазме крови, не контактирующей с активирующей поверхностью (Т), было выявлено, что у пациенток с формированием сгустка в день ПЭ был погранично значимо выше уровень IgM-антител к аннексину V (р=0,07).
При проведении корреляционного анализа между параметрами ТД и дозой экзогенно вводимых гонадотропинов для овариальной стимуляции была выявлена статистически значимая сильная положительная связь между дозой гонадотропина и параметром Cs(3) (r=0,7368; p=0,05).
Обсуждение
В основе патогенеза бесплодия и осложнений беременности при антифосфолипидном синдроме лежит воздействие АФА на эндотелиальные клетки с развитием эндотелиальной дисфункции и повышенным риском тромбообразования и на клетки трофобласта с развитием провоспалительной реакции, нейтрофильной инфильтрации, выработкой провоспалительных цитокинов и активацией системы комплемента, что приводит к торможению роста трофобласта [5, 13]. Был проведен ряд исследований, посвященных изучению взаимосвязи антифосфолипидного синдрома, изолированного носительства АФА c исходами программ ВРТ. Если роль антифосфолипидного синдрома и АФА в патогенезе невынашивания беременности является очевидной и доказанной, то их роль в развитии бесплодия и неудач программ ВРТ остается дискуссионной. В нашем исследовании было показано, что персистенция так называемых некритериальных АФА снижает шансы наступления беременности в программах ВРТ в 4,34 раза.
Наши данные не согласуются с данными Chighizola et al. (2014), проанализировавших 29 исследований, в которых изучалась взаимосвязь между носительством АФА и исходами программ ВРТ [10]. Несмотря на то что в 44,8% исследований была выявлена зависимость исходов ВРТ от повышенных титров АФА, авторы обзора отметили высокую гетерогенность групп пациенток, использование разных диагностических критериев для оценки титра АФА, определение различных типов и классов АФА. В результате был сделан вывод о том, что связь между повышенными титрами АФА и бесплодием, а также исходами ВРТ в настоящее время является недоказанной.
При этом наши данные согласуются с данными Di Rosa et al. (2019), которые в своем исследовании с участием 520 пациенток выявили связь АФА с исходами программ ВРТ [12]. Наиболее часто определялись повышенные титры волчаночного антикоагулянта (53,49%), антитела к КЛ (44,19%) и β2-ГП-1 (25,58%). При этом 6,73% пациенток имели диагнозы системных аутоиммунных заболеваний, в том числе 3,27% – антифосфолипидного синдрома. Авторы отмечают, что у части пациенток (4,6%) с повышенным титром АФА отсутствовали классические клинические проявления антифосфолипидного синдрома, тем не менее в анамнезе чаще отмечались неблагоприятные исходы беременности, в том числе неудачи имплантации в программах ВРТ. В результате было сделано предположение, что спектр клинических проявлений антифосфолипидного синдрома может быть шире утвержденных классических клинических критериев. В связи с этим авторы исследования рекомендуют проводить обследование на наличие АФА всем пациенткам программ ВРТ с целью ранней коррекции возможных нарушений имплантации и течения беременности.
Также похожие данные были приведены в систематическом обзоре Di Nisio et al. (2011) [8]. По результатам метаанализа, включающего 29 когортных исследований, а также исследования случай-контроль (5270 пациенток), персистенция АФА увеличивала риск неудач программ ВРТ в 3,3 раза (ОШ=3,33; 95% ДИ 1,77–6,26). При этом именно некритериальные АФА играли роль в неудачах имплантации.
По данным отечественных исследователей (Khizroeva et al., 2018), частота носительства АФА у пациенток с неудачными исходами программ ВРТ (42,9%) выше по сравнению с пациентками с состоявшейся беременностью (19,1%) [11]. При этом чаще выявляются антитела к β2-ГП-1 (31,4%), аннексину V (24,7%) и КЛ (8,9%). Авторы предлагают рассматривать повышенный титр АФА как временное противопоказание к проведению программ ВРТ.
Учитывая неоднозначные результаты предыдущих исследований, пациенткам с персистенцией АФА необходимо проведение комплексного исследования системы гемостаза. В нашем исследовании с помощью теста ТД было показано, что до овариальной стимуляции и сразу после нее (в день ТВП) отмечался более высокий уровень АФА, связанный с развитием гиперкоагуляционного состояния, тогда как через 5 дней после прекращения введения гонадотропина наблюдалась обратная тенденция в сторону развития гипокоагуляции. Более высокий уровень АФА после овариальной стимуляции ассоциировался со спонтанным формированием фибриновых сгустков, свидетельствующим о выраженной гиперкоагуляции, что может быть обусловлено наличием в образце плазмы собственных прокоагулянтных компонентов, а именно микровезикул, активных факторов свертывания, следов тканевого фактора. При этом отмечалась связь между параметрами ТД и дозой вводимых гонадотропинов.
Выводы
Персистенция АФА уменьшает шансы наступления беременности в 4,34 раза (95% ДИ 1,04–20,22). АФА, оказывающие негативное влияние на ЧНБ в программах ВРТ, в основном представлены некритериальными антителами к ФС, ФЭ и аннексину V. Между уровнем АФА и параметрами ТД отмечается сильная корреляционная связь, отражающая развитие гиперкоагуляционного состояния крови, которое после проведения овариальной стимуляции сменяется гипокоагуляционным состоянием потребления, связанным с дозой вводимых гонадотропинов, что может представлять один из патогенетических механизмов неудач имплантации в программах ВРТ.



